Введение
Актуальной задачей биотехнологии является получение пребиотиков - веществ для поддержания нормальной микрофлоры желудочно-кишечного тракта. К таким веществамотносятся различные фруктозиды. Доказано, что инулин и олигофрутозиды избирательно стимулируют рост и метаболическую активность бифидо- и лактобактерий, не влияя на рост других бактерий и подавляя рост потенциально патогенных бактерий [1,2,3]. Одним из способов получения фруктоолигосахаридов является ферментативный гидролиз инулинсодержащего сырья. Несмотря на многочисленные исследования инулиназ - ферментов, гидролизующих инулин, данные по получению эндо-инулиназ немногочисленны [4,5,6]. Отсутствуют высокоактивные ферментные препараты, способствующие превращению инулинсодержащего сырья во фруктозиды различной степени полимеризации.
Целью работы явилось определение оптимальных условий биосинтеза дрожжей - продуцента активной эндо-инулиназы, получение высокоочищенного препарата фермента и изучение его физико-химических свойств.
Материалы и методы
Объектом исследования служили селекционированные авторами дрожжи Saccharomycescerevisiae ВГШ-2, обладающие способностью к интенсивному биосинтезу эндо-инулазы [7]. Дрожжи культивировали жидкофазным способом на несменяемой среде (частота вращения 4с-1, уровень аэрации 1,4 г О2/дм3; температура 32-34оС; рН 4,8; объем питательной среды 100 см3). По окончании выращивания(24 ч) дрожжи отделяли центрифугированием при 8000 об/мин
в течение 15 мин, промывали водой, отпрессовывали до влажности 75 %.
Извлечение фермента осуществляли путем разрушения клеток дрожжей с помощью ультразвукового дезинтегратора УЗДН-2Т при мощности 500 Вт и частоте 22 кГц в течение 2-х мин в ледяной бане. Гомогенат использовали для получения водной вытяжки (10 %) путем настаивания в течение
20 мин при (20±2оС) и центрифугирования при 8000 об/мин в течение 10 мин. Saccharomycescerevisiae охлаждали до 2-4оС и проводили очистку ферментного препарата.
Для получения высокоочищенного препарата инулиназу осаждали из водной вытяжки изопропиловым спиртом в соотношении объемов 1:1,5 при температуре смеси 2-4°С. Осадок, содержащий фермент, отделяли центрифугированием в течение 10 мин. Осажденный фермент растворяли в 0,1 М ацетатном буфере, рН 4,5, наносилина колонку размером 21,5´150 мм и элюировали тем же буфером со скоростью 1 мл за 5 мин. В ходе очистки инулиназы применяли сефадекс G-25 (для освобождения фермента от низкомолекулярных примесей и разделения с близкими по размерам белковыми молекулами). Далее проводили гель-фильтрацию на колонке с сефадексом G-100. Содержание белка во фракциях определяли по методу Лоури.
Активность инулиназы определяли резорциновым методом по реакции Селиванова, используя в качестве субстрата инулин (Spofa, Прага).
Для выращивания дрожжейS.cerevisiae использовали синтетическую среду Ридера с глюкозой в качестве источника углерода (среда №1), пивное сусло (среда №2), дрожжевую питательную среду следующего состава (%): пептон - 1,0; дрожжевой экстракт - 0,5; глюкоза - 2; рН среды от 5,5 до 8,0 (среда № 3).
Обсуждение результатов
Известно, что в дрожжевой клетке β-фруктофуранозидаза прочно с ней связана и переходит в водные экстракты в незначительных количествах. Это подтверждают и наши исследования, как в отношении инвертазы, так и инулиназы. Культивирование дрожжей проводили на питательной среде № 2. Об активности ферментов судили по накоплению редуцирующих веществ. При изучении способности внутри- и внеклеточных гликозидаз дрожжей S. cerevisiae гидролизовать 5 % раствор сахарозы и инулина (рис. 1) было установлено, что наибольшая активность ферментов (95-97 %) сосредоточена внутри клетки, поэтому дальнейшие исследования проводили с внутриклеточными ферментами.
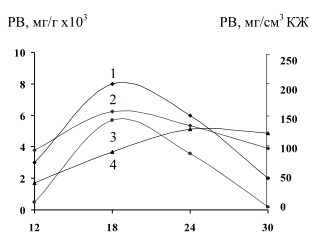
Рис.1. Гидролиз сахарозы (РВ, мг)внутриклеточными (1,2) ивнеклеточными (3,4)
гликозидазами S.cerevisiae ВГШ-2. 1,3 - инулиназа; 2,4 - инвертаза
Использование питательных сред разного состава для биосинтеза гликозидаз показало (рис. 2), что наибольшая активность β-фруктофуранозидазы и инулиназы (640и 110 ед/г биомассы, соответственно) наблюдалась при культивировании дрожжей в течение 24-х ч на среде №2. чтобы исключить влияние на биосинтез ферментов мальтозы,азотсодержащих и минеральных веществ, которые входят в состав пивного сусла в количестве(%): 58,95, 4,34 и 1,53 соответственно, дальнейшие исследования проводили на дрожжевой среде, активность инвертазы на которой составила 600 и инулиназы - 390 ед/г сырой биомассы дрожжей. Соотношениеинвертаза/инулиназа составило 1,5 : 1,0.
Далее перед нами стояла задача - подобрать состав среды, обеспечивающий изменение соотношения в сторону увеличения синтеза инулиназы.
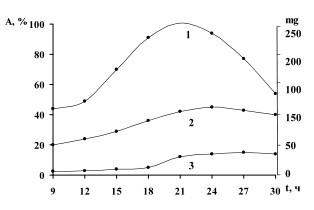
Рис.2. Изменение активности инулиназы, синтезируемой Saccharomycescerevisiae ВГШ-2 при культивировании на различных питательных средах. А - активность инулиназы;
t - продолжительность культивирования, ч; 1 - пивное сусло; 2 - дрожжевая среда;
3 - синтетическая среда Ридера
Для определения влиянияразличных углеводов на рост дрожжей S. cerevisiae ВГШ-2 и синтез имиинулиназы в питательную среду поочередно включали моносахариды, олигосахариды и полисахариды. Углеводы вносили в количестве 1 % по углероду в питательную среду, содержащую 1,0 % масс.пептонаи 0,5 % масс. дрожжевого экстракта,рН 4,5-6,0. Результаты исследований представлены в табл. 1.
Таблица 1
Влияние источника углерода на биосинтез инулиназы дрожжей S.cerevisiae ВГШ-2
|
Источник углерода |
Активность инулиназы |
Количество дрожжевых клеток |
|
Глюкоза - контроль |
500 |
870 |
|
Фруктоза |
980 |
995 |
|
Рамноза |
20 |
100 |
|
Инулин |
760 |
1095 |
|
Арабиноза |
20 |
135 |
|
Сахароза |
850 |
1060 |
|
Лактоза |
30 |
400 |
|
Мальтоза |
210 |
727 |
|
Раффиноза |
230 |
560 |
|
Крахмал |
70 |
680 |
|
Галактоза |
110 |
430 |
Из табл.1 следует, что все источники углерода по способности к биосинтезу инулиназы можно расположить в сле-дующий нисходящий ряд: фруктоза→сахароза→инулин→глюкоза→раффиноза→
мальтоза→галактоза→крахмал→лактоза→арабиноза→рамноза. Количество образующейся биомассы на средах с различными источниками углерода также было различным. Наибольшее накопление дрожжевых клеток наблюдалось при выращивании их на среде с инулином, сахарозой, фруктозой и глюкозой. Однако строгой корреляции между накоплением клеток в культуре дрожжей и биосинтезом фермента установлено не было.
Наряду с углеродом в процессе биосинтеза ферментов большое значение имеют также источники азота. Для выявления наилучших источников азота при биосинтезе инулиназы S. сerevisiaeВГШ-2 нами были испытаны минеральные соли: (NH4)2SO4, (NH4)2HPO4, NH4H2PO4, NH4Cl, NaNO3, KNO3 и источники органического азота: кукурузный экстракт, солодовый экстракт, дрожжевой экстракт. Их дозировали в количестве 0,086 % по азоту. Влияние источников углерода исследовали на фоне фруктозы, которую использовали в количестве 2,5 % к массесреды (табл. 2).
Таблица 2
влияние источника азота на биосинтез инулиназы дрожжей S. сerevisiae ВГШ-2
|
Источник азота |
Активность инулиназы, % от максимальной |
Количество дрожжевых клеток |
|
KNO3 |
68 |
14,5 |
|
NaNO3 |
24 |
11,2 |
|
NH4NO3 |
34 |
12,1 |
|
(NH4)2HPO4 |
57 |
10,1 |
|
NH4H2PO4 |
100 |
10,3 |
|
(NH4)2SO4 |
47 |
18,4 |
|
Дрожжевой экстракт |
60 |
20,9 |
|
Кукурузный экстракт |
36 |
17,69 |
|
Солодовый экстракт |
18 |
8,965 |
Из табл. 2 видно, что лучшим из минеральных солей оказался NH4H2PO4; среди источников органического азота - дрожжевой экстракт. Интенсивный синтез фермента в присутствии аммонийных солей фосфорной кислоты можно объяснить тем, что они являются как источником азота, так и источником фосфора. Последний, как известно, играет важную роль в биоэнергетике клетки.
С целью оптимизации условий биосинтеза инулиназы в качестве основных факторов, влияющих на биосинтез инулиназы дрожжей S. cerevisiae, были выбраны: х1- температура культивирования, оС; х2 - продолжительность процесса культивирования, ч; х3 - исходная величина рН питательной среды; х4 - концентрацияNH4H2PO4,%; х5 - концентрация фруктозы, %. Все эти факторы не совместимы и не коррелируют между собой. Пределы изменения этих факторов приведены в таблице 3.
Таблица 3
Пределы изменения факторов при биосинтезе инулазы дрожжей S.сerevisiae ВГШ-2
|
Условия планирования |
Факторы |
||||
|
х1, оС |
х2, ч |
х3, |
х4, % |
Х5, % |
|
|
Основной уровень (0) |
35 |
24 |
4,5 |
0,6 |
2,5 |
|
Интервал варьирования ∆ |
5 |
6 |
0,5 |
0,2 |
0,5 |
|
Верхний уровень (+1) |
40 |
30 |
5,0 |
0,8 |
5,0 |
|
Нижний уровень (-1) |
30 |
18 |
6,0 |
0,4 |
2,0 |
|
Верхняя «звездная точка» (+2) |
45 |
36 |
5,5 |
1,0 |
3,5 |
|
Нижняя «звездная точка» (-2) |
25 |
12 |
3,5 |
0,2 |
1,5 |
Критерием оценки влияния различных факторов на биосинтез инулиназы была активность фермента, содержащегося в клетках дрожжевой биомассы (Y, ед/г биомассы).
Программа исследований закладывалась в матрицу планирования экспериментов. В исследованиях использовали полный факторный эксперимент 25 с применением центрального композиционного рототабельного униформпланирования. Порядок опытов рандомизировали посредством таблицы случайных чисел, что исключало влияние неконтролируемых параметров на результаты эксперимента.
Статистическая обработка экспериментальных данных позволила получить уравнение регрессии (1), описывающее процесс биосинтеза инулиназы под влиянием исследуемых факторов ед/см3:
Y=990,058 - 206,408 х1 + 190,651 х2 + 216,308 х3 + 90,986 х4- 102,384 х5 - 207,082 х1х2 - 147,438 х1х3 - 51,188 х1х4 + 92,688 х1х5 + 111,063 х2х3 + 183,312 х2х4 +127,688 х2х5 +74,468 х3х4 - 82,988 х2х5- 75,238 х4х5 - 157,803 х12+ 1,197 х22 20,928 х32 - 145,053 х42 - 170,053 х52. (1)
Анализполученных данных позволил выделить факторы, оказывающие наибольшее влияние на процесс биосинтеза инулиназы дрожжами S.сerevisiae ВГШ-2, это - температура и продолжительность культивирования. В меньшей степени влияликонцентрация фруктозы и гидрофасфата аммония. Отношение коэффициентов перед линейными членами, показывающее степень влияния факторов друг на друга, оказались равными х2/х1=-0,899;х3/х1 = -0,763;х4/х1=-0,347;х5/х1 = -0,477; х3/х2=0,098;х4/х2 = 0,399; х5/х2= 0,388; х4/х3= 0,216; х5/х3=-0,383;х5/х4 = -0,496. Таким образом, уравнение (1) позволило получить информацию о влиянии факторов и их взаимодействии на биосинтез инулиназы. Данный подход позволил выбрать оптимальные условия, обеспечивающие максимальный биосинтез инулиназы: температура культивированиях1= 300 С, продол-жительность биосинтеза х2=30 ч, начальное значение рН среды х3=5,0, концентрацияNH4H2PO4 х4=0,8 %, концентрация фруктозы х5=3 %. В этом случае активность инулиназы составила Y=1998,2 ед/г дрожжей.
Изучение физико-химических свойств ферментов требует их высокой степени очистки. Результаты по очистке представлены в таблице 4. В результате очистки был получен ферментный препарат со степенью очистки 88,9 и удельной активностью378,75 ед/г белка.
Таблица 4
Очистка инулиназыS. сerevisiae ВГШ-2
|
Стадии очистки |
Активность инулиназы, ед |
Количество белка, мг |
Удельная активность, ед/мг белка |
Степень очистки |
Выход, % |
|
Водная вытяжка дрожжей |
4417,0 |
738,0 |
5,98 |
1,00 |
100 |
|
Осаждение изопропанолом в соотношении объемов 1:1,5 |
2517,7 |
243,2 |
10,35 |
1,73 |
95 |
|
Гель-фильтрация |
1104,3 |
11,69 |
93,46 |
15,62 |
87 |
|
Гель-фильтрация |
60,6 |
0,16 |
378,75 |
63,33 |
75 |
Эксперименты по исследованию влияния температуры и рН на каталитическую активность инулиназы (рис.3) показали,
что температурный оптимум действия
фермента лежит в пределах 43-46оС. Кривая рН-активности имеет характерную для многих ферментов колоколообразную форму с максимумом 4,5-4,7.
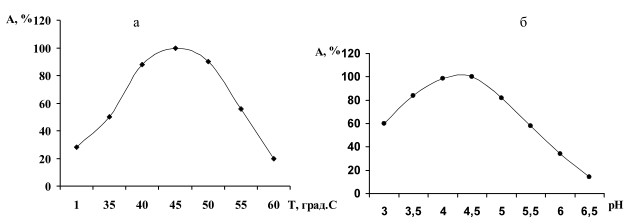
Рис.3. Влияние температуры (а) и рН (б) на каталитическую активность инулиназы дрожжей S.cerevisiae
Выводы
- Исследование локализации фермента в дрожжевой клетке показало, что дрожжиS.cerevisiae ВГШ-2синтезируют внутриклеточную инулиназу.
- Исследования по влиянию различных углеводов на биосинтез инулиназы показали, что она относится к индуцибельным ферментам. Индуцирование синтеза фермента происходит под действием фруктозы, сахарозы и инулина. Относительно низкий уровень активности на среде с глюкозой косвенно свидетельствует о том, что глюкоза, вероятно, является катаболитным ингибитором.
- Методом статистической обработки экспериментальных данных былиподобраны оптимальные параметры процесса культивирования дрожжей, обеспечивающие максимальный синтеза инулиназы: состав питательной среды(%): дрожжевой экстракт - 2;NH4H2PO4 - 0,8, фруктоза - 3; начальное значение рН среды 5,0; температура культивирования 30°C, продолжительность 30 ч.
- Оптимальными параметрами каталитической активности инулиназы следуетсчитать: рН 4,5-4,7; температуру 45-47оС; концентрацию субстрата 5х10-7 моль/л.
Список литературы
- Menne E., Guggenbuhl N., Roberfroid M. Fn-type chicory inulin hydrolysate has a prebiotic effect in humans.// J. Nutr. 2000. №130 Р.1197-1199.
- Delzenne N.M., Kok N. Effects of fructans-type prebiotics on lipid metabolism. //Am J Clin Nutr. 2001 №73Р.456-458.
- Grizard D., Barthomeuf C. Non-digestible oligosaccharides used as prebiotic agents: mode of production and beneficial effects on animal and human health. //Reprod. Nutr. 1999 Dev.39Р.563-588.
- Kulminskaya A.A., Arand M., Eney-skayaE.V., Ivanen D.R., Shabalin K.A., Shishlyannikov S.M., Saveliev A.N., Korneeva O.S., Neustroev K.N. Biochemical characterization of Aspergillus awamori exoinulinase: substrate binding characteristics and regioselectivity of hydrolysis.// Biochim. Biophys. 2003.Acta. 1650Р.22-29.
- Pandey A., Soccol C.R., Selvakumar P., Soccol V.T., Krieger N., Fontana J.D. Recent developments in microbial inulinases. Its production, properties, and industrial applications.// Appl. Biochem. Biotechnol. 1999. №81.Р.35-52.
- Baumgartner S., Praznik W. Purification of exo- and endoinulinase from crude inulinase extract for the analysis of fructans.// Int. J. Biol. Macromol. 1995, №17Р.247-250.



