Разработка теории и методов расчета свойств веществ, исходя из сведений о строении молекул, составляет фундаментальную научную задачу химии. Наличие надежных расчетных методов исследования позволяет предсказывать характеристики вещества (прежде, чем оно синтезировано, а свойство измерено) и тем самым выбрать из многих (ещё не изученных и даже не полученных) соединений те, которые (согласно прогнозу) удовлетворяют поставленным требованиям. Это закладывает научные основы создания новых веществ и материалов с заранее заданными свойствами.
Авторами разработана методология построения методов расчета термохимических характеристик радикальных реакций, включающая в себя следующие этапы:
1. Выбор объектов исследования с выделением базовых соединений, генерирование и систематизация структур на множестве выбранных объектов (при помощи методов теории перечисления графов).
2. Анализ состояния числовых данных по свойству P для данного круга соединений и реакций: их cбор, экспертная оценка, упорядочение по рядам сходных молекул и т.д. Отбор ключевых соединений (и реакций), сопоставление данных, установление взаимосогласованности и надежности значений и т.п.
Необходимо отметить, что экспериментальные сведения о термохимических характеристиках радикальных реакций весьма скудны и порой разноречивы. Так, для энергий разрыва связей D (тепловых эффектов распада) галогензамещенных метана (при 298 К) согласно [1] имеются 14 значений D для связей С-Н (из 35), 13 значений D для связей С-F (из 35), 12 значений D для связей С-Cl (из 35), 13 значений D для связей С-Br (из 35), 9 значений D для связей С-I (из 35).
3. Выбор методов расчета. На основе развитой нами ранее феноменологической концепции попарных и более сложных взаимодействий атомов (атом-атомное представление) [2-6] разработаны расчетные методы определения и предсказания энергий разрыва связей (D), тепловых эффектов (q), энергий активаций (e†) и логарифмов констант скоростей (lg k) реакций радикального распада и замещения.
Рассмотрим реакции радикального распада вида
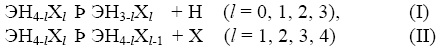
(Э = С, Si,… ; X = D, T, F,…,) и радикального замещения вида
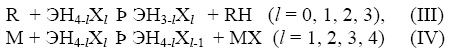
(Э = С, Si,…; X = D, T, F,…, R = Сl, CH3, ... ; M=Na).
Тепловые эффекты реакций (I)-(IV) могут быть выражены через энтальпии образования исходных и образующихся частиц . При учете парных взаимодействий атомов получаем:
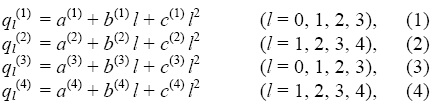
где a(1), b(1), c(1), a(2),…– параметры, выражающиеся через валентные и невалентные взаимо-действия атомов.
Энергии активации реакций (I)-(IV)– это разности между энергией активированного комплекса (переходного состояния) вида
H…ЭH3-lXl или X…ЭH4-lXl-1 ,
R…H…ЭH3-lXl или M…X…ЭH4-lXl-1.
Энергии этих комплексов можно выразить через атом-атомные взаимодействия [2] в виде (1)-(4). В таком же виде можно записать энергии активаций:
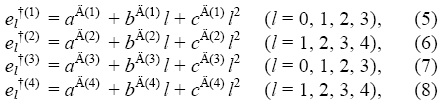
(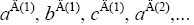 – некоторые параметры).
– некоторые параметры).
Константы скорости реакций (I)-(IV) подчиняются (в определенном температурном интервале) уравнению Аррениуса, которое (в логарифмической форме) имеет вид lg k = lgZ – e†/RT, где e† – энергия активации, а Z – предэкспоненциальный множитель. Мы полагаем, что Z в серии однотипных реакций близки (т.е. Zl(1)≈, Z(1) , Zl(2)≈Z(2)). Логарифмы констант скоростей рассматриваемых реакций можно представить как:
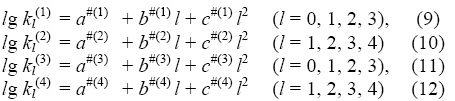
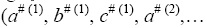 – некоторые параметры).
– некоторые параметры).
Формулы (1)-(12) можно распространить на частицы (молекулы и радикалы) с большим числом разноимённых заместителей.
4. Число параметров схем, их определение. Предсказательная сила теории.
Неизвестные параметры определяются в феноменологическом подходе через исходные экспериментальные (опорные) данные. Предсказательная способность теории с ростом числа разноименных заместителей k заметно возрастает.
Если известно большее количество надёжных данных, то можно расширить исходную (обучающую) выборку и методом наименьших квадратов (МНК) найти наилучшие значения параметров, а затем уже производить численные расчеты свойств и делать предсказания (вне данной выборки).
5. Взаимосвязь между схемами расчета. Установлена связь формул (1), (10),… с другими методами в разных приближениях: линейном (схемы Фаянса, П. Маслова, М. Карапетьянца), квадратичном (схемы Лайдлера, Бенсона, Цана, Бернштейна) и кубическом (схемы Аллена, Сомаяюлу – Кудхадкера – Зволинского) и др. [2-5].
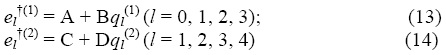
(А и В, C и D– постоянные). Формулы (13) и (14) выражают известное правило Полани-Семенова [7;8]). Линейные соотношения получаются в этом случае также между логарифмами констант скоростей и тепловыми эффектами (энергиями разрыва связей), между логарифами констант скоростей и энергиями активаций реакций и т.д.
Определенные взаимоотношения можно установить между рассматриваемым подходом и методами Моина [9], Сабо [10] , Гаммета [11] и др. [2,8,12 ]
6. Численные расчеты. Систематизация данных. Нами были проведены расчеты тепловых эффектов (q), энергий активаций (e†) и логарифмов констант скоростей (lg k) ряда реакций [2-6,15]. Результаты расчетов, как правило, хорошо согласуются с экспериментом. Сделаны предсказания.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект 07-03-96403-рЦентр-а)
СПИСОК ЛИТЕРАТУРЫ:
- Гурвич Л.В., Карачевцев Г.В., Кондратьев В.Н., Лебедев Ю.А., Медведев В.А., Потапов В.К., Ходеев Ю.С. Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. М.: Наука, 1974. 351 с.
- Папулов Ю.Г., Виноградова М.Г. Расчетные методы в атом-атомном представлении: Монография. Тверь: ТвГУ, 2002. 232 с.
- Папулов Ю.Г., Виноградова М.Г. Исследование связи свойств веществ со строением молекул на основе феноменологической модели молекулы как системы взаимодействующих атомов // Журн. физ. химии. 1996. Т. 70, № 6. С. 1059-1065.
- Papulov Yu.G., Vinogradova M.G. Relations between the properties of substances and their molecular structure: phenomenological study of substituted methanes and their analogs // Mathematical models of non-linear exitations, transfer, dynamics, and control in condensed
- Папулов Ю.Г., Виноградова М.Г. Феноменологические методы исследования взаимосвязи «структура – свойство» в атом-атомном представлении: Обзор // Вестн. Тверск. гос. ун-та. Сер. Химия, 2005. Вып. 2. С. 5-40.
- Папулов Ю.Г., Виноградова М.Г. Энергия химических связей: основные закономерности и методы расчета: Обзор // Вестн. Тверск. гос. ун-та. Сер.«Химия». 2006. Вып. 3. С. 5-39.
- Семенов Н.Н. О некоторых проблемах химической кинетики и реакционной способности. М.: Изд-во АН СССР. 1958. 686 с.
- Кондратьев В.Н., Никитин Е.Е., Резников А.И., Уманский С.Я. Термические бимо-лекулярные реакции в газах. М.: Наука, 1976. 192 с.
- Моин Ф.Б. Расчет энергии активации химических реакций на основе принципа аддитивности // Успехи химии. 1967. Т. 36, .№7. С. 1223-1243.
- Сабо З.Г. Классификация гомогенных газовых реакций и расчет энергий активации // Химическая кинетика и цепные реакции. К семидесятилетию академика Н.Н. Семенова. М.: Наука, 1966. С. 46-60.
- Гаммет Л. Основы физической органической химии: Пер. с англ. М.: Мир, 1972. 534 с.



