Злокачественные новообразования мягких тканей остаются одним из самых сложных разделов онкологии, как в диагностике, так и прогнозировании течения заболевания [1]. Одной из редких локализаций злокачественных неоплазий этой группы является лейомиосаркома (ЛМС) тела матки, хотя из всех неэпителиальных опухолей она встречается значительно чаще - в 25-60 % [2; 3]. В целом, ЛМС составляет 1-1,3 % злокачественных новообразований матки [4] и 25-60 % сарком матки [5]. При этом ряд авторов считает, что данная опухоль практически нечувствительна к химио- и лучевой терапии [6; 7] и причины остаются неизвестными. Следует отметить, что, с точки зрения гистологических вариантов, опухоли ЛМС ‒ достаточно гетерогенная группа, включающая в себя наиболее часто встречающиеся формы ‒ веретеноклеточный и эпителиоидноклеточный варианты [8]. В редких случаях выделяют и еще один вариант опухоли - миксоидную [9]. Вместе с тем достаточно часто патолог сталкивается с ЛМС тела матки, одним из компонентов которой являются многоядерные клетки, причем иногда охватывающие значительный объем опухоли. Безусловно, многоядерные клетки в мезенхимальных злокачественных опухолях - явление достаточно частое и может входить в понятие опухолевого полиморфизма, но регулярность встречаемости таких типов опухоли позволяет рассмотреть их отдельно. Однако отсутствие соответствующей рубрики в классификации ВОЗ не позволяло до настоящего времени оценить клинико-морфологические характеристики и особенности экспрессии биомолекулярных маркеров в опухолях такого типа.
Цель исследования, исходя из вышеизложенного, ‒ определить клинико-морфологические и молекулярно-биологические характеристики ЛМС тела матки с большим количеством многоядерных клеток в своем составе и прогноз больных с таким типом неоплазии.
Материалы и методы исследования
В исследование включили 198 лейомиосарком, удаленных по поводу быстрорастущей опухоли тела за период 1996-2008 годов в Алтайском крае. Изучению подвергали образцы опухоли (центр и периферия), исследовали неизмененный миометрий перитуморозной зоны (не более 0,5-1 см от опухоли). С точки зрения клинико-морфологических данных, оценивали состояние репродуктивной функции, возраст больных лейомиосаркомой, размер и локализацию образования, количество неоплазий в теле матки. Препараты окрашивали гематоксилином и эозином, железным гематоксилином по Гейнденгайну, пикрофуксином по Ван-Гизону. Параллельно гистологические срезы окрашивали нитратом серебра по методу Howell W.M. и Black D.A., 1980 в модификации Боброва И.П. и соавт., 2002 для определения активности аргирофильных белков области ядрышкового организатора (AgNOR). Для исследования НАД(Ф)-зависимых дегидрогеназ на замораживающем микротоме готовили срезы толщиной 10-15 мкм, наклеивали на стекло и инкубировали в субстрате соответствующего фермента: НАДН2-диафораза (IUBMB 1.6.99.1), сукцинатдегирогеназа СДГ (IUBMB 1.3.99.1) и лактатдегидрогеназа ЛДГ (IUBMB 1.1.1.27). Ядра докрашивали 0,1 %-м водным раствором нильского голубого. Активность ферментов в гладкомышечных клетках оценивали количественным методом Нарциссова Р.П., основанным на подсчете образованных в клетке видимых гранул формазана, при использовании n-нитротетразолия фиолетового. Микроциркуляторное русло с целью исследования особенностей архитектоники изучали на свежезамороженных нефиксированных срезах опухоли толщиной 30-40 мкм, окрашенных на щелочную фосфатазу по Гомори ЩФ (IUBMB 3.1.3.1). Морфоденситометрические особенности клеток опухоли (плоидность и площадь ядер) выявляли на срезах, окрашенных по Фельгену. При определении гистограмм плоидности за эталон 2с принимали малый тканевой лимфоцит. Использовали иммуногистохимический способ с полимерной системой визуализации BioGenex Super Sensitive Polymer-HRP Detection System/DAB. Для дифференциальной диагностики использовали панель, состоящую из виментина, десмина, гладкомышечного актина и CD68, а опухоль считали гладкомышечного гистогенеза при умеренной либо выраженной цитоплазматической позитивной реакции к SMAα. Плотность сосудов микроциркуляторного русла (ПМЦР) оценивали на позитивно окрашенном эндотелии CD31 на 2 мм². Пролиферативную активность оценивали по уровню экспрессии Ki-67 (клон MIB-1), количество клеток в S-фазе оценивали по BrdU-метке: для предобработки использовали раствор BrdU (Sigma B 5002,7 mg/ml saline; Sigma), который вводили в маточную артерию и инкубировали при температуре 37 °С 24 часа. Далее, вместо предобработки 2М HCL и последующим использованием протеазы по Harms G. et al., 1986 мы использовали обработку в цитратном буфере с рН 6.0 в модификации Tang X. et al., 2007 [10]. Оценивали экспрессию белков-регуляторов апоптоза Bcl-2 (клон МКА 124) и p53 (клон DO-7). Определяли активность фермента-гиразы Topoisomerase IIα (клон Ki-S). Оценивали локализацию молекулярного шаперона HSP70 (клон W27) в клетке и оценивали рецепторный статус неоплазии по экспрессии рецепторов прогестерона (клон PgR636) и эстрогена α (1D5) по методике согласно ER/PR pharmDx. Оценивали экспрессию коллагена общего типа. Для оценки полученных результатов использовали компьютерный анализатор с программой Image Tool 3.0 и Image J в автоматическом и ручном режимах просчета - количество коллагена в процентном соотношении, площадь и плоидность и количество аргирофильных гранул в ядре клетки (кариоплазматический и нуклеолярные кластеры). Прогноз оценивали, исследуя 10-летнюю выживаемость по Каплан-Мейеру, проводили многофакторный регрессионный анализ по Коксу. Статистическую обработку проводили при помощи программы Statistica 6.0, корреляцию определяли по Пирсону.
Результаты исследования и их обсуждение
Лейомиосаркома с большим количеством многоядерных клеток (ЛМСБКМ) наиболее часто выглядела как веретеноклеточная гладкомышечная опухоль со всеми светооптическими признаками злокачественности и с широкими полями многоядерных клеток, занимающих не менее 10 % от общих структур (рис. 1). В случаях с высокой степенью опухолевой анаплазии на светооптическом уровне такие компоненты опухоли было невозможно отличить от фиброзной гистиоциомы либо гигантоклеточной опухоли, что требовало ИГХ диагностики с, как правило, отрицательной реакцией к CD68 и позитивной к SMA (рис. 2, 3). Реже такие структуры встретились нам в эпителиоидных ЛМС тела матки. Поскольку неоплазия с такого типа структурами в большей степени регистрировалась в веретеноклеточных саркомах, то в последующем сравнение параметров проводили именно с ней. Веретеноклеточная лейомиосаркома (ЛМСВ) встретилась нам в 57,6 % случаев, а ЛМСБКМ - в 19,7 % случаев, что было относительно частым показателем. Средний возраст больных ЛМСВ составил 52,3 ± 0,9, а ЛМСБКМ - 54,2 ± 1,6, различия статистически незначимы. В 52,7 % случаев больные с ЛМСВ были менопаузального возраста, а ЛМСБКМ в период менопаузы была отмечена в 46,1 %, что также было сопоставимо. Не было выявлено отличий и в размере неоплазии. Локализация также не имела особенностей при опухолях обоего типа.
Наибольшие различия были выявлены при исследовании биомолекулярных характеристик неоплазии. Избыточная продукция внеклеточного матрикса в виде коллагена общего типа при ЛМСВ была характерна для 5,3 % ± 2,5 случаев, а для ЛМСБКМ - в 23,2 % ± 6,7 случаев, р ≤ 0,05.

Рис. 1. Лейомиосаркома с большим
количеством многоядерных клеток, степень злокачественности G1. Окраска гематоксилин и эозин; ув. х200; в левом верхнем углу
позитивная иммуногистохимическая
реакция к SMA
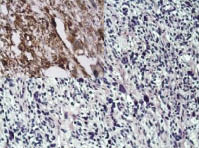
Рис. 2. Лейомиосаркома с большим
количеством многоядерных клеток, степень злокачественности G2. Окраска гематоксилин и эозин; ув. х100; в левом верхнем углу
позитивная иммуногистохимическая
реакция к SMA
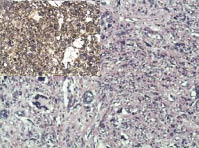
Рис. 3. Лейомиосаркома с большим
количеством многоядерных клеток, степень злокачественности G3. Сложно
дифференцировать с фиброзной
гистиоцитомой. Окраска гематоксилин
и эозин; ув. х200; в левом верхнем углу
позитивная иммуногистохимическая
реакция к SMA
Практически в 69,2 % ± 9 случаев ЛМСБКМ характеризовалась небольшим содержанием коллагена. Метаболическая активность ЛМСБКМ по уровню общего метаболизма была значимо выше, чем в саркомах другого типа, и составила 173,3 ± 5,6 гранулы НАДН2-диафоразы, причем за счет усиления обоих типов метаболизма с усилением ЛДГ и СДГ (инверсия метаболического профиля). При исследовании микроциркуляторного русла, по данным контрастного компьютерного анализа, ЛМСБКМ характеризовались интенсивным окрашиванием эндотелия сосудов на щелочную фосфатазу и наличием множества истинных капиллярных - сосудисто петель вне зон некроза. Кроме того, в большинстве случаев отмечали незавершенность строения некоторых петель и большое количество растущих новообразованных капилляров в зоне свободной от некротических изменений. Простая веретеноклеточная ЛМС была с более завершенным ангиогенезом с преобладанием сосудов модульного типа и небольшим количеством петель и анастомозов. ПМЦР ЛМСБКМ составила 71,4 ± 2,1 на 2 мм², а при ЛМСВ ПМЦР была значимо меньше - 60,4 ± 1,9. При анализе морфоденситометрических характеристик образований обоих типов были получены данные, показывающие значимые различия: при веретеноклеточной ЛМС площадь ядер была 82,2 ± 1,9 мкм², а плоидность - 8,6с ± 0,2. В то же время параметры ЛМСБКМ были значимо выше - площадь ядер была 108,7 ± 6,5 мкм², а плоидность - 12,4с ± 0,7. Количество AgNOR также было значимо выше в ЛМСБКМ, чем в ЛМСВ (30,5 ± 4,1 и 19,8 ± 0,7 соответственно) за счет обоих типов кластеров гранул. Пролиферативная активность имела отличия с большим индексом Ki-67 в ЛМСВ (24,6 % ± 2,5 и 16,5 % ± 2,1 соответственно). Вместе с тем количество клеток с гиперэкспрессией белка было выше в ЛМСБКМ (60,2 % ± 3,2 и 45,7 % ± 2,2 соотв.). Количество клеток в S-фазе цикла по данным BrdU-метки, было выше в ЛМСБКМ (6,8 % ± 0,1 и 4,9 % ± 0,07 соответственно). Активность Bcl-2 была практически одинаковой при всех гистологических типах ЛМС и варьировала от 78 до 81 %. Вместе с тем степень экспрессии значимо варьировала и при ЛМСВ низкую степень отмечали в 21,4 % ± 4,4, а при ЛМСБКМ всего в 9,1 % ± 5 (р ≤ 0,05). Активность белка-активатора апоптоза р53 так же, как и Bcl-2, значимо не различалась между гистологическими вариантами ЛМС, но степень экспрессии также была сопоставима при различных типах ЛМС. Активность и степень экспрессии фермента-гиразы TopoIIα была значимо выше при ЛМСБКМ, чем при ЛМСВ - 23,1 % ± 2,9 и 13,1 % ± 2,6 соответственно по уровню активности. Клеток с выраженной степенью экспрессии фермента было также больше при ЛМСБКМ - 61,5 % ± 8,9 и 37,2 % ± 4,9 соотв. Активность и ядерная транслокация HSP70 не были связаны с гистологическим типом саркомы. Веретеноклеточная ЛМС была чаще позитивнее по отношению к рецепторам прогестерона и эстрогена, чем ЛМСБКМ - 52,6 % ± 4,6 и 38,4 % ± 8,1. Анализ выживаемости показал, что в группах ЛМС всех типов стадии I‒II прогноз был наиболее неблагоприятен при ЛМСБКМ - до 10 лет дожили 9,1 % ± 5 больных, а при ЛМСВ - 66,7 % ± 6,4, что было значимо лучшим показателем (таблица, рис. 4).
Сравнительные молекулярно-биологические характеристики лейомиосаркомы тела матки и 10-летняя выживаемость при гистологической форме веретеноклеточной
лейомиосаркомы и с большим количеством многоядерных клеток
|
Исследуемый маркер |
Тип опухоли |
Различия (р) |
||
|
ЛМСВ |
ЛМСБКМ |
|||
|
ВКМ (+++) |
5,3 % ± 2,5* |
23,2 % ± 6,7 |
р = 0,0002 |
|
|
Метаболизм |
НАДН2 |
140,5 ± 3,1* |
173,3 ± 5,6 |
р = 0,02 |
|
СДГ |
57,9 ± 1,9* |
69,6 ±2,5 |
||
|
ЛДГ |
29,5 ± 1,1* |
34,8 ± 2,7 |
||
|
ПМЦР (CD31) |
60,4 ± 1,9* |
71,4 ± 2,1 |
р = 0,003 |
|
|
Морфо денситометрия |
Площадь (мкм²) |
82,2 ± 1,9* |
108,7 ± 6,5 |
р = 0,004 |
|
Плоидность (с) |
8,6с ± 0,2* |
12,4 ± 0,7 |
||
|
AgNOR (нуклеолярный кластер) |
19,8 ± 0,7* |
30,5 ± 4,1 |
р = 0,0006 |
|
|
Ki-67 |
16,5 % ± 2,1* |
24,6 % ± 2,5 |
р = 0,01 |
|
|
BrdU-метка |
4,9 % ± 0,07* |
6,8 % ± 0,1 |
р = 0,04 |
|
|
Bcl-2 |
21,4 % ± 4,4* |
9,1 % ± 5 |
р = 0,00002 |
|
|
p53 |
20 % ± 3,4 |
28,5 % ± 5,2 |
р = 0,05 |
|
|
Topoisomerase IIα |
13,1 % ± 2,6* |
23,1 % ± 2,9 |
р = 0,0008 |
|
|
Транслокация HSP70 |
50 % ± 10,2 |
42,4 % ± 7,4 |
р = 0,2 |
|
|
Рецепторный статус |
52,6 % ± 4,6* |
38,4 % ± 8,1 |
р = 0,01 |
|
|
10-летняя выживаемость |
66,7 % ± 6,4* |
9,1 % ± 5 |
р = 0,0000001 |
|
Примечание: знаком * отмечены значимые различия при р ≤ 0,05.
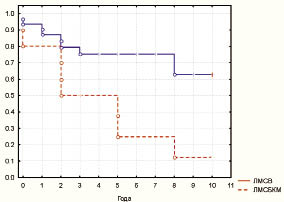
Рис. 4. Зависимость кумулятивной выживаемости
от гистологического типа по Каплан-Мейеру
Заключение. Таким образом, полученные результаты в виде значимых отличий в патоморфологических и молекулярно-биологических параметрах лейомиосаркомы с большим количеством многоядерных клеток и значимо неблагоприятным прогнозом по отношению к другим типам гладкомышечных злокачественных неоплазий этой локализации требуют отдельной констатации в патологанатомическом заключении и в целом могут позволить выделить этот тип лейомиосаркомы в отдельную классификационную рубрику.
Список литературы
- Франк Г.А. Проблемы морфологической классификации и диагностики опухолей мягких тканей // Практическая онкология. - 2004. - Т. 5, №4. - С. 231-236.
- Norris H.J., Zaloudek C.J. Mesenchymal tumors of the uterus. In: Blaustein A. editor. Pathology of the female genital tract. 2nd ed. New York. Springer - Verlag Books; 1982. - Р. 352-392.
- Harry V.N., Narayansingh G.V., Parkin D.E. Uterine leiomyosarcomas: a review of the diagnostic and therapeutic pitfalls // Obstet. and. Gynecol. - 2007. - №9. - Р. 88-94.
- Giuntoli R.L., Metzinger D.S., DiMarco C.S., Cha S.S., Sloan J.A., Keeney G.L., Goustaut B.S. Retrospective review of 208 patients with leiomyosarcoma of the uterus: prognostic indicators, surgical management, and adjuvant therapy // Gynecol. oncol. - 2003. - Vol. 89, №3. - Р. 460 - 469.
- Robboy J., Bentley C., Butnor К, Anderson C. Pathology and Pathophysiology of Uterine Smooth-Muscle Tumors // En. Health Perspectives Suppl. - 2000. - Vol. 108, №S5. - Р. 779-784.
- Dinh T.A., Oliva E.A., Fuller A.F., Lee H., Goodman A. The treatment of uterine leiomyosarcoma. Result from a 10-year experience (1990 - 1999) at the Massachusetts General Hospital // Gynecol. Oncol. - 2004. - Vol. 92, №2. - Р. 648-652.
- Ghaemmaghami F., Zarchi M.K., Gilani M.M., Mousavi A., Behtash N., Chasemi M. Uterine sarcoma: clinicopathological characteristics, treatment and outcome in Iran // Asian pacific J. cancer prev. - 2008. - №9. - Р. 421-426.
- Silva E.C., Bodurka D.C., Scouros M.A., Ayala A.A uterine leiomyosarcoma that became positive for HMB45 in the metastasis // Ann. Diagn. Pathol. - 2005. - №1. -Р. 43-45.
- Vigone A., Giana M., Surico D., Leutner M., Surico N. Massive myxoid leiomyosarcoma of the uterus // Int. Gynecol. Cancer. - 2005. - Vol. 15, № 3. - Р. 564-567.
- Tang X., Douglas L. Fal., Li X., Lane T., Luskin M.B. Antigen-Retrieval Procedure for Bromodeoxyuridine Immunolabeling with Concurrent Labeling of Nuclear DNA and Antigens Damaged by HCl Pretreatment // J. of Neuroscience. - 2007. - Vol. 27(22). - Р. 5837-5844.
Рецензенты:
Лепилов А.В., д.м.н., профессор кафедры патологической анатомии с секционным курсом ГОУ ВПО Алтайский государственный медицинский университет, г. Барнаул;
Талалаев С.В., д.м.н., профессор, зав. кафедрой гистологии ГОУ ВПО Алтайский государственный медицинский университет, г. Барнаул.



