Проблема тромбозов в артериях, венах, микроциркуляторном русле является одной из самых актуальных в современной медицине. Артериальные тромбозы в коронарных сосудах являются основной причиной инфаркта миокарда, они же вызывают почти 90 % нарушений мозгового кровообращения. Окклюзия микроциркуляторного русла в виде различных вариантов внутрисосудистого микросвертывания крови не имеет точной статистической оценки, хотя встречается при многих заболеваниях, сопровождающихся гипертонией, интоксикацией, сепсисом, нарушениями иммунитета и др. [2, 3].
Важную роль в развитии диссеминированного внутрисосудистого свертывания крови играют продукты анаэробного метаболизма, вызывающие ацидоз. Они представляют реальную опасность для организма, так как способны не только нарушать функции, но и приводить к морфологическим изменениям в различных органах и тканях [1, 3, 6]. Накопление молочной кислоты, известной в качестве крупного донора протонов, изменяет гемостатические и реологические свойства крови, усиливает гипоксию тканей и уменьшает функцию энергообразования клеток вследствие разобщения гликолиза и цикла Кребса, снижает ресинтез АТФ и ведет к увеличению энтропии в организме [6, 7]. Влияние ацидоза на показатели гемостаза изучалось многими исследователями [1-3]. Благодаря этому были выявлены основные закономерности изменения функции тромбоцитов, свертывания крови, фибринолиза, антикоагулянтной активности, развития диссеминированного внутрисосудистого свертывания крови (ДВС) и тромбогеморрагического (ТГС) синдромов при ацидотических состояниях. Однако некоторые механизмы остаются не ясными. Наши исследования посвящены изучению влияния различных сдвигов рH на свертывание крови, фибринолиз, агрегацию и дзета-потенциал тромбоцитов.
Методы и организация исследования
Для исследования роли метаболических факторов в механизмах свертывания крови и сосудисто-тромбоцитарного гемостаза были проведены исследования in vitro. На 20 собаках весом от 15 до 25 кг, использованных в качестве доноров, изучали действие различных концентраций молочной кислоты, приготовленных на физ.растворе, на свертывание крови, фибринолиз, показатели сосудисто-тромбоцитарного гемостаза. В экспериментах применялись различные концентрации лактата (от 2,5 до 17 ммоль/л). Пробы крови брали в силиконированные пробирки, содержащие 3,8 % цитрат натрия, так, чтобы конечное соотношение цитрата и крови составляло 1 к 9. Для получения плазмы кровь центрифугировали в течение 10 минут при 1500 об/мин, а плазму, богатую тромбоцитами, для изучения дзета-потенциала и агрегации – при 1000 об/мин. Определение электрокинетической подвижности тромбоцитов проводили в камере H.A. Abramson (1928) модификации В.В. Альфонсова (1977). Показатели КЩР определяли микрометодом Аструпа «Микро-Аструп». В опытах in vivo лактат-ацидоз создавали введением 3 % раствора молочной кислоты в изотоническом растворе NaCl в бедренную вену под гексеналовым наркозом. Различный сдвиг рН в кислую сторону достигали дозированным капельным введением лактата от 20 до 38 капель в мин. под контролем рН. Для определения показателей системы гемостаза пробы крови забирали до и после введения лактата из бедренной артерии. В работе с экспериментальными животными были соблюдены требования, изложенные в «Методических рекомендациях по проведению медико-биологических исследований с использованием животных» от 1985 г. Статистическая обработка материала проводилась на ПЭВМ Pentium 5 с использованием пакета программ Microsoft Excel 2007 для операционной системы Windows 7. Достоверность различий показателей в группах оценивали по величине t -критерия Стьюдента
Результаты исследования и их обсуждение
Результаты проведенных исследований свидетельствуют о том, что молочная кислота в опытах in vitro оказывает выраженное влияние на систему свертывания крови. Сдвиг рН в кислую сторону как в плазме, так и в цельной крови приводит к двухфазным изменениям гемокоагуляции. По мере подкисления плазмы от 7,4 до 7,22–7,10 скорость образования фибринового сгустка увеличивается, дальнейший сдвиг реакции среды в кислую сторону приводит к замедлению свертываемости крови и при рН 6,0 сгусток не образуется. Активность факторов, входящих в протромбиновый комплекс, наиболее устойчива к сдвигу рН в кислую сторону, VII фактор проявляет оптимальную активность при рН 7,40–7,22, дальнейшее подкисление среды приводит к быстрой его инактивации. Тромбиновое время в присутствии различных концентраций молочной кислоты также претерпевает двухфазные изменения. В малых дозах (до 5,95 ммоль/л) лактат укорачивает время перехода фибриногена в фибрин за счет связывания естественных антикоагулянтов, в больших (16,6 ммоль/л) – блокирует формирование фибрина в связи с нарушениями полимеризации фибрин – мономера (табл. 1).
Внутривенное введение 3 %-го раствора лактата приводит к выраженному ацидозу (рН – 7,10), падению щелочного резерва и уровня кислорода в крови. На фоне изменения внутренней среды организма происходит резкая активация процессов свертываемости крови – время рекальцификации укорачивается почти вдвое. Протромбиновое время обычной плазмы и плазмы с низким содержанием V и VII факторов практически не изменяется, активность антигемофильного глобулина возрастает. Ацидоз сопровождается устойчивым падением уровня фибриногена. В то же время лизис эуглобулинов в течение опыта остается замедленным. Снижение концентрации фибриногена и появление в крови фибриногена В заставляет предположить, что введение больших доз лактата сопровождается внутрисосудистым свертыванием крови (табл. 2).
Таблица 1
Влияние различных концентраций молочной кислоты на свертывание плазмы и фибринолиз в опытах in vitro (M ± m)
|
Изучаемые показатели n = 8 |
Контроль |
Концентрация лактата в плазме в ммоль/л |
||||
|
2,5 |
4,0 |
5,95 |
7,77 |
16,6 |
||
|
Время рекальцификации |
130,0 ± 3,5 |
127 ± 3,2 |
120 ± 3,6* |
124 ± 4,8 |
154 ± 10,0* |
Нет сгустка |
|
Протромбиновое время |
14, ± 0,9 |
14 ± 0,95 |
14 ± 0,90 |
15 ± 1,05 |
17 ± 1,5 |
28 ± 5,0* |
|
Фактор VII |
30,0 ± 1,5 |
30 ± 1,8 |
30 ± 1,9 |
37 ± 2,5* |
48 ± 3,1** |
Нет сгустка |
|
Тромбиновое время |
19 ± 1,2 |
15 ± 0,8** |
13 ± 0,72*** |
13 ± 0,82*** |
14 ± 1,0** |
30 ± 3,1* |
|
Тромбиновое время гепаринизированной плазмы |
98 ± 16 |
26 ± 16** |
18 ± 12*** |
15 ± 13*** |
15 ± 13** |
28 ± 22* |
|
Фибринолиз |
38 ± 1,8 |
41 ± 2,0 |
43 ± 2,0* |
47 ± 1,8** |
52 ± 2,1*** |
78 ± 4,5*** |
|
рН |
7,55 ± 0,05 |
7,35 ± 0,08** |
7,22 ± 0,10** |
7,10 ± 0,15** |
6,85 ± 0,20** |
6,0 ± 0,31*** |
Примечание: * – p < 0,05, ** – p < 0,01, ***- p < 0,001 – различия достоверны между контролем и опытом.
Таблица 2
Влияние внутривенного введения 4 % раствора молочной кислоты на свертывание, фибринолиз и некоторые физико-химические показатели крови (M ± m)
|
Изучаемые показатели n = 8 |
До инъекции |
На фоне инъекции |
После инъекции |
|
|
Через 10 мин |
Через 60 мин |
|||
|
рН пробы |
7,35 ± 0,043 |
7,07 ± 0,02*** |
7,23 ± 0,03*** |
7,29 ± 0,02 |
|
Время рекальцификации (с) |
121 ± 5,2 |
65 ± 4,1*** |
82 ± 7,0** |
120 ± 6,0 |
|
Фактор V (с) |
19 ± 0,85 |
20 ± 0,9 |
22 ± 1,2 |
23 ± 2,0 |
|
Фактор VII (с) |
57 ± 2,6 |
54 ± 3,0 |
65 ± 3,0* |
68 ± 3,5* |
|
Фактор VIII (с) |
17 ± 1,5 |
11 ± 1,5* |
16 ± 2,0 |
17 ± 2,1 |
|
Фактор X (с) |
22 ± 1,8 |
22 ± 1,6 |
22 ± 2,0 |
23 ± 1,8 |
|
Протромбиновое время (с) |
15 ± 0,85 |
14 ± 0,76 |
14 ± 0,95 |
14 ± 1,3 |
|
Тромбиновое время (с) |
36 ± 1,5 |
39 ± 0,9* |
43 ± 0,1*** |
45 ± 0,7*** |
|
Фибриноген (мг %) |
395 ± 17,8 |
346 ± 18* |
364 ± 26,7 |
370 ± 28,9 |
|
Фибриноген В |
– |
+ + + |
+ + + |
+ + + |
|
Эуглобулиновый фибринолиз (мин) |
49 ± 2,2 |
51 ± 3,4 |
54 ± 3,1 |
58 ± 3,1* |
|
Лактат (ммоль/л) |
0,70 ± 0,034 |
1,49 ± 0,11*** |
1,02 ± 0,08* |
0,74 ± 0,07* |
|
Щелочной резерв (Мэкв/л) |
110 ± 4,2 |
90 ± 5,0* |
95 ± 5,5 |
105 ± 2,1 |
|
Кислород (об %) |
17 ± 1,0 |
14 ± 1,2* |
14 ± 1,2 |
16 ± 1,1 |
Примечание: * – p < 0,05, ** – p < 0,01, ***- p < 0,001 – различия достоверны между контролем и опытом.
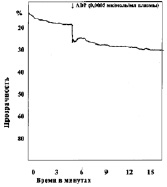
В следующей серии опытов изучали агрегацию тромбоцитов при различных сдвигах рН (7,50; 7,4; 7,34; 7,2; 7,18; 6,92; 6,8; 6,50; 6,11). Анализ кривых агрегации в контрольных наблюдениях показывает, что тромбоциты без добавления агрегирующего агента не склеиваются. Кривые агрегации, записанные при рН 7,4–7,5, характеризуют нормальную реакцию тромбоцитов на дозу АДФ, равную 0,0005 мк/мл плазмы (рис. 1).
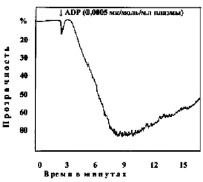
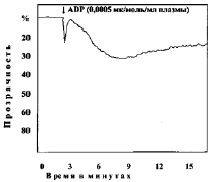
Рис. 1. Варианты кривых агрегации тромбоцитов под влиянием АДФ (контроль)
Замена в изучаемых пробах физиологического раствора на различные концентрации молочной кислоты приводила к изменению характера агрегации тромбоцитов (рис. 2). При уменьшении рН до 7,34 в отдельных случаях появлялась спонтанная агрегация тромбоцитов, которая составляла по средним данным 2,5°, при этом время начала агрегации после внесения АДФ увеличивается не достоверно. Угол агрегации снижался до 59,0°. Процесс становился более растянутым, он удлинялся до 369 с, однако ввиду большой вариабильности результатов эти изменения не достоверны. Амплитуда агрегации пластинок уменьшалась, величина агрегатов оставалась практически неизменной. Сдвиг реакции среды в кислую сторону приводит также к снижению интенсивности дезагрегации. Более выраженные изменения агрегации наблюдались, если рН пробы равнялся 7,2. При такой концентрации водородных ионов во всех опытах обнаружена спонтанная агрегация тромбоцитов. Внесение в кювету калориметра агрегирующего агента усиливало склеивание кровяных пластинок, однако средняя величина угла агрегации падала до 42°, процесс агрегации становился бесконечным и через 900 с плотность плазмы достигала 33,5 %. Величина агрегатов при рН 7,13 оставалась такой же, как в контроле, дезагрегация отсутствовала во всех экспериментах. Дальнейшее подкисление среды приводило к более выраженным изменениям агрегации, основной особенностью которых являлось увеличение угла спонтанной агрегации в присутствии лактата и блокирование специфического действия АДФ. При рН 6,92 угол спонтанной агрегации тромбоцитов возрастал до 11,3° (р < 0,2), при 6,50 до 16° (р < 0,05), при 6,11 до 21,8° (р < 0,05). Угол наклона агрегации под влиянием АДФ в пробе с рН 6,92 несколько увеличивался, при рН 6,5 и 6,11 внесение АДФ уже не приводило к дальнейшему изменению угла агрегации. «Спонтанное» склеивание кровяных пластинок в кислой среде всегда было необратимым, амплитуда агрегации со временем увеличивалась.
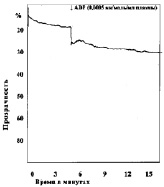 б
б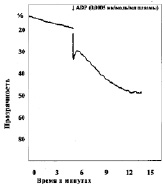
 г
г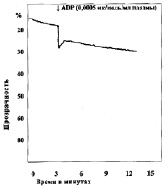
Рис. 2. Агрегация тромбоцитов под влиянием различных концентраций молочной кислоты:а – кривая агрегации тромбоцитов при рН крови 7,0; б – кривая агрегации тромбоцитов при рН крови 7,2; в – кривая агрегации тромбоцитов при рН крови 6,9; г – кривая агрегации тромбоцитов при рН крови 6,42
Таким образом, тромбоциты при сдвигах в кислую сторону или ацидозе способствуют повышению гемокоагуляционных свойств крови и приобретают способность к спонтанной агрегации. Интересно проследить, как изменяется электрокинетический потенциал кровяных пластинок при ацидозе, вызываемом внутривенной инъекцией молочной кислоты.
В следующей серии наблюдений было выявлено, как влияют сдвиги рН в кислую сторону при внутривенном введении 3 % молочной кислоты из расчета 10 мл/кг веса (опыты на 8 собаках) на электрокинетический потенциал тромбоцитов (табл. 3).
Таблица 3
Влияние инъекции 4 % раствора молочной кислоты на дзета-потенциал тромбоцитов (M ± m)
|
До инъекции n = 8 |
На фоне инъекции n = 8 |
Через 10 мин после инъекции n = 8 |
|
14,958 + |
13,940 ± 0,16 p < 0,05 |
14,825 ± 0,13 p < 0,05 |
Примечание: р – достоверность различий между контролем и опытом, n – количество исследований.
До инъекции молочной кислоты дзета-потенциал тромбоцитов, полученных из крови бедренной артерии, равнялся 14,958 мв. На фоне введения лактата электрокинетический заряд кровяных пластинок падал до 13,940 мв или на 6,9 % (Р < 0,05). Одновременно в системном кровотоке наблюдалось увеличение концентрации молочной кислоты с 11 до 26 об % (Р < 0,002), снижение рН с 7,30 до 7,07 (Р < 0,001), щелочного резерва со 110 до 90 м-экв/л (Р < 0,05) и уровня кислорода с 17 до 14 об % (Р < 0,05). На 10-й минуте после введения кислоты метаболические показатели частично восстанавливались, наряду с этим имело место и увеличение дзета-потенциала тромбоцитов. Из приведенных данных видно, что метаболические сдвиги, возникающие в организме в ответ на появление в кровеносном русле лактата, сопровождается снижением электрокинетического потенциала тромбоцитов. Снижение заряда кровяных пластинок создает благоприятные условия для их взаимного склеивания и нарушения движения крови по микроциркуляторному руслу. Ацидоз, вероятно, приводит к снижению не только электрокинетического потенциала форменных элементов крови, но и сосудистой стенки, что должно сопровождаться адгезией пластинок к поверхности эндотелия. В связи с этим можно наблюдать два одновременно протекающих процесса: с одной стороны – нарушение микроциркуляции тромбоцитарными агрегатами, и с другой – снижение числа тромбоцитов за счет прилипания их к измененной внутренней поверхности крупных сосудов.
Таким образом, гиперкоагуляция, возникающая при сдвигах рН крови в кислую сторону, сопровождается увеличением активности плазменных факторов, более быстрой полимеризацией фибрина, спонтанной агрегацией, нарушением процессов дезагрегации и понижением электрокинетического потенциала тромбоцитов.
Работа выполнена в рамках Государственного задания по вузу Минобрнауки РФ, № 4.3604.2011.
Рецензенты:
Степанов А.В., д.м.н., зав. кафедрой безопасности жизнедеятельности и медицины катастроф Читинской государственной медицинской академии, г. Чита;
Авсеенко Н.Д., д.м.н., профессор кафедры безопасности жизнедеятельности и защиты окружающей среды Забайкальского института железнодорожного транспорта (ИрГУПС), г. Чита.
Работа поступила в редакцию 07.05.2013



