Высокая рыночная стоимость металлов золота и платины, ограниченность сырьевых ресурсов делает весьма актуальной разработку новых методов их получения.
Процессы восстановления ионов золота из водных растворов исследован подробно, так как гидрометаллургический метод является основным способом извлечения этих металлов из руд. Однако гидрометаллургический процесс является сравнительно медленным, многостадийным процессом и отличается высокой токсичностью. Этих недостатков лишен электролиз расплавленных солей.
По проблеме электроосаждения золота и платины из расплавленных солей имеется ограниченное число работ. Так, в работе [1] электроосаждение золота проводили в расплавленной эвтектике NaCl–KCl–CsCl, содержащей хлорид золота, при температуре 500–700 °С.
Авторами [2] было установлено, что в равновесии с металлом подавляющая часть ионов золота находится в степени окисления +1. При всех исследованных условиях осадки золота были дендритными. В начальной стадии роста осадка на золотой подложке происходило эпитаксиальное наращивание тонкого слоя (1–3 мкм). Установлено, что у золота температура рекристаллизации колеблется в пределах20–200 °С в зависимости от чистоты и степени деформации. О более высокой подвижности ад-атомов золота на гранях (111) и (100) по сравнению с серебром сообщалось в работе [4].
В работе [3] было изучено зарождение кристаллов платины на стеклоуглеродном микрокатоде в расплаве NaCl–KCl–CsCl–PtCl2 при 500–700 °С гальваностатическим методом. Из экспериментальных кривых перенапряжение – время и данных по числу кристаллов, образующихся на катоде, рассчитаны токи обмена разряда-ионизации платины на растущих зародышах платины.
В работе [5] авторами была изучена структура платиновых металлов, осажденных из хлоридных расплавов. Получены катодные осадки в форме покрытий и дендритов. Все сплавы платиновых металлов получены как твердые растворы в широком интервале концентраций. Платиновые металлы получены электроосаждением из водных растворов с высоким выходом по катодному току в форме покрытий, в форме крупных осадков, содержащих водород.
Цель исследования: исследование процесса электровосстановления ионов золота и платины в галогенидном расплавленном электролите NaCl–KCl–CsCl на платиновом и стеклоуглеродном электродах.
Материал и методы исследования
Для исследования механизма электровосстановления ионов золота и платины, а также для анализа катодных продуктов использовали следующие методы:
– циклическую вольтамперометрию при различных скоростях поляризации (стационарный и нестационарный режим) (потенциостат PAR2273);
– потенциостатический и гальваностатический электролиз (потенциостат PAR2273);
– рентгенофазовый метод изучения фазового состава продуктов (ДРОН-6);
– рентгенофлуоресцентный элементный анализ (Спектроскан МАКС-GV);
Для изучения процесса электровосстановления ионов золота и платины использовали высокотемпературную трехэлектродную ячейку. В качестве индикаторного электрода использовали платиновые и стеклоуглеродные игольчатые электроды. Электродом сравнения служил квазиобратимый платино-кислородный электрод, а анодом и одновременно контейнером для расплавленного электролита – стеклоуглеродный тигель.
Электровосстановление хлоридных комплексов золота и платины проводили в расплаве KCl–NaCl–CsCl. Золото и платину вводили в расплав в виде золотохлороводородной и платинохлороводородной кислот соответственно.
При добавлении H3AuCl6 и H2PtCl6 в хлоридный расплав происходит мгновенное их разложение по следующим схемам:
H3AuCl6 → AuCl3 + 3 HCl↑ (1)
H2PtCl6 → PtCl4 + 2HCl↑ (2)
Хлориды золота и платины, растворяясь в эвтектическом расплаве KCl–NaCl–CsCl, образуют следующие комплексы: [AuCl4]– и [PtCl6]2–. Таким образом, электрохимически активными частицами в данных расплавленных электролитах выступают хлоридные комплексы: [AuCl4]– и [PtCl6]2–.
Результаты исследования и их обсуждение
Электровосстановление хлоридных комплексов золота в расплаве KCl–NaCl–CsCl на платиновом и стеклоуглеродном электродах
Добавление H3AuCl6 (или AuCl3) в хлоридный эвтектический расплав проявляется появлением волны восстановления комплекса [AuCl4]– при потенциалах +0,1–0,2 В относительно платино-кислородного электрода сравнения (рис. 1, кривые 2–4). При потенциале –(2,2–2,3) В имеется обратимая волна электровосстановления щелочных металлов на предварительно выделенном металлическом золоте. Высота этой волны при концентрации H3AuCl6 более 2,0⋅10–4 моль/см3 не меняется, так как при достижении концентрации золота, достаточной для покрытия всей площади электрода выделившимся золотом, при данной скорости поляризации достигается предельная скорость разряда щелочного металла (концентрация ионов щелочного металла как фонового электролита в данном расплаве является избыточной).
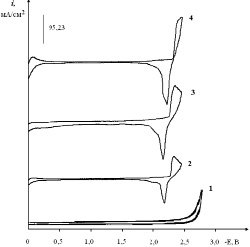
Рис. 1. Вольтамперограммы расплава KCl-NaCl-CsCl (эвтектика), содержащего H3AuCl6, С (H3AuCl6)∙10–4 моль/см3:1 – вольтамперограмма фонового электролита; 2 – 0,5; 3 – 2,0; 4 – 4,0. Катод – Pt, скорость поляризации 0,1 В/с. Температура – 550 °С
Рентгенофазовый анализ катодных продуктов потенциостатического электролиза при –0,5 В показал наличие фаз Au (рис. 2).
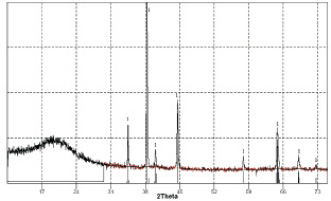
Рис. 2. Рентгенограмма катодных осадков, полученных электролизом расплава KCl–NaCl–CsCl–AuCl3 при потенциале – 0,5 В:1 – стандартные линии металлического Au. Катод – стеклоуглерод. Температура – 550 °С
С увеличением концентрации наблюдается линейный рост тока восстановления золота (рис. 3). Аналогичные исследования были проведены и на стеклоуглеродном электроде. Волна электровосстановления хлоридных комплексов золота наблюдается при потенциале –(0,3–0,5) В (рис. 4.) на стеклоуглеродном электроде.
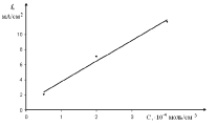
Рис. 3. Зависимость тока пика волны электровосстановления от концентрации [AuCl4]– при скорости поляризации, v = 0,1 B
Анализ стационарных вольтамперных кривых по уравнению Лингейма-Кольтгоффа в координатах Е – lg(id-i) дает число электронов, участвующих в стадии переноса заряда равное трем. Электродный процесс с участием хлоридных комплексов золота можно представить в следующем виде:
AuCl4– + 3e = Au +4Cl– (3)
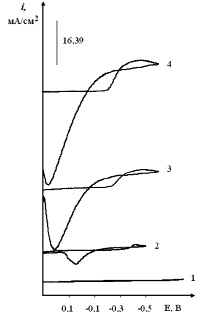
Рис. 4. Вольтамперограммы расплава KCl–NaCl–CsCl (эвтектика), содержащего H3AuCl6, С (H3AuCl6)∙10–4 моль/см3: 1 – вольтамперограмма фонового электролита; 2 – 0,5; 3 – 2,0; 4 – 4,0. Скорость поляризации 0,1 В/с. Катод – стеклоуглерод, температура – 550 °С
Электровосстановление хлоридных комплексов платины в расплаве KCl–NaCl–CsCl на платиновом и стеклоуглеродном электродах
Введение H2PtCl6 (или PtCl4) в хлоридный эвтектический расплав приводит к появлению волны восстановления комплекса [PtCl6]2– при потенциалах –(0,1–0,2) В относительно платино-кислородного электрода сравнения (рис. 5, кривые 2–4) на стеклоуглеродном электроде.
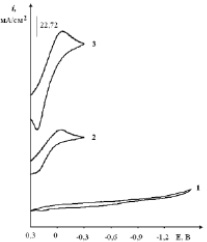
Рис. 5. Вольтамперограммы расплава KCl–NaCl–CsCl (эвтектика), содержащего H2PtCl6, С (H2PtCl6)∙10–4моль/см3:1 – вольтамперограмма фонового электролита; 2 – 1,0; 3 – 2,0. Скорость поляризации 0,1 В/с. Катод – стеклоуглерод, температура – 550 °С
С увеличением концентрации наблюдается линейный рост тока восстановления платины. Рентгенофазовый анализ катодных продуктов потенциостатического электролиза при –0,5 В показал наличие фаз Pt.
Выводы
1. Исследованы процессы электровосстановления ионов золота и платины в эвтектическом расплаве KCl–NaCl–CsCl на платиновом и стеклоуглеродном электродах при температуре 550 °С.
2. Методами рентгенофазового и рентгенофлуоресцентного анализов установлено, что катодные осадки, полученные при электролизе расплава KCl–NaCl–CsCl, содержащие хлоридные комплексы [PtCl6]2– [AuCl4]–, являются фазами металлических золота и платины.
Работа выполнена в ЦКП «Рентгеновская диагностика материалов» в рамках выполнения госконтракта 16.552.11.7074.
Рецензенты:
Мусаев Ю.И., д.х.н., профессор кафедры, ФГБОУ ВПО «Кабардино-Балкарский государственный университет им. Х.М. Бербекова», г. Нальчик;
Лигидов М.Х., д.х.н., профессор, декан ХФ, ФГБОУ ВПО «Кабардино-Балкарский государственный университет им. Х.М. Бербекова», г. Нальчик.
Работа поступила в редакцию 08.05.2013.



