Повсеместно увеличивается число инфекций, вызванных патогенными резистентными бактериями. Низкая антимикробная активность лекарственных препаратов (или полное ее отсутствие) обусловлена развитием лекарственной устойчивости к синтетическим антибиотикам или препаратам, полученным из лекарственных растений. В связи с этим синтез и изучение биологической активности новых антимикробных агентов, к которым бы не развивалась лекарственная устойчивость, является чрезвычайно актуальным в современной биологии и медицине. В настоящее время активно изучается биохимия и фармакология селеноорганических соединений. На протяжении нескольких последних лет установлена противоопухолевая, противовирусная, антимикробная, антиоксидантная, антитоксическая активность органических соединений селена [1, 3–6]. Например, селеноорганический препарат эбселен (2-фенил-1,2-бензисоселеназол-3(2H)-он) обладает антимикробной активностью против грамположительных и грамотрицательных бактерий при низкой концентрации (MIC = 2–32 мкг/мл) [7].
В животноводстве и птицеводстве ряда регионов России в настоящее время применяется селеноорганический препарат диацетофенонилселенид (ДАФС-25), который позволяет нормализовать деятельность иммунной, антиоксидантной и детоксицирующей систем организма животных и птиц, приводит к увеличению яичной и мясной продукции [2].
В связи с этим целью работы явилось изучение антимикробного действия фторированного производного диацетофенонилселенида на клинические штаммы Staphylococcus aureus (S. aureus).
Материалы и методы исследования
В эксперименте использовали препарат 1,5-ди-(п-фторфенил)-3-селенапентандион-1,5 – фторпроизводное диацетофенонилселенида в концентрациях от 0,0001 до 1 мг/мл (рисунок).
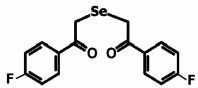
Структурная формула исследуемого препарата – 1,5-ди-(п-фторфенил)-3-селенапентандион-1,5 (соединение 1)
Препарат любезно предоставлен профессором, докт. хим. наук Б.И. Древко.
Эксперимент проводили на клинических штаммах S. aureus. Штаммы бактерий выделяли от больных с гнойными осложнениями, находящихся на лечении в травматолого-ортопедическом стационаре Саратовского научно-исследовательского института травматологии и ортопедии (СарНИИТО). Видовую идентификацию штаммов проводили на основании изучения фенотипических свойств. Бактерии обладали резистентностью к пяти и более профильным антибиотикам: бета-лактамам (цефалоспорины 1–2 поколения, оксациллин, метициллин), макролидам (эритромицин), фторхинолонам (ципрофлоксацин, левофлоксацин), аминогликозидам (гентамицин) и ванкомицину.
Суспензию бактерий готовили по стандарту мутности ГИСК им. Л.А. Тарасевича, путём последовательных разведений до конечной концентрации бактерий – 3∙105 клеток в 1 мл.
1 мг соединения растворяли в 100 мкл ДМФА (диметилформамида), добавляли 900 мкл 0,9 %-го NaCl – проба 1 (1 мг/мл). В качестве контроля использовали 1 мл ДМФА + 9 мл 0,9 %-го NaCl. Затем из пробы 1 отбирали 100 мкл, добавляли 900 мкл из контрольной пробирки, получая пробу 2 (0,1 мг/мл). Из пробы 2 отбирали 100 мкл содержимого, добавляли 900 мкл из контроля, получая пробу 3 (0,01 мг/мл). Из пробы 3 отбирали 100 мкл раствора, добавляли 900 мкл из контроля, получая пробу 4 (0,001 мг/мл).
В пробирки с разведениями препарата добавляли по 100 мкл конечной суспензии (3∙105 КОЕ/мл) микроорганизмов, встряхивали и инкубировали в течение 30, 60, 90, 120, 150 мин при комнатной температуре.
В качестве контроля использовали такие же количества бактериальной взвеси, разведенные в аналогичных пропорциях с контролем (ДМФА с 0,9 %-м NaCl), а также выдержанные в течение тех же промежутков времени. После этого бактериальные взвеси из каждой пробирки в количестве 100 мкл высевали на чашки Петри с твердой питательной средой (мясо-пептонный агар), которые затем помещали в термостат на 24 часа при 37 °С. Подсчет колоний производили на следующий день.
Статистическую обработку полученных данных осуществляли при помощи пакета программ Statistica 6.0. Проверяли гипотезы о виде распределений (критерий Шапиро‒Уилкса). Большинство данных не соответствуют закону нормального распределения, поэтому для сравнения значений использовался U-критерий Манна‒Уитни, на основании которого рассчитывался Z-критерий Фишера и показатель достоверности p. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали равным 0,05.
Результаты исследования и их обсуждение
Установлено, что характер влияния изученного соединения на рост колоний клинических штаммов S. aureus и выраженность антибактериального эффекта зависят от концентрации препарата и времени воздействия на бактериальную взвесь.
Соединение проявляло выраженную антибактериальную активность в широком диапазоне концентраций (от 1 до 0,0001 мг/мл) при разном времени инкубации (30–150 минут).
В минимальной концентрации 0,0001 мг/мл исследованное соединение подавляло рост колоний клинических штаммов S. aureus при разном времени инкубации: на 25,4 % (30 минут), 33,6 % (60 минут), 61,4 % (90 минут), 66,4 % (120 минут), 81,9 % (150 минут) соответственно по сравнению с контролем (р < 0,05) (таблица).
В концентрации 0,001 мг/мл данное соединение проявляло более выраженные антибактериальные свойства, снижая рост колоний золотистого стафилококка на 41,3 % (30 минут), 50,1 % (60 минут), 76,3 % (90 минут), 87,0 % (120 минут) и на 98,6 % (150 минут) соответственно (р < 0,001).
При более высокой концентрации 0,01 мг/мл соединение значительно подавляло рост колоний S. aureus при разном времени инкубации на 72,9 % (30 минут) (р < 0,05), 77,4 % (60 минут), 86,2 % (90 минут), 98,7 % (120 минут), а при максимальном времени инкубации 150 минут исследованный препарат полностью подавлял рост колоний S. aureus (р < 0,001).
Изученное соединение как антибактериальный агент было наиболее эффективно в отношении клинических штаммов S. aureus в высоких концентрациях 1 и 0,1 мг/мл. В этих концентрациях при инкубации 90–120 минут не наблюдалось роста бактерий, а при инкубации 30 и 60 минут отмечалось значительное уменьшение числа клеточных колоний на 92,3 % (30 минут), 99,7 % (60 минут) в концентрации 0,1 мг/мл и на 91,9 % (30 минут), 97,6 % (60 минут) в максимальной концентрации 1 мг/мл (см. табл. 1).
Следовательно, исследованное соединение 1,5-ди-(п-фторфенил)-3-селенапентандион-1,5 оказывало значительное антимикробное действие даже в низких концентрациях и краткосрочной инкубации. Антибактериальная активность этого препарата возрастала с увеличением концентрации препарата и времени инкубации.
Антибактериальное действие соединения 1 на клинические штаммы S. aureus
|
Количество колоний на твердых питательных средах, КОЕ |
|||||||
|
Контроль (ДМФА и физ. р-р) |
Опытные группы, концентрация вещества, мг/мл |
||||||
|
1 |
0,1 |
0,01 |
0,001 |
0,0001 |
|||
|
Время воздействия, мин |
30 |
959 (895; 980) |
78 (56; 104) Zк = 3,77; pк = 0,000157 |
74 (45; 208) Zк = 3,77; pк = 0,000157 |
260 (159; 278) Zк = 3,09; pк = 0,001940 |
563 (563; 590) Zк = 3,47; pк = 0,000507 |
715 (487; 895) Zк = 2,34; pк = 0,01911 |
|
60 |
866 (785; 905) |
21 (0; 54) Zк = 3,77; pк = 0,000157 |
3 (0; 19) Zк = 3,77; pк = 0,000157 |
196 (102; 328) Zк = 3,09; pк = 0,001940 |
432 (342; 459) Zк = 3,77; pк = 0,000157 |
575 (414; 784) Zк = 2,41; pк = 0,01556 |
|
|
90 |
891 (769; 1148) |
0 (0; 3) Zк = 3,77; pк = 0,000157 |
0 (0; 8) Zк = 3,77; pк = 0,000157 |
123 (74; 279) Zк = 3,77; pк = 0,000157 |
211 (115; 387) Zк = 3,51; pк = 0,000440 |
344 (261; 632) Zк = 3,17; pк = 0,00149 |
|
|
120 |
875 (794; 1134) |
0 (0; 0) Zк = 3,77; pк = 0,000157 |
0 (0; 0) Zк = 3,77; pк = 0,000157 |
11 (2; 34) Zк = 3,77; pк = 0,000157 |
114 (18; 289) Zк = 3,77; pк = 0,000157 |
294 (118; 451) Zк = 3,17; pк = 0,00149 |
|
|
150 |
904 (898; 985) |
0 (0; 0) Zк = 3,77; pк = 0,000157 |
0 (0; 0) Zк = 3,77; pк = 0,000157 |
0 (0; 0) Zк = 3,77; pк = 0,000157 |
13 (9; 98) Zк = 3,77; pк = 0,000157 |
163 (87; 321) Zк = 3,70; pк = 0,00021 |
|
Примечания: в каждом случае приведены средняя величина (медиана – Ме), нижний и верхний квартили (25;75 %). Zк, pк – различия по сравнению с группой контроля.
Заключение
В результате проведенных экспериментов было выявлено выраженное антибактериальное действие соединения 1,5-ди-(п-фторфенил)-3-селенапентандион-1,5 (фторированное производное диацетофенонилселенида) на клетки клинических штаммов S. aureus. Значительно уменьшалось число колоний на твердых питательных средах при использовании низких концентраций вещества. Полученные данные позволяют предполагать перспективность использования данного соединения как антибактериального средства в отношении антибиотикорезистентных штаммов S. aureus.
Антибактериальная активность исследованного соединения 1, вероятно, объясняется наличием в его структуре двух атомов фтора, благодаря которым этот препарат приобретает токсичность, прооксидантные свойства и, как следствие, выраженную антибактериальную активность.
Авторы выражают сердечную благодарность за помощь в подготовке статьи профессору, доктору химических наук Древко Б.И. и канд. мед. наук Бабушкиной И.В.
Рецензенты:
Микашинович З.И., д.б.н., профессор, заведующая кафедрой общей и клинической биохимии № 1, ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, г. Ростов-на-Дону;
Бондаренко Т.И., д.б.н., профессор кафедры биохимии и микробиологии ФГАОУ ВПО «Южный федеральный университет», г. Ростов-на-Дону.
Работа поступила в редакцию 03.06.2013.



