Число отдельных костей, входящих в состав скелета взрослого человека, больше 200, из них 36–40 расположены по средней линии тела, непарные, остальные – парные. Короткие трубчатые кости (кости пясти, плюсны, фаланги пальцев) представляют собой короткие рычаги движения; из эпифизов эндохондральный очаг окостенения имеется только в одном (истинном) эпифизе (моноэпифизарные кости) [4].
Хондрома костей – доброкачественная опухоль, характеризующаяся образованием хорошо дифференцированной хрящевой ткани, нередко с очагами обызвествления и окостенения. Это довольно распространенная опухоль, и, по данным литературы, частота её распространения составляет от 10 до 27 % среди доброкачественных опухолей костей и до 12 % среди всех новообразований костной системы. Есть основания полагать, сто истинная частота встречаемости хондром гораздо выше, так как небольшие по размеру хондромы зачастую протекают бессимптомно и никак не проявляются клинически.
Классическое обнаружение хондром приходится на второе (80 %), реже на третье десятилетие жизни, что, несомненно, придает этому разделу клинической онкоортопедии большую социальную значимость. В подавляющем большинстве случаев опухоль локализуется в коротких трубчатых костях кистей и стоп (80 %), значительно реже она определяется в ребрах и длинных трубчатых костях [3, 5, 9].
Большое значение кисти в трудовой и повседневной деятельности человека, а также отсутствие единой тактики в ведении больных определяет постоянный высокий интерес к проблеме лечения пациентов с хондромами коротких трубчатых костей.
Основным методом лечения данных заболеваний является хирургический. Главными этапами операции являются: удаление патологического очага в пределах здоровых тканей, обработка границ резекции известными способами с целью девитализации, замещение образовавшегося дефекта пластическим материалом, а также выполнение, при необходимости профилактического металлоостеосинтеза.
При выполнении подобных операций необходимо учитывать радикальность операции и возможность последующего восстановления анатомической целостности пораженной кости. После удаления патологической ткани образуются дефекты костей, требующие последующего замещения. Адекватное их замещение необходимо не только для восстановления анатомической целостности пораженной кости, но также является важным звеном в комплексной профилактике последующих рецидивов патологического процесса и других грозных осложнений. До недавнего времени приоритет в этом вопросе отдавался аллопластике консервированными трупными трансплантатами [2].
Однако в связи с проблемами в заготовке аллотрансплантатов из-за СПИДа, гепатита и послеоперационных осложнений методика их приготовления становится все более высокотехнологичной и, соответственно, дорогостоящей, что делает данный способ малодоступным для широкого применения. Немаловажным обстоятельством является и то, что нередко больные воздерживаются от применения этой методики по ряду причин.
Исходя из вышеизложенного, в последние годы многие авторы при замещении дефектов костей при лечении обсуждаемых заболеваний все чаще отдают предпочтение аутопластике свободными неваскулляризованными трансплантатами [1,8].
Задачей данной работы явилась разработка нового устройства для взятия костной ткани, позволяющего быстро и малоинвазивно производить забор костного аутотрансплантата необходимого размера.
Цель исследования – обосновать применение и проанализировать первый опыт использования нового устройства для забора костной ткани при замещении пострезекционных дефектов в оперативном лечении пациентов с хондромами коротких трубчатых костей.
Материалы и методы исследования
Авторами совместно с сотрудниками научно-исследовательского института Самарского государственного аэрокосмического университета им. С.П. Королёва была разработана модель нового устройство для забора костной ткани [7]. Следует отметить, что впервые было предложено сконструировать устройство, позволяющее легко, быстро и малоинвазивно производить забор костной ткани как пластического материала для замещения пострезекционных дефектов, так и с целью получения недеформированного столбика биопсийного материала для гистологического исследования. В первом случае полученные аутотрансплантаты были необходимого диаметра для пластики дефектов коротких трубчатых костей, а длину трансплантата удавалось регулировать благодаря линейной шкале, располагающейся на корпусе устройства. Во втором случае мы получали исследуемый материал без нарушения дифференцировки слоев, что увеличивало достоверность постановки морфологического заключения. Несомненно, одним из значительных достоинств данного устройства является возможность производить забор необходимого материала в том числе и под местной анестезией, что служит благоприятным фактором для пациента.

Рис. 1. Устройство для забора костной ткани (общий вид)
Предложенное устройство состоит из трубчатого корпуса 1 с режущей частью 2, выполненной в виде заточенной под углом 65 градусов кромки. Внутренняя поверхность трубчатого корпуса имеет зубья по типу «рыбьей чешуи» 3, направленные под острым углом от режущей части к верхушке. Эта особенность позволяет удерживать забираемый материал в полости устройства.

Рис. 2. Внутренний диаметр рабочего корпуса (зубья по типу «рыбьей чешуи»)
На корпусе выполнена линейная шкала 5 для оценки его погружения в костную ткань. Также имеется цилиндр – толкатель с площадкой в виде «Оливы» 6 для беспрепятственного извлечения взятого материала из полости устройства диаметром, равным внутреннему диаметру трубчатого корпуса. Площадка в виде оливы 7 на основании цилиндра – толкателя 6 служит упором при извлечении трансплантата из корпуса 1, который позволяет извлекать костную ткань из корпуса устройства, не деформируя трансплантат.
Устройство используют следующим образом. После произведенного минидоступа достаточно разреза кожи длинной не более 1 см, – рассечения мягких тканей устройство размещают режущей частью 2 на костной ткани в заданном направлении. На корпусе 1 размещают рукоятку-направитель 4 и производят удары молотком по ней. Устройство погружается в костную ткань на заданную глубину под контролем линейной шкалы 5. Режущая часть 2 отсекает взятый материал цилиндрической формы. После этого устройство легко извлекают. Взятая костная ткань в виде столбика остается во внутренней части корпуса 1, благодаря зубьям по типу «рыбьей чешуи» на внутренней поверхности, и легко извлекается при помощи цилиндра – толкателя 6 в направлении от режущей – дистальной части к проксимальной. Костная ткань направляется на гистологическое исследование или используется для замещения дефекта, а мягкие ткани послойно ушивают после проведения туалета и гемостаза раны.
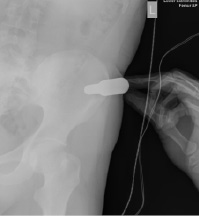
Рис. 3. Интраоперационная рентгенограмма взятия костного аутотрансплантата с крыла левой подвздошной кости при помощи нового устройства
Клинический пример.
Больной Т., 1990 г.р., находился на стационарном лечении в отделении общей онкологии СОКОД в 2011 г. с жалобами на боли и деформацию в области II пястной кости правой кисти. При обследовании была выполнена компьютерная томография и рентгенография правой кисти. Поставлен клинический диагноз: Энхондрома II пястной кости правой кисти.
Оперативное вмешательство выполняли в соответствии с топографо-анатомическими особенностями расположения патологического очага. Послойно обнажили и трепанировали II пястную кость. Выполнили резекцию кортикального слоя в пределах здоровых тканей. Затем тщательно ложкой Фолькмана механически удалили новообразование. После тщательного просушивания полости границы резекции обработали при помощи аргонно-плазменной установки по известной методике. Мощность плазменного потока в данном случае составила 60 Вт [6].
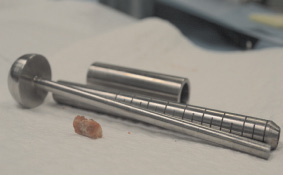
Рис. 4. Полученный аутотрансплантат с гребня крыла подвздошной кости
Далее выполнили забор аутотрансплантата при помощи нового устройства с гребня крыла подвздошной кости. В данном случае от выполнения накостного остеосинтеза воздержались. Произвели иммобилизацию гипсовой лангетой сроком на 4 недели. В послеоперационном периоде назначили комплекс реабилитационно-восстановительного лечения.
Результаты исследования и их обсуждение
Всего с использованием нового устройства для забора костной ткани прооперировано 56 пациентов. Из них: для замещения пострезекционных дефектов ‒ 32 операции; биопсии малоинвазивным путем ‒ 24 операции.
В большинстве случаев при замещении дефектов костной ткани дополнительное моделирование забранного материала не требовалось. Диаметр трансплантата соответствовал костно-мозговому каналу (пострезекционному дефекту), а длину можно было регулировать при заборе благодаря линейной шкале.
При малоинвазивной биопсии применяли местную инфильтративную или проводниковую анестезию, стандартных донорских зон. Исследуемый материал получали без нарушения дифференцировки слоев, размерами подходящими для исследований, что позволяло увеличить достоверность постановки морфологического заключения.
Вывод
Использование нового устройства для забора костной ткани при оперативном лечении пациентов с хондромами коротких трубчатых костей позволяет быстро и малоинвазивно производить забор костного материала необходимого размера.
Рецензенты:
Повелихин А.К., д.м.н., профессор кафедры травматологии, ортопедии и экстремальной хирургии, ГБОУ ВПО «Самарский государственный медицинский университет» Минздравсоцразвития России, г. Самара;
Чернов А.П., д.м.н., профессор кафедры травматологии, ортопедии и экстремальной хирургии, ГБОУ ВПО «Самарский государственный медицинский университет», Минздравсоцразвития России лауреат Государственной премии, г. Самара.
Работа поступила в редакцию 16.09.2013.



