Согласно современным представлениям, тканевые повреждения во время операции являются причиной многих органных и метаболических патологических проявлений, объединяемых в понятие «хирургический стресс» (ХС) [5]. При недостаточной выраженности защитно-компенсаторных и репаративных процессов, направленных на экстренную адаптацию организма к новому состоянию, вызванному оперативным вмешательством, отмечается осложненное течение ХС, одним из проявлений которого становится длительный послеоперационный болевой синдром (дПБС) [7, 10, 11]. Негативная значимость длительной послеоперационной боли состоит в увеличении вероятности сердечно-сосудистых, дыхательных, гемореологических и ряда других осложнений, отмечаемых в периоде после выполненного хирургического вмешательства [3].
Существующая у оперированных больных опасность развития дПБС делает актуальным изучение значимости факторов риска данного осложнения. С учетом этого целью настоящего исследования явилась оценка значимости для риска дПБС после гинекологических операций факторов, связанных как с особенностями предоперационного состояния (выраженность анемии, ожирения, тип преобладающей вегетативной регуляции), так и с показателями, характеризующими выполненное вмешательство (объем интраоперационной кровопотери и длительность операции).
Материалы и методы исследования
При изучении факторов риска дПБС использовались данные пред- и интраоперационного обследования 339 гинекологических больных, оперированных с использованием только лапаротомического доступа и получавших традиционную терапию в послеоперационном периоде. Возраст включенных в исследование больных варьировался от 19 до 70 лет (M ± m = 41,6 ± 5,2 года).
При анализе клинической значимости вероятных факторов риска дПБС выраженность анемии уточняли на основании предоперационного определения гемоглобина (Hb). Степень ожирения определяли, рассчитывая индекс массы тела (ИМТ) по Brey (ИМТ = масса тела, кг:рост, м2). Характер преобладающего типа вегетативной регуляции определяли за сутки до операции в состоянии покоя по данным оценки индекса Кердо [1].
Данные о величине интраоперационной кровопотери и длительности операции были взяты из операционных журналов.
В послеоперационном периоде для измерения интенсивности боли применяли тесты субъективной самооценки по визуальной аналоговой шкале (ВАШ) и 4-балльной рейтинговой шкале боли (ВРШ/Б) [2], использовавшихся в течение всего периода пребывания больных в стационаре. Наличие дПБС констатировалось при выраженности боли > 25 % ВАШ (2–3 балла по ВРШ/Б) на сроках более 4 суток после выполненной операции.
Исследования значимости факторов риска дПБС основывались на ретроспективном изучении количества пациенток с дПБС в группах, выделенных с учетом наличия или отсутствия изучаемого признака. При этом с использованием соответствующих статистических методов [8] определялась величина относительного (relative risk – RR) и степень связи прогноза и исхода (Odds ratio – OR) для дПБС при наличии анализируемого признака.
Величина RR показывает, во сколько раз возрастает вероятность дПБС у лиц с анализируемым признаком в сравнении с пациентками группы сравнения без такого признака. Значения показателя OR характеризуют, насколько верным оказывается положительный и отрицательный прогноз вероятности возникновения дПБС у лиц с наличием или отсутствием изучаемого признака.
При расчете величин RR и OR в обязательном порядке определяли их 95 % доверительные интервалы (ДИ): если верхняя и нижняя границы 95 % ДИ оказывалось > 1,0 для показателей RR и OR, это указывало на достоверность их значений (р < 0,05), т.е. означало статистически подтверждаемую значимость изучаемого признака для риска дПБС. Нижняя граница 95 % ДИ < 1,0 при его верхней границе > 1,0 указывала на недостоверность величин RR и OR (р > 0,05), т.е. на несущественную связь между изучаемым признаком и вероятностью дПБС.
Для облегчения расчетов при анализе связи изучавшихся признаков с дПБС (при вычислении RR, OR и их 95 %ДИ) использовалась компьютерная программная система SAS (Statistical Analysis System).
Физиотерапевтическое лечение включало процедуры лазеротерапии (ИК НЛИ).
Процедуры лазеротерапии проводились с помощью аппарата «Азор-2К-02» (Россия), генерирующего импульсное лазерное излучение инфракрасного диапазона с длиной волны λ = 0,89 мкм, с частотой следования импульсов 1500 Гц, при импульсной мощности 4–6 Вт/имп. Процедуры проводились на область тимуса [4], контактно, стабильно, время воздействия – 10 минут, на курс 6–8 ежедневных процедур.
Результаты исследования и их обсуждение
При мониторировании выраженности послеоперационных болей дПБС был констатирован у 43 из 339 (12,7 %) находившихся под наблюдением пациенток.
Полученные данные показали, что частота больных с дПБС среди лиц с Hb в интервале 100–120 г/л в сравнении с пациентками без анемии оказывалась большей в 1,4 раза, среди лиц с Hb < 100 г/л – в 4,5 раза. Статистический анализ этих данных позволяет отметить, что достоверно риск дПБС был выражен только у лиц с анемией при Hb < 100 г/л (RR = 2,0; 95 %ДИ = 1,5–2,7).
В сравнении с пациентками с ИМТ < 26, ожирение I–II степени сопровождалось увеличением частоты дПБС в 1,3 раза, ожирение III–IV степени – в 11,6 раз. Достоверным риск дПБС оказывался у больных с ИМТ более 30 (RR = 2,1; 95 % ДИ = 1,7 – 2,5), тогда как ожирение I–II степени статистически значимо не влияло на вероятность изучавшегося осложнения (RR = 1,1; 95 % ДИ = 0,5–2,6).
При анализе связи преобладающего типа вегетативной регуляции (ВР) с вероятностью дПБС было установлено, что в сравнении с пациентками с эйтонией, риск дПБС оказывался достоверно выраженным только у лиц с симпатотонией (RR = 1,3; 95 % ДИ = 1,1–1,6). У женщин с парасимпатотонией относительный риск дПБС (RR = 1,3) не подтверждался статистически (95 % ДИ для RR = 0,6–2,6, р > 0,05).
Среди лиц с длительностью операции менее 1 часа, от 1 до 2 часов и более 2 часов частота случаев дПБС составляла соответственно 10, 10,2 и 62,5 %. При сопоставлении частоты дПБС у лиц с разной продолжительностью операции было установлено, что в сравнении с пациентками с длительностью операции менее 1 часа (группа сравнения) увеличение времени операции более 2 часов сопровождалось достоверным возрастанием относительного риска дПБС (RR = 3,3; 95 % ДИ = 1,6–7,0, р < 0,05). У женщин, оперированных в течение 1–2 часов, величина относительного риска дПБС достоверно не отличалась от аналогичного показателя в группе сравнения (RR = 1,0; 95 % ДИ = 0,9–1,1, р > 0,05).
У пациенток с кровопотерей менее 250 мл, от 250 до 500 мл и более 500 мл частота дПБС составляла соответственно 12,5; 10,9 и 38,9 %. Статистическая обработка этих результатов позволяет отметить, что в сравнении с лицами с кровопотерей менее 250 мл, лишь возрастание интраоперационной кровопотери до значений более 500 мл сопровождалось достоверным риском дПБС (RR = 2,6; 95 % ДИ = 1,3 – 5,4, р < 0,05). Кровопотеря в объеме 250–500 мл не приводила к достоверному увеличению вероятности дПБС (RR = 1,0; 95 % ДИ = 0,8 – 1,1, р > 0,05).
Проведенный анализ связи изучавшихся факторов с вероятностью дПБС после выполненных гинекологических операций позволил выделить из них причины, которые имеют статистически подтверждаемую значимость для риска данного осложнения. Их итоговая характеристика, основанная на оценке величины RR для дПБС, приводится на рисунке. Представленные на нем результаты дополняют приводимые в литературе сообщения о причинных факторах длительных послеоперационных болей [9], позволяя составить четкие представления о конкретной величине относительного риска дПБС при наличии каждого из изучавшихся признаков.
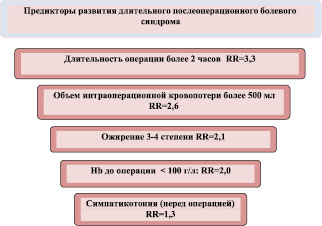
Факторы, имеющие статистически подтверждаемую самостоятельную значимость для риска дПБС
Очевидно, что полученный нами материал о действительно значимых (т.е. подтверждаемых статистически) факторах риска дПБС может быть использован для своевременного прогноза каждого из этих осложнений, что облегчает индивидуальное планирование тактики послеоперационного ведения гинекологических больных. Так, можно предположить, что оперированным женщинам с достоверным риском дПБС из-за наличия у них одного или нескольких из указанных на рисунке признаков (т.е. больным с ожидаемым относительно длительным использованием анальгетиков) после выполненного хирургического вмешательства следует исходно назначать физиотерапевтическое лечение, обладающее вегетокорригирующим и обезболивающим эффектами. Например, с указанной целью в подобных клинических ситуациях представляется целесообразным назначать лазеротерапию на область тимуса, вместо традиционно используемых неселективных блокаторов ЦОГ. Последнее аргументируется тем, что все неселективные ингибиторы ЦОГ (ксефокам, кеторол, солфаплекс, диклофенак, кетонал и др.) при их длительном назначении могут оказывать негативное влияние на почки, гемостаз (геморрагии) и особенно на состояние слизистой желудочно-кишечного тракта (язвообразованиие) [Машковскиий М.Д. 2005; Lazzaroni M. et al., 2004; Gryer B., 2003]. Физиотерапевтические факторы воздействия не имеют побочных эффектов и являются высоко безопасными методами лечения, что, собственно, и предопределяет предпочтительность их использования в ситуациях, требующих относительно длительного использования анальгетиков (более 3–5 дней).
К этому можно добавить, что представленный материал, позволяющий составить четкие представления о статистически значимых причинных факторах дПБС, облегчает решение вопроса и о направленности первоочередных превентивных терапевтических мероприятий в пред- и послеоперационном периоде. Очевидно, что их успешное проведение является важной предпосылкой к устранению (или, по крайней мере, ослаблению) конкретных нарушений, достоверно увеличивающих риск изучавшегося послеоперационного осложнения. Исходя из полученных нами данных, нетрудно предвидеть, что профилактике дПБС может способствовать, прежде всего, превентивные курсы лазеротерапии.
Результаты профилактического применения инфракрасной лазерной терапии на область тимуса у пациенток с предикторами возникновения дПБС.
Особую актуальность на современном этапе развития медицины приобретают вопросы профилактики осложнений после различных лечебных мероприятий, в том числе и оперативных вмешательств. Это касается и профилактики возникновения осложнений после гинекологических операций лапаротомным методом, в связи с чем в работе пациенткам с наличием одного или нескольких дооперационных предикторов развития дПБС назначался курс ИК НЛИ на область тимуса до проведения операции с целью повышения адаптивных и резервных возможностей организма.
Для изучения профилактической ценности метода до операции была проведена лазеротерапия у 52 пациенток. Результаты сравнивались с общей выборкой пациенток 1 этапа исследования.
Необходимо подчеркнуть, что из 52 пациенток, которым проводились профилактические курсы ИК НЛИ, осложнения отмечались лишь у 2,7 % пациенток в виде дПБС, без применения профилактических курсов осложнения развивались в 12,7 % случаев дПБС, т.е. отмечено снижение их возникновения в 4,8 раза.
Таким образом, полученные результаты свидетельствуют о высокой профилактической ценности, а значит, и целесообразности применения низкоинтенсивной инфракрасной лазеротерапии при воздействии на тимус перед проведением гинекологических операций.
Суммируя полученные нами данные о клинических эффектах применения ИК НЛИ на область тимуса, можно констатировать, что его назначение является вполне оправданным для предупреждения изучавшихся осложнений хирургического стресса. Это заключение основывается на статистически подтвержденном уменьшении вероятности развития дПБС.
Выводы
1. Причинами, ассоциированными с достоверным возрастанием относительного риска дПБС (RR от 1,3 до 2,6; р < 0,05), являются длительность операции более 2 часов, объем интраоперационной кровопотери более 500 мл, ожирение III–IV степени, анемия с показателем гемоглобина до операции < 100 г/л и симпатотония в предоперационном периоде.
2. Факторами, не имеющими статистически подтверждаемой самостоятельной значимости для риска дПБС (р > 0,05 при оценке 95 % ДИ для RR и OR) являются анемия с уровнем гемоглобина до операции от 100 до 120 г/л, ожирение I–II степени, длительность операции менее 2 часов, объем интраоперационной кровопотери менее 500 мл, парасимпатотония в предоперационном периоде.
3. Профилактическое применение низкоинтенсивной инфракрасной лазеротерапии на область тимуса перед проведением гинекологических операций у пациенток с дооперационными предикторами риска развития дПБС способствует снижению случаев данного осложнения в 4,8 раза.
Практические рекомендации
Пациенткам с наличием одного или нескольких факторов риска развития дПБС до оперативного вмешательства показано профилактическое проведение курса низкоинтенсивной лазеротерапии при воздействии на область тимуса, на курс 6–8 процедур, проводимых ежедневно.
Рецензенты:
Корчажкина Н.Б., д.м.н., профессор кафедры восстановительной медицины, спортивной медицины, курортологии и физиотерапии Института последипломного профессионального образования Федерального государственного бюджетного учреждения «Государственный научный центр Российской Федерации – Федеральный медицинский биофизический центр имени А.И. Бурназяна», г. Москва;
Орехова Э.М., д.м.н., профессор кафедры восстановительной медицины, спортивной медицины, курортологии и физиотерапии Института последипломного профессионального образования Федерального государственного бюджетного учреждения «Государственный научный центр Российской Федерации – Федеральный медицинский биофизический центр имени А.И. Бурназяна», г. Москва.
Работа поступила в редакцию 04.02.2014.



