Известно, что липопротеины могут связывать и транспортировать, в том числе и через цитоплазматическую мембрану, ксенобиотики, жирорастворимые витамины, стероидные соединения, тиреоидные гормоны, лекарственные препараты [5, 7]. В литературе показано, что наиболее перспективными переносчиками являются липопротеины высокой плотности (ЛПВП) и их белковый компонент аполипопротеин А-I (апоА-I), образующий стабильные комплексы с биологически активными веществами [6, 11, 14]. Показано, что многие клетки обладают рецепторами к апоА-I, поэтому апоА-I нашел применение в искусственных липосомах в качестве маркера для распознавания такими клетками [12, 15]. Однако транспортной ролью функции апоА-I не ограничиваются. Показано, что апоА-I сам по себе и в комплексе с тетрагидрокартизолом (ТГК) связывается с эукариотической ДНК [1]. На коротких олигонуклеотидах было продемонстрировано, что наибольшее сродство комплекс апоА-I-ТГК имеет к олигонуклеотидам, в состав которых входит (GCC)n повторы (n = 3,5). При этом в местах взаимодействия образуются однонитевые разрывы ДНК, в результате чего происходит увеличение копирования ДНК на 22–27 % [2, 13]. Основываясь на этих данных, на специфическом (или слабоспецифическом) взаимодействии апоА-I с ДНК, мы предположили его использование для трансфекции клеток млекопитающих плазмидными ДНК (пДНК). Поскольку некоторые клетки животных, в том числе и опухолевые, имеют рецепторы к апоА-I [9, 10], конгломерат апоА-I(n)-пДНК может быть поглощен этими клетками. Целью настоящего исследования явилось изучение возможности трансфекции клеток асцитной карциномы Эрлиха плазмидными ДНК с помощью апоА-I.
Материалы и методы исследования
Аполипопротеин А-I выделяли из плазмы крови человека по методике [3, 6]. Качество белка анализировали в 12 % полиакриламидном геле в денатурирующих условиях по Леммли. Концентрацию белка измеряли спектрофотометрически по методике Варбурга и Кристиана (отношение оптической плотности раствора при 280 и 260 нм). В качестве культуры клеток использовался монослой перевиваемой линии клеток АКЭ. Животные были любезно предоставлены Калединым В.И. (ИЦиГ СО РАН, Новосибирск). Содержание, питание, уход за животными и выведение их из эксперимента осуществляли в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных» (приложение к приказу МЗ СССР от 12.08.1977 № 755). Выделение и выращивание клеток из перитонеального экссудата мышей проводилось как описано в работе [7]. Клетки высевались в 24-луночный планшет («Orange Scientific», США) предварительно обработанный раствором коллагена 0,1 мг/мл, из расчета 180 000 живых клеток на лунку. Далее клетки инкубировались ночь в СО2-инкубаторе для формирования монослоя в атмосфере, содержащей 5 % CO2 и 95 % воздуха, при 37 °С. На следующие сутки производилась замена культуральной среды и инкубация с исследуемыми веществами – комплексом апоА-I-ФИТЦ или трансфецирующими реагентами (комплекс пДНК-апоА-I и пДНК-Lipofectamin 2000). Конъюгат апоА-I-ФИТЦ получали путем инкубации смеси белка с ФИТЦ (флуоресцеин-5-изотиоцианат) в течение ночи в карбонатном буфере рН 9,5, в соотношении 12,5 мкг ФИТЦ к 1 мг белка. Конъюгат от не прореагировавшего ФИТЦ отделяли с помощью гель-фильтрации на Sephadex G25 (примерно 1 мг конъюгата на 10 мл смолы, высота колонки 10 см), хроматография велась в стандартном фосфатно-солевом буфере (рН 7,4–7,5). Полученный таким образом конъюгат использовался для инкубации с клетками. Визуально конъюгат имел желто-зеленый оттенок, что говорило о присоединении флуоресцентной метки ФИТЦ к молекулам белка.
Плазмиды для трансфекции содержали ген gfp под контролем промотора цитомегаловируса – pTagGFP2-С, ~4,7 т.п.н. («Евроген», Россия). Второй вариант плазмиды являлся аналогичным и содержал рекомбинантную ДНК – слитые гены gfp и апоА-I человека. Плазмиды в препаративном количестве нарабатывали в клетках E.coli, выделяли плазмиды из клеток набором «Plasmid Miniprep» («Евроген», Россия), конечный продукт мог использоваться для трансфекций. Качество плазмид анализировали электрофоретически в 0,8 % агарозном геле. За основу метода трансфекции был взят протокол, прилагаемый фирмой-производителем Lipofectamin 2000 («Invitrogen; Life Technologies», США). На вторые сутки после трансфекции клетки визуально анализировались с помощью флуоресцентного микроскопа Axiovert 40 CFL («Zeiss», Германия). Уровень трансфекции оценивался как отношение количества флуоресцирующих клеток к общему количеству клеток, наблюдаемых в микроскопическом поле (не менее 20 полей для каждого образца). Результаты статистически обрабатывались и были представлены в процентах как среднее значение и среднеквадратичное отклонение.
Результаты исследования и их обсуждение
На предварительном этапе работ было исследовано предположение о проникновении апоА-I в ядра клеток АКЭ. Для этого был получен конъюгат апоА-I с флуоресцирующим красителем ФИТЦ (флуоресцеин-5-изотиоцианат). Конъюгат инкубировался с клетками в течение различных промежутков времени, от 30 до 180 минут. Концентрация конъюгата так же варьировалась от 5 до 50 мкг/мл. Монослой клеток был выращен в 24-луночном планшете, объем среды составлял 1 мл. По окончании инкубации клеток с конъюгатом клетки фиксировались на покровном стекле и анализировались в флуоресцентном микроскопе. В результате анализа было обнаружено зеленое свечение в ядрах некоторых клеток (рис. 1). Как и ожидалось, максимальное количество таких клеток наблюдалось в образцах, инкубированных 180 минут с концентрацией конъюгата 50 мкг/мл (рис. 1, А). Наличие выраженных светящихся ядер (и ядрышек) в клетках являлось прямым доказательством проникновения конъюгата в ядра клеток АКЭ. В контрольных клетках подобного свечения не наблюдалось, как вариант эти клетки можно видеть на рис. 1, А. В случае инкубации клеток со «свободным» ФИТЦ клетки представлялись гомогенными «размытыми пятнами» без выраженной структурной флуоресценции (рис. 1, В).
На рис. 1, А можно видеть, что далеко не все клетки обладали светящимся ядром. Вероятно, это следствие гетерогенной популяции клеток АКЭ, т.е. клеток, находящихся в различных стадиях пролиферации. Клетка обладает максимальным количеством активных рецепторов к апоА-I лишь в определенный промежуток своего жизненного цикла. Отсюда мы и наблюдали небольшую долю клеток со светящимися ядрами.
Подтверждение о проникновении апоА-I в ядра клеток АКЭ позволило перейти к следующему этапу исследований. Далее мы изучили возможность переноса пДНК молекулами апоА-I в ядра клеток АКЭ. Для этого предварительно инкубировали пДНК с апоА-I в фосфатно-солевом буфере или бессывороточной среде в течение 15–20 мин в различных молярных соотношениях пДНК:апоА-I, от 1:1 (1 мкг:0,01 мкг) до 1:100, т.е. в крайних точках мы предполагали посадку от 1 до 100 молекул белка на плазмиду (апоА-I(n)-пДНК, где n равно 1, 5, 25, 50 и 100). Затем различное количество смеси добавляли к клеткам, общее количество пДНК при этом составляло от 0,5 до 5 мкг на лунку 24-луночного планшета (примерно 150000–180000 клеток на лунку). Данный вариант эксперимента проводился на двух пДНК, разница заключалась в том, что одна пДНК содержала ген gfp, слитый с геном апоА-I человека (2 вариант). Этот вариант плазмиды был специально нами заказан («Евроген», Россия), поскольку, проанализировав структуру гена апоА-I человека на примере известной кДНК [GenBank: AK292231.1], мы обнаружили в 3’-концевой области гена некоторое количество относительно сближенных GCC-триплетов. Расстояние между GCC-триплетами составляло от двух до восьми нуклеотидов (рис. 2). Это натолкнуло нас на мысль, что, может быть, с этим вариантом плазмиды взаимодействие белка апоА-I будет более специфичным, как и в случае с GCC-богатыми олигонуклеотидами [2, 13].
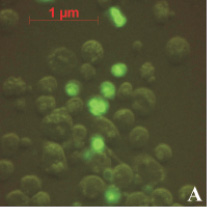
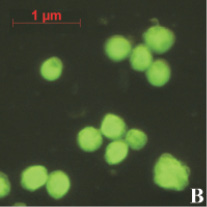
Рис. 1. А – клетки АКЭ, инкубированные 180 минут с концентрацией конъюгата 50 мкг/мл, снимок в флуоресцентном режиме; В – клетки, инкубированные со «свободным» ФИТЦ, снимок в флуоресцентном режиме
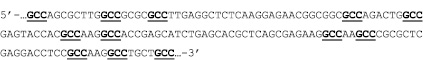
Рис. 2. Фрагмент кДНК гена апоА-I человека, повторы GCC подчеркнуты
В качестве контроля параллельно проводился аналогичный эксперимент со «свободной» пДНК (1 вариант, пДНК содержала только ген gfp). Условия эксперимента были аналогичными, как и для комплекса апоА-I(n)-пДНК.
В качестве контрольной реакции на возможность переноса пДНК в ядра клеток АКЭ параллельно проводилась трансфекция клеток с помощью зарекомендовавшего себя трансфецирующего реагента Lipofectamin 2000 (далее Lip). В постановке контрольной реакции исследовалось оптимальное для трансфекции соотношение пДНК:Lip – от 1 мкг:1 мкл до 1 мкг:5 мкл. Комплекс пДНК:Lip получали инкубацией в бессывороточной среде при комнатной температуре в течение 20 мин. согласно инструкции к Lip., затем смесь добавляли к клеткам. Суммарное количество пДНК на лунку было аналогичным, как и в случае комплекса апоА-I(n)-пДНК. На следующие сутки, примерно после 24 часов инкубации, начинали наблюдение за клетками в флуоресцентный микроскоп. Через каждые сутки инкубационная среда менялась на свежую, не содержащую трансфецирующих реагентов. Общее время инкубации клеток не превышало трех суток.
По результатам этих экспериментов в клетках, инкубированных со смесью пДНК:Lip наблюдалась характерная выраженная флуоресценция клеток, синтезирующих зеленый флуоресцирующий белок уже после суток инкубации, пример клеток представлен на рис. 3. Частота встречаемости флуоресцирующих клеток составляла от 1,8 ± 0,7 до 8,6 ± 2,1 % и была достоверно выше, чем в контрольных клетках со «свободной» пДНК. Максимальный уровень флуоресцирующих клеток 8,6 ± 2,1 % был обнаружен при соотношении пДНК:Lip, равном 1 мкг:3 мкл и общем количестве пДНК 3 мкг. Дальнейшее увеличение количества пДНК а так же увеличение количества Lip в соотношении пДНК:Lip не приводило к росту уровня трансфекции, значения оставались примерно на этом же уровне.

Рис. 3. Пример клеток АКЭ, инкубированных с комплексом пДНК:Lip, снимок в флуоресцентном режиме после 24 часов с начала проведения трансфекции. Клетки, экспрессирующие ген gfp, имели характерное ярко-зеленое свечение
В литературе отсутствуют данные о трансфекции клеток АКЭ с помощью Lip, однако в целом можно отметить низкий уровень трансфекции клеток по сравнению с известными клеточными линиями. Например, для нейронных клеток и клеток лини HEK 293 уровень трансфекции в первом пассаже с помощью Lip по данным производителя составляет 25 % и 99 % соответственно [4]. Вероятно, в нашем случае низкий уровень трансфекции обусловлен особенностью клеток АКЭ и, возможно, недостаточной очисткой используемых пДНК.
В клетках, инкубированных со смесью апоА-I(n)-пДНК (оба варианта пДНК), частота встречаемости флуоресцирующих клеток не превышала частоту клеток, инкубированных с аналогичным количеством «свободной» пДНК. Уровень трансформации в таких клетках не превышал 0,2 %, и достоверного отличия с контрольными образцами обнаружено не было. Это говорит о том, что комплекс апоА-I(n)-пДНК, в исследованных молярных соотношениях при n, равной 1, 5, 25, 50 и 100, не проникал в ядра клеток АКЭ. Вероятной причиной таких результатов могла быть громоздкость комплекса апоА-I(n)-пДНК, что сделало невозможным его рецептор-опосредованный перенос в клетку и/или ядра клеток.
Заключение
В результате исследований впервые было показано проникновение апоА-I, меченного ФИТЦ, в ядра клеток асцитной карциномы Эрлиха. Впервые была показана возможность трансфекции клеток АКЭ в условиях in vitro с помощью трансфецирующего реагента Lipofectamin 2000, уровень трансфекции составил до 8,6 ± 2,1 % клеток. Эти данные позволяют говорить о пригодности клеток АКЭ в качестве модели для трансфекции. Показана неспособность апоА-I к переносу плазмидных ДНК размером 5–6 т.п.н. в клетки и/или ядра клеток АКЭ в исследуемых молярных соотношениях.
Рецензенты:
Гимаутдинова О.И., д.б.н., доцент кафедры медицинской химии, ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России, г. Новосибирск;
Куницын В.Г., д.б.н., ведущий научный сотрудник лаборатории медицинской биотехнологии, ФГБУ «НИИ биохимии» СО РАМН, г. Новосибирск.
Работа поступила в редакцию 01.04.2014.



