Аминокислоты – являются структурной единицей белка, функции которого в живом организме многообразны. В большинстве своем аминокислоты не вырабатываются организмом. Так, например метионин может регенерироваться из гомоцистеина, единственным источником которого в организме служит метионин. В пище гомоцистеина крайне мало, поэтому потребности человека в метионине и гомоцистеине обеспечиваются только метионином пищи или посредством медикаментозной терапии [1]. Согласно [2, 11] метионин и цистеин определяют йодометрическим методом, который предполагает использование неустойчивого титранта – йода. Особого внимания заслуживает способ определения цистеина в водных растворах методом циклической вольтамперометрии [3, 4]. Модификация электродов пленками различной природы позволяет проводить селективное определение тиоаминокислот [7–10], но требует строгого соблюдения условий проведения анализа. Применение фотохимического титрования с биамперометрической индикацией конечной точки титрования позволяет устранить недостатки классической йодометрии. Суть метода заключается в том, что из вспомогательного вещества под действием света получается титрант, который тут же в растворе взаимодействует с аналитом. При этом не требуется предварительной стандартизации титранта, что значительно сокращает время определения.
Цель настоящего исследования – апробация способа определения метионина и цистеина в лекарственных средствах, основанного на титровании тиоаминокислот раствором фотогенерированного йода. В результате взаимодействия метионина или цистеина с йодом происходит уменьшение его количества, что приводит к уменьшению силы тока в амперометрической цепи. Измерение времени генерации йода до достижения первоначального количества при облучении раствора светом позволяет судить о содержании их в анализируемой пробе.
Экспериментальная часть
Принципиальная схема установки для получения фотогенерированного йода приведена [6].
Методика количественного определения тиоаминокислот в субстанции, таблетках. Навеску порошка массой 0,10 и 0,20 г (точная навеска) субстанции (метионин, цистеин) полученного в результате растирания 10 таблеток препарата (метионин) количественно переносили в мерную колбу емкостью 250 мл, прибавляли 20 мл фосфатного буферного раствора с рН 5,8 и доводили водой до метки. Рабочий раствор препарата готовили разбавлением исходного в 200 раз.
При определении цистеина в комбинированном ЛС («Флуимуцил», АЦЦ-100) навеску порошка массой 3,0 г количественно переносили в мерную колбу емкостью 100 мл и доводили водой до метки. В делительную воронку емкостью 25 мл последовательно вносили 10 мл хлороформа, 4,0 мл пробы и 0,5 мл 0,5 М раствора гидроксида натрия. Пробу экстрагировали в течение 1 минуты. Экстракт переносили в фарфоровую чашку и отгоняли хлороформ на водяной бане. К сухому остатку прибавляли 1,0 мл раствора соляной кислоты (ρ = 1,19 г/мл) и 10 мл воды, смывали остаток на дно чашки, количественно переносили в мерную колбу емкостью 50 мл и доводили водой до метки.
В сосуд для титрования помещали 40 мл 0,5 М раствора йодида калия, 10 мл раствора эозината натрия, 20 мл ацетатного буферного раствора (рН = 5,6). Ячейку продували воздухом и облучали видимым светом в течение 1–2 минут. Йод генерировали со скоростью 3,2·10–5 ммоль/мин до содержания его 4·10–5 ммоль. О концентрации титранта судили по изменению тока в цепи. После генерации йода отключали источник света и вводили 0,1–0,5 мл рабочего раствора препарата, фиксируя при этом изменение показаний гальванометра. После достижения постоянства силы тока ячейку вновь продували воздухом в течение 1–2 минут, облучали светом и измеряли время генерации, необходимое для восполнения убыли титранта. Для проведения последующих определений раствор, находящийся в сосуде для титрования, вновь облучали светом, генерируя в нем определенное количество йода. Один и тот же поглотительный раствор позволяет проводить 10–20 определений.
О количестве действующего вещества в аналите судили по градуировочным графикам, полученным с использованием стандартных растворов (рис. 1, 2).
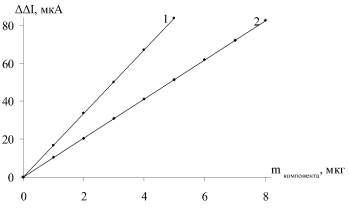
Рис. 1. Калибровочный график для определения метионина (1) и цистеина (2) по изменению силы тока: 1 – ΔΔI = 16,729 m + 0,0714, R2 = 1; 2 – ΔΔI = 10,3 m + 0,0556, R2 = 1
По результатам титрования модельных растворов метионина и цистеина найдено, что в кислой среде реакция с йодом протекает в соотношении 1:1 и 2:1 соответственно, что согласуется с литературными данными [1, 11]. Установлено, что вспомогательные компоненты таблеточной массы не мешают определению действующего вещества. Результаты определения препаратов, найденные фотохимическим методом по времени генерации (табл. 1–3), и изменению силы тока (табл. 1–3) согласуются между собой, а также с результатами, полученными по стандартной методике [2, 11]. Достоверность полученных результатов контролировали по стандартной методике и методом добавок.
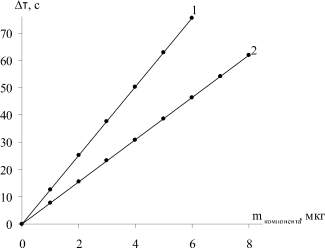
Рис. 2. Калибровочный график для определения метионина (1) и цистеина (2) по времени генерации: 1 – Δτ = 12,594 m – 0,0524, R2 = 1; 2 – Δτ = 7,7583 m – 0,0889, R2 = 0,9999
Таблица 1
Метрологические характеристики определения метионина в субстанции
|
Действующее вещество |
Фотохимический метод |
Метод [2, 11] |
||||
|
по силе тока |
по времени генерации |
|||||
|
Найдено, мг |
Метрологические характеристики |
Найдено, мг |
Метрологические характеристики |
Найдено, мг |
Метрологические характеристики |
|
|
Метионин |
99,7 99,8 99,7 100,2 100,0 100,3 99,9 |
Хср = 99,94 ∆Хср = 0,2 Sх = 0,2371 Sr = 0,002 εср = 0,22 % |
99,7 99,8 99,9 100,1 100,0 100,3 99,8 |
Хср = 99,94 ∆Хср = 0,1 Sх = 0,1504 Sr = 0,001 εср = 0,14 % |
99,6 99,8 99,5 100,3 100,2 100,3 100,0 |
Хср = 99,96 ∆Хср = 0,3 Sх = 0,3310 Sr = 0,003 εср = 0,31 % |
Примечание. Р = 95 %.
Таблица 2
Метрологические характеристики определения цистеина в субстанции
|
Действующее вещество |
Фотохимический метод |
Метод [2, 11] |
||||
|
по силе тока |
по времени генерации |
|||||
|
Найдено, мг |
Метрологические характеристики |
Найдено, мг |
Метрологические характеристики |
Найдено, мг |
Метрологические характеристики |
|
|
Цистеин |
99,2 99,0 99,8 99,7 99,9 100,2 100,3 |
Хср = 99,73 ∆Хср = 0,5 Sх = 0,4896 Sr = 0,005 εср = 0,45 % |
99,3 99,2 99,9 99,8 99,8 100,1 100,2 |
Х??ср = 99,76 ∆Хср = 0,4 Sх = 0,3780 Sr = 0,004 εср = 0,35 % |
99,0 99,5 99,0 100,5 100,3 99,8 99,6 |
Хср = 99,67 ∆Хср = 0,4 Sх = 0,3869 Sr = 0,004 εср = 0,37 % |
Примечание. Р = 95 %.
Содержание метионина и цистеина, найденных в анализируемых образцах, соответствуют заявленным в нормативных документах. Нижний предел определения составляет 0,06 и 0,10 мкг по силе тока, 0,08 и 0,13 мкг по времени генерации йода в поглотительной ячейке для метионина и цистеина соответственно.
Фотохимический способ определения метионина и цистеина характеризуется высокой точностью, экспрессностью, не требует дорогостоящего оборудования, что позволяет использовать его в условиях обычной контрольно-аналитической лаборатории.
Выводы
- Установлены стехиометрические коэффициенты реакции метионина и цистеина с фотогенерированным йодом, составляющие 1:1 и 2:1 соответственно.
- Установлено, что экстракция ацетилцистеина из щелочных растворов хлороформом позволяет проводить его количественное определение в комплексных лекарственных средствах.
- Разработана методика количественного определения тиоаминокислот (метионина, цистеина) в различных лекарственных формах, заключающаяся в титровании аналита фотогенерированным йодом
(Sr составляет 4,0–5,0 %).
Таблица 3
Результаты определения аминокислот в лекарственных средствах
|
Наименование ЛС |
Найдено в препарате |
|||||||||
|
фотохимический |
по [2, 11] |
|||||||||
|
по силе тока |
по времени генерации |
mпробы = 0,50 г |
||||||||
|
mпробы = 0,10 г |
mпробы = 0,20 г |
mпробы = 0,10 г |
mпробы = 0,20 г |
|||||||
|
, |
Sr, % |
, |
Sr, % |
, мг |
Sr, % |
, |
Sr, % |
, |
Sr, % |
|
|
Метионин1 |
62,5 ± 2,5 |
4,0 |
62,7 ± 2,4 |
3,8 |
62,1 ± 1,9 |
3,1 |
62,5 ± 2,5 |
4,0 |
62,3 ± 2,4 |
3,5 |
|
Метионин2 |
98,0 ± 4,0 |
4,1 |
99,1 ± 4,0 |
4,0 |
99,2 ± 3,7 |
3,7 |
99,6 ± 3,4 |
3,4 |
99,2 ± 3,1 |
3,1 |
|
Флуимуцил3 |
199,0 ± 7,5 |
3,8 |
200,0 ± 7,2 |
3,6 |
199,0 ± 7,4 |
3,7 |
200,0 ± 7,3 |
3,7 |
199,0 ± 7,2 |
3,6 |
|
АЦЦ-1004 |
99,0 ± 4,0 |
4,0 |
100,0 ± 3,9 |
3,9 |
100,0 ± 3,9 |
3,9 |
100,0 ± 3,8 |
3,8 |
99,0 ± 3,4 |
3,4 |
Примечание. (Р = 95 %, n = 5).1 - ООО «Озон», г. Жигулёвск (Россия), серия 020213; 2 - Фармстандарт-Юфавита, г. Уфа (Россия), серия 010313; 3 - Zambon (И), ?N 015474/01; талия), ПN 015474/01; 4 - С3u1586. алютас-Фарма ГмбХ (Германия), 3u1586.
Рецензенты:
Шевердов В.П., д.фарм.н., профессор, ФГБОУ ВПО «Чувашский государственный университет имени И.Н. Ульянова», г. Чебоксары;
Павлова С.И., д.м.н., профессор, ФГБОУ ВПО «Чувашский государственный университет имени И.Н. Ульянова», г. Чебоксары.
Работа поступила в редакцию 18.04.2014.



