Фототерапия, или терапия светом, существовала всегда. Еще в древнем Египте, например, существовал специальный храм, посвященный «всеисцеляющему лекарю» – солнечному свету. Однако наличие в его спектре опасного УФ излучения приводит к преждевременному старению, иммуносупрессии и раку кожи [8, 14]. Стратегия «полезного солнца» основывается на использовании новых материалов, специальных пленок-экранов, в состав которых введены мельчайшие частицы – субмикронные фотолюминофоры [6], которые не только поглощают негативное для организмов УФ излучение, но преобразуют его в оранжево-красную часть спектра, обладающего биостимулирующим действием [1, 7]. Использование таких материалов, содержащих фотолюминофоры, как мы показали ранее, обеспечило достижение позитивных результатов за счет преобразованного солнечного света на организм мышей линии СD-1 [6].
Целью данной работы было изучение действия солнечного света, преобразованного с помощью новых светопреобразующих материалов? на функциональные и структурные характеристики клеток сердечной мышцы гипертензивных крыс линии SHR.
Материал и методы исследования
Исследование проводилось на самцах гипертензивных крыс линии SHR (Spontaneously Hypertensive Rat) и нормотензивных крыс WKY (Wistar Kyoto), выращенных в питомнике лабораторных животных «Пущино» Филиала Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова и содержащихся в стандартных условиях при свободном доступе к пище и воде. Работа проведена на 15 крысах SHR (3 мес., вес 300 ± 50 г), 5 крысах Wistar-Kyoto (3 мес., вес 300 ± 50 г). У гипертензивных крыс наблюдалось стабильное повышенное артериальное давление (175 ± 9 мм рт.ст.), в отличие от нормотензивных крыс с давлением 115–130 мм рт.ст. У всех животных удаляли шерсть со спины площадью 4×6 см.
В качестве источника искусственного солнечного света использовали осветитель ЛОС-1 с ксеноновой лампой (мощность 150W). Для получения преобразованного солнечного света его пропускали через светопреобразующий экран на основе поликарбонатного пластика, покрытого слоем мелкодисперсного фотолюминофора Y1.9Eu0.1O2S, который трансформировал часть ультрафиолета в дополнительную оранжево-красную люминесцентную компоненту с λmax = 626. Крысы были разбиты на четыре группы. Первую группу сформировали контрольные нормотензивные WKY (контроль I), вторую – контрольные гипертензивные SHR (контроль II). В третьей группе крыс SHR облучали солнечным светом без УФ-компоненты (СС-УФ, опытная группа III; 30,6 Дж/см2), в четвертой группе – преобразованным солнечным светом (ПСС; опытная группа IV; 31,1 Дж/см2). Во время облучения животные находились в ограниченном пенале. Облучали ежедневно по 30 мин в день в течение 16 дней. Для устранения теплового эффекта был применен тепловой фильтр.
Выделенную из миокарда правого желудочка папиллярную мышцу помещали в термостатируемую (30 ± 1 °С) проточную камеру с физиологическим раствором (pH 7,4). Раствор оксигенировали карбогеном: О2 (95 %) и СО2 (5 %). Выделение папиллярных мышц, стимуляцию и регистрацию изометрических мышечных сокращений на базовой частоте 0,3 Гц проводили по ранее описанной методике [3]. Измерялись кинетические параметры сокращения: время достижения максимума сокращения, время полурасслабления. Для гистологического и электронномикроскопического изучения выделяли ткани из субэндокардиального отдела левого желудочка миокарда. Полученные образцы обрабатывали по общепринятой методике и заливали в эпон-812. Полутонкие срезы, ориентированные поперечно, окрашивали гематоксилином и эозином. На светооптическом уровне с помощью микроскопа NU-2E определяли относительную площадь капилляров (%), число капилляров на 1 мм2 среза, площадь сечения капилляров (мкм2). Ультратонкие срезы, ориентированные поперечно, изготавливали на ультратоме LKB-3 и контрастировали уранилацетатом и цитратом свинца. Срезы просматривали в электронном микроскопе JEOL 1010 при увеличении 10000. В процессе ультраструктурного анализа основное внимание уделяли изменениям в структуре саркоплазматического ретикулума. Измеряли также относительную площадь миофибрилл и относительную площадь митохондрий.
Статистическую обработку полученных данных проводили с помощью программы Microsoft Excel, SigmaPlot 11.0. Оценку достоверности результатов проводили по критерию Стьюдента, Манни ‒ Уитни, Пирсона.
Результаты исследования и их обсуждение
Папиллярные мышцы миокарда экспериментальных животных (крыс, морских свинок) являются удобной моделью для изучения сократительной активности сердца при различных воздействиях. Исследуемыми параметрами изометрического сокращения папиллярных мышц в наших экспериментах являлись кинетические характеристики сокращения, а именно, время достижения максимума сокращения и время полурасслабления. Поскольку известно, что саркоплазматический ретикулум является ключевым регулятором электромеханического сопряжения в сердечной мышце, то об эффективности работы саркоплазматического ретикулума можно косвенно судить по временным характеристикам развития сокращения мышцы [9].
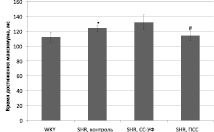
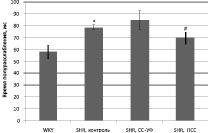
В результате экспериментов было установлено, что кинетические параметры изометрических сокращений папиллярной мышцы у контрольной SHR группы превышают значения, полученные у нормотензивных крыс WKY группы, что обычно характерно для крыс линии SHR (рисунок) [13].
Хроническое облучение крыс SHR группы искусственным солнечным светом (СС-УФ) выявило дальнейшее увеличение временных параметров сокращения папиллярной мышцы (p < 0,05).
Длительное воздействие преобразованным светом у крыс (опытная группа IV; ПСС) показало уменьшение времени достижения максимума сокращения и времени расслабления более чем на 20 % относительно показателей, полученных у нативных гипертензивных крыс (контроль II). Таким образом, данное воздействие значительно нормализовало сократительную активность папиллярных мышц крыс SHR, достоверно приближая их функциональные значения к кинетическим характеристикам мышц нормотензивных крыс, полученных в наших исследованиях (р < 0,05).
На светооптическом уровне было выявлено, что у крыс SHR имеются значительные отличия в структуре сердечной мышцы по сравнению с нормотензивными крысами. В первую очередь отмечается низкий уровень капилляризации, что согласуется с литературными данными [2]. Число капилляров снижено почти на 30 %, также существенно ниже средняя площадь сечения капилляров (табл. 2).
Электронно-микроскопическое изучение кардиомиоцитов левого желудочка клеток сердечной мышцы выявило, что у нативных гипертензивных крыс линии SHR (контроль II) имеются значительные отличия в структуре сердечной мышцы по сравнению с нормотензивными крысами WKY. Особенно это различие было заметно в структуре саркоплазматического ретикулума. Он имел недостаточное развитие и был представлен короткими канальцами и малочисленными цистернами, а его относительная площадь в миоцитах гипертензивных крыс была почти в 3 раза меньше по сравнению с нормотензивными животными (р < 0,005). Также была снижена относительная площадь митохондрий на 14 % (р < 0,05). Эти данные согласуются с результатами, полученными нами в предыдущих экспериментах [6].
 а
а
 б
б
Временные характеристики изометрического сокращения папиллярной мышцы: а – время достижения максимума; б – время полурасслабления. * – сравнение значений между WKY и SHR, контроль; # – сравнение значений SHR, контроль, и SHR, облученными преобразованным солнечным светом (р < 0,05, U-критерий; M ± σ)
Продолжительное облучение крыс SHR солнечным светом без УФ-компоненты (СС-УФ) заметно повлияло на структуру кардиомиоцитов. Были обнаружены выраженные изменения ультраструктуры митохондрий и миофилламентов, свидетельствующие об их гиперфункции с признаками патологического сдвига (табл. 1). Наблюдался некоторый отёк миофибрилл, их разволокнение, ход миофилламентов менялся от продольного к косому, относительная площадь миофибрилл заметно снижалась на 25 % (р < 0,005). В противоположность этому, относительная площадь митохондрий увеличивалась (на 20 %, р < 0, 005), однако в структуре многих митохондрий встречались патологические изменения: набухание, разрывы внутренней и внешней мембран с частичной деградацией митохондрий. Обнаруженные изменения ультраструктуры митохондрий и миофилламентов свидетельствуют об их гиперфункции. Так же увеличивалась относительная площадь саркоплазматического ретикулума (на 20 %, р > 0,05). Эти данные отражают повышенную функциональную активность кардиомиоцитов и свидетельствуют об отрицательном воздействии продолжительного курса облучения искусственным солнечным светом на организм животных.
Облучение гипертензивных крыс SHR преобразованным солнечным светом положительно повлияло на структуру кардиомиоцитов (табл. 1).
Как видно из табл. 2, у контрольных крыс SHR площадь, занимаемая капиллярами, количество капилляров на единицу площади среза и средняя площадь сечения капилляров были достоверно ниже по отношению к показателям нормотензивных животных. После облучения ПСС у крыс достоверно увеличиваются все три показателя. Между числом капилляров на единицу площади и площадью сечений капилляров наблюдается слабая отрицательная связь (P = –0,392, p > 0,05), что может свидетельствовать о большем вкладе неоангиогенеза в увеличение процентного отношения площади, занимаемой капиллярами, чем о вкладе увеличения диаметра капилляров или увеличения числа открытых капилляров после облучения ПСС. Интересно, что стимуляцию неоваскулогенеза часто наблюдают после облучения красным светом лазера [5, 15].
Ультраструктурный анализ показал, что облучение преобразованным солнечным светом привело к увеличению относительной площади митохондрий (на 11 %, р > 0,05) и улучшению их морфологического состояния. Отмечались скопления митохондрий, преимущественно небольшого размера, в центральных областях клеток и околоядерной зоне. Предполагается, что это свидетельствует об активизации процессов биосинтеза в клетках [5]. Хотя мы не обнаружили увеличения относительной площади профилей миофилламентов по отношению к значениям, полученным у контрольных крыс, следует отметить практически полное отсутствие патологических изменений в их структуре. Основное изменение претерпевала структура саркоплазматического ретикулума, его размеры увеличились более чем в 2 раза (р < 0,001).
Таблица 1
Количественная морфологическая характеристика паренхиматозно-стромальных взаимоотношений миокарда крыс (M ± m)
|
Параметр |
WKY (I) |
SHR (II) |
SHR (III) |
SHR (IV) |
|
Относительная площадь миофибрилл, мкм2/мкм2 |
0,40 ± 0,03 |
0,43 ± 0,05 |
0,33 ± 0,073* |
0,43 ± 0,07 |
|
Относительная площадь митохондрий, мкм2/мкм2 |
0,27 ± 0,02 |
0,23 ± 0,061* |
0,29 ± 0,063* |
0,26 ± 0,04 |
|
Относительная площадь саркоплазматического ретикулума, мкм2/мкм2 |
0,028 ± 0,010 |
0,009 ± 0,0031** |
0,012 ± 0,0032** |
0,021 ± 0,0044,5** |
Примечания:
* – уровень значимости p < 0,05; ** – уровень значимости p < 0,001, t-критерий
1 – сравнение значений в группах крыс WKY и SHR II
2 – сравнение значений в группах крыс WKY и SHR III
3 – сравнение значений в группах крыс SHR II и SHR III
4 – сравнение значений в группах крыс SHR II и SHR IV
5 – сравнение значений в группах крыс SHR III и SHR IV
Таблица 2
Анализ капилляров субэндокарда левого желудочка крыс
|
Показатель |
WKY |
SHR, контроль |
SHR, ПСС |
|
Относительная площадь капилляров, % |
6,5 ± 0,9 |
4,2 ± 0,6 |
6,3 ± 0,7* |
|
Число капилляров на 1 мм2 среза |
1960,8 ± 53,0 |
1781,8 ± 147,0 |
2029,5 ± 195,0* |
|
Площадь сечения капилляров, мкм2 |
22,5 ± 1,0 |
19,9 ± 0,4 |
23,4 ± 0,7* |
Примечание. * – достоверная разница по сравнению с контролем (р < 0,05; Х критерий).
Таким образом, мы обнаружили, что в результате продолжительного воздействия искусственного солнечного света (СС-УФ) наблюдаются патологические изменения в ультраструктуре кардиомиоцитов, сопровождающиеся пролонгированием кинетических характеристик мышечного сокращения, что характерно, в частности, для стареющих гипертензивных крыс in situ [10]. В отличие от этого, воздействие преобразованным солнечным светом (ПСС) улучшает ультраструктурные характеристики кардиомицитов гипертензивных животных, в частности, происходит значительное увеличение объемов саркоплазматического ретикулума, и параллельно с этим сокращаются временные параметры сокращения, что косвенно указывает на повышение скорости обмена кальция в клетке [12].
Как известно, саркоплазматический ретикулум активно регулирует гомеостаз ионов кальция и поскольку установлено, что у крыс и мышей основной вклад в регуляцию силы сокращения сердечной мышцы вносит именно кальций ретикулума [9], увеличение его буферных возможностей может иметь дополнительное положительное влияние на процессы сокращения-расслабления в сердечной мышце [11]. Возможно также, что облучение оранжево-красным светом улучшает работу Ca2+ –ATФазы ретикулума, как это было обнаружено в экспериментах с низкоинтенсивным лазерным облучением [4].
Таким образом, мы установили, что облучение оранжево-красным светом, полученным путем трансформации УФ-компоненты через специальный светопреобразующий экран, оказывает положительное влияние на структурно-функциональные характеристики в клетках сердечной мышцы гипертензивных крыс линии SHR, и хорошо согласуется с результатами, полученными нами ранее в экспериментах на мышах [6].
Работа выполнена при поддержке стипендии Президента (СП-6350.2013.4).
Рецензенты:
Павлик Л.Л., д.б.н., ФГБУН «Институт теоретической и экспериментальной биофизики Российской академии наук», г. Пущино;
Гапеев А.Б., д.ф.-м.н., профессор, ФГБУН «Институт биофизики клетки РАН», г. Пущино.
Работа поступила в редакцию 28.07.2014.



