Диагностика поражений нервной системы у доношенных новорожденных в первые дни жизни обусловлена трудностью дифференцирования физиологических адаптационных процессов от патологических, как при клиническом осмотре, так и при использовании современных лабораторно-диагностических методов, которые не всегда могут предоставить объективную информацию о степени тяжести заболевания и последующем прогнозе [1,2,3,4].
Основываясь на учении Г. Селье и Г.Х. Гаркави о реализации неспецифического адаптационного стресс-синдрома, доказавших существование последовательно возникающих неспецифических адаптационных реакций организма и установивших, что для каждого адаптационного типа характерен комплекс изменений в нейро-эндокринной системе, проявляющейся количественным и качественным изменением структуры лимфоцитов [2,3,4,5,6,7,8,9].
Нами проведено комплексное исследование структуры лимфоцитов периферической крови (кариометрия) и ультразвуковое исследование головного мозга у доношенных новорожденных для оценки компенсаторно-адаптационных реакций при поражениях нервной системы.
Целью настоящей работы явилось изучение адаптационно-компенсаторных реакций в неонатальном периоде у доношенных новорожденных детей с гипоксически-ишемическим и травматическим поражением нервной системы.
Материалы и методы
Обследовано 310 доношенных детей в 2011-2013 гг. на базе МАБУ ДГБ №1 г. Томска (главный врач А.П. Балановский) и ЛОЦ «Здоровая мама – крепкий малыш» г. Томска (руководитель центра д-р мед. наук, профессор Т.С. Кривоногова).
Катамнестическое наблюдение исследуемых детей проводилось в несколько этапов. На I этапе (родильный дом или отделение патологии новорожденных) оценивалась динамика симптомов и синдромов заболевания, проводилось комплексное инструментальное обследование, включающее нейросонографию головного мозга, рентгенологическое обследование головы и шейного отдела позвоночника в двух проекциях, ультразвуковое обследование органов грудной и брюшной полости. Клинический диагноз был установлен на основании данных анамнеза, оценки неврологического и соматического статуса, инструментальных и лабораторных методов исследования. В возрасте одного месяца, на II этапе (амбулаторно-поликлиническом) оценивали динамику течения заболевания, общее состояние ребенка, оценка физического развития и проводилось дополнительное инструментальное обследование, включающее определение нейроспецифической енолазы (NSE), методом твердофазного ИФА наборами фирмы «CanAg» (Канада), нейровизуализация структуры головного мозга ультразвуковым аппаратом «Аloca» SSD 650» (Япония), а также морфологическое исследование лимфоцитов периферической крови. Исследование морфологии лимфоцитов капиллярной крови производилось на мазках, до лечения, приготовленных по традиционной гематологической методике. Мазки фиксировали в метаноле и окрашивали по Нохту-Максимову. Изображение лимфоцитов получали со светового микроскопа Axiostarplus (Carl Zeiss, Германия), оснащенного цифровой фотокамерой. Анализ полученных изображений лимфоцитов, измерение площади, периметра клетки и ядра проводили с использованием программы Image J, разработанной by Wayne Rasband, National Institute soft Health (USA) и свободно доступной на публичном домене в сети Internet [10]. Для измерения размеров лимфоцитов предварительно производили съёмку объект-микрометра при тех же условиях, что и съёмка лимфоцитов, и калибровали шкалу измерения в мкм. Для каждого лимфоцита измеряли площадь, периметр клетки и ядра. На каждом мазке до лечения было обмерено 50 лимфоцитов.
В результате исследования новорожденные были разделены на две группы. В первую группу сравнения вошли 120 доношенных новорожденных с гипоксически-ишемическим поражением ЦНС (рубрика Р91.0 по МКБ-10), гестационным возрастом 38-40 недель, средней массой тела 3530(3419-3746) г.
Во вторую группу сравнения вошли 120 доношенных новорожденных с травматическим поражением ЦНС (рубрика Р10.0 по МКБ-10), гестационным возрастом 38-40 недель, средней массой тела 3780 (3479-3872) г.
Группу контроля составили 50 здоровых доношенных новорожденных, родившихся при сроке гестации 39(38-40) недель.
Диагноз ставился в соответствии с «Классификацией перинатальных поражений нервной системы у новорожденных» (2000) и «Классификацией последствий перинатальных поражений нервной системы у детей раннего возраста» (РАСПМ, 2005).
Критериями для включения детей в первую и вторую группы являлись: гестационный возраст новорожденных 38-40 недель; отсутствие во время беременности клинических и лабораторных данных, свидетельствующих о течении инфекционного процесса; отсутствие генетической патологии, врожденных пороков развития по данным клинического осмотра и инструментальных методов обследования; отсутствие клинических и лабораторных признаков ТОRСН-синдрома у новорожденных; отрицательные показатели неспецифических признаков воспаления в общем анализе крови и биохимических показателях; отсутствие клинических признаков местной гнойно-воспалительной патологии; наличие информированного согласия родителей.
Статистическую обработку полученных данных проводили с использованием прикладного программного пакета R-system. Проверку на нормальность распределения признака определяли с помощью W-теста Шапиро-Уилка. Проводился описательный и сравнительный анализ. Данные представлены в виде среднего (Me), а также квартильного отклонения (Q1-Q3) для ненормально и несимметрично распределенных параметров. Сравнительный анализ основывался на определении достоверности разницы показателей по U-критерию Манна-Уитни для не нормально распределенных параметров. Критический уровень значимости (р) при проверке статистических гипотез в исследовании принимался равным 0,05. Анализ зависимости признаков проводился с помощью расчета и оценки значимости непараметрического коэффициента корреляции Спирмена.
Результаты исследования
Общее состояние новорожденных детей групп сравнения в раннем неонатальном периоде расценивалось как легкое либо средней степени тяжести, что было обусловлено неврологической симптоматикой. Статистически значимых отличий по сроку гестации и средней массе тела у новорожденных исследуемых групп не было выявлено.
Среди 120 новорожденных с гипоксически-ишемическим поражением ЦНС через естественные родовые пути родилось 84 (70 %) ребенка, в результате кесарева сечения 36 (30 %) детей. Показаниями для экстренного абдоминального родоразрешения были слабость родовой деятельности 19 (15,8 %), не поддающаяся корригирующей терапии; клинически узкий таз 11(9,2 %); неправильное положение плода 6(5 %). У 20 (16,7 %) детей отмечалась задержка внутриутробного развития по гипотрофическому типу I степени, 23 (19,2 %) ребенка родилось в удовлетворительном состоянии; в состоянии кардиореспираторной депрессии – 17 (14,2 %) и в асфиксии – 15 (12,5 %) новорожденных.
В группе новорожденных с травматическим поражением ЦНС через естественные родовые пути родилось 62 (51,6 %) ребенка, проведения операции кесарева сечения понадобилось 58 (48,3 %) женщинам. У 23 (19,2 %) женщин наблюдалась слабость родовой деятельности; клинически узкий таз 17 (14,2 %); неправильное положение плода 16 (13,3 %), короткая пуповина плаценты 2 (1,6 %). У 16 (13,3 %) детей отмечалась задержка внутриутробного развития по гипотрофическому типу I степени, 15(12,5 %) детей родились в удовлетворительном состоянии, в состоянии кардиореспираторной депрессии 14 (11,7 %) новорожденных и в асфиксии 8 (6,7 %) новорожденных.
Клиническая картина неврологических синдромов в неонатальном периоде у новорожденных первой и второй групп статистически не отличалась. Неврологическая симптоматика у детей первой группы характеризовалась синдромами возбуждения – 64 (53,3 %) пациента, внутричерепной гипертензии – 77 (64,2 %) детей, вегето – висцеральных нарушений – 98 (81,6 %) наблюдений. В группе детей с травматическим поражением ЦНС выявлялись синдромы возбуждения – 73 (60,8 %) случая, внутричерепной гипертензии – 86 (71,6 %) пациентов, вегето – висцеральных нарушений – 91 (75,8 %) ребенок.
К первому месяцу жизни сывороточная концентрация нейроспецифической енолазы (NSE) в первой группе новорожденных составляла 0,081(0,064-0,103) (мкг/л), во второй группе – 0,093(0,072-0,150) (мкг/л), в группе контроля – 0,067(0,055-0,082) (мкг/л), статистически значимых отличий между группами не выявлено.
К концу неонатального периода при статистическом анализе показателей кариограммы лимфоцитов были выявлены статистически значимые отличия между группами (табл. 1).
Таблица 1
Показатели кариометрии лимфоцитов в зависимости от этиопатогенеза поражения нервной системы у доношенных новорожденных в возрасте 1-го месяца, Me (Q1-Q3).
|
Показатели |
Группа контроля (n=50) |
Первая группа (n=120) |
Вторая группа (n=120) |
|
Среднее значение диаметра ядра (мкм)
|
64,72 (64,27-64,97)
|
58,28 (55,03-60,57) р=0,001 р1-2=0,001 |
70,44 (66,99-73,96) р=0,001
|
|
Среднее значение диаметра клетки (мкм) |
94,78 (91,78-97,21) |
80,71 (74,53-86,78) р=0,001 р1-2=0,001 |
105,46 (97,21-114,61) р=0,001
|
|
Среднее значение периметра ядра (мкм)
|
29,61 (29,40-29,86) |
28,38 (27,02-29,93) р=0,001 р1-2=0,001 |
30,87 (30,18-31,65) р=0,001
|
|
Среднее значение периметра клетки (мкм) |
35,21 (34,42-36,26) |
32,58 (31,19-33,97) р=0,001 р1-2=0,001 |
37,32 (35,40-39,07) р=0,001
|
Примечание: р – статистические отличия c группой контроля
р1-2 – статистические отличия между группами сравнения
В месячном возрасте при сравнительном анализе показателей морфоструктуры лимфоцитов у детей первой группы лимфоциты имели ядра с мелкодисперсным хроматином, характеризующий усиленный апоптоз, что подтверждало наличие ишемического процесса. У детей второй группы при оценке показателей кариограммы регистрировались лимфоциты со сниженным содержанием хроматина в ядрах и также наблюдалось увеличение числа лимфоцитов с полиплоидными ядрами, что выявляло не только тяжесть ишемического процесса, но и наличие стрессора (дисциркуляторные процессы в нервной ткани) [5,6,7,8,9,11].
В месяц жизни при статистическом анализе показателей нейросонограммы были выявлены статистически значимые отличия между группами сравнения и группой контроля (табл. 2).
Таблица 2
Показатели нейросонограммы у доношенных новорожденных в зависимости от этиопатогенеза поражения нервной системы в возрасте 1-го месяца, Me (Q1-Q3).
|
Показатели |
Группа контроля (n=50) |
Первая группа (n=120) |
Вторая группа (n=120) |
|
Глубина переднего рога левого желудочка (мм) |
1,6 (1,2-2,0) |
2,2 (1,9-3,0) р=0,001 |
2,0 (1,5-2,8) |
|
Глубина тела левого желудочка (мм) |
1,4 (1,0-2,0) |
2,0 (2,0-3,0) р=0,001 |
2,0 (1,5-2,7) р=0,004 |
|
Ширина затылочного рога левого желудочка (мм) |
10,7 (10,0-11,0) |
11,4 (10,7-12,0) р=0,003 р1-2=0,026 |
11,0 (10,0-11,4) р=0,001
|
|
Глубина переднего рога правого желудочка (мм) |
1,6 (1,2-2,0) |
2,4 (2,0-3,4) р=0,001 р1-2=0,024 |
2,0 (1,5-3,0) р=0,01 |
|
Глубина тела правого желудочка (мм) |
1,4 (1,0-2,0) |
2,0 (2,0-3,0) р=0,001 |
2,0 (1,8-3,0) р=0,001 |
|
Ширина затылочного рога правого желудочка (мм) |
10,7 (10,0-11,0) |
12,0 (10,7-13,0) р=0,001 |
11,0 (10,0-12,0) р=0,001 |
|
Коронарное сечение переднего рога слева (мм) |
2,0 (1,5-2,0) |
2,4 (2,0-3,2) р=0,001 |
2,1 (2,0-2,9) р=0,001 |
|
Коронарное сечение переднего рога справа (мм) |
2,0 (1,5-2,0) |
2,9 (2,0-3,6) р=0,001 р1-2=0,031 |
2,0 (2,0-3,0) р=0,001 |
|
Третий желудочек (мм) |
3,0 (2,6-3,0) |
3,4 (2,8-3,8) р=0,001 р1-2=0,001 |
4,8 (4,6-5,2) р=0,001
|
|
Субарахноидальное пространство слева (мм) |
1,8 (1,5-1,8) |
2,2 (2,0-2,8) р=0,001 |
2,4 (2,0-3,8) р=0,001 |
|
Субарахноидальное пространство справа (мм) |
1,8 (1,5-1,8) |
2,2 (2,0-2,8) р=0,001 |
2,4 (2,0-3,7) р=0,001 |
|
Межполушарная борозда (мм) |
2,8 (2,4-3,0) |
3,8 (3,0-5,1) р=0,001 |
3,95 (3,0-5,6) р=0,001 |
Примечание: р – статистические отличия c группой контроля
р 1-2 – статистические отличия между группами сравнения
При сравнительной характеристике показателей нейросонограммы к месяцу жизни у детей первой группы наблюдалось перераспределение ликвора в боковые желудочки головного мозга с асимметрией рогов боковых желудочков и расширение межполушарной щели, что подтверждало склонность этих детей к гидроцефалии. У детей второй группы на нейросонограмме регистрировалось увеличение субарахноидального пространства, расширение межполушарной щели и размеров третьего желудочка, указывающего на окклюзионные процессы в ликворной системе головного мозга детей [12].
При проведении статистического анализа были получены прямые корреляционные взаимосвязи между средним значением диаметра ядра и средним значением диаметра клетки лимфоцитов периферической крови с размерами третьего желудочка на нейросонограмме (r=0,52; p=0,05 и r=0,46; p=0,05). Также были установлены обратные корреляционные взаимосвязи среднего значения диаметра ядра и среднего значения диаметра клетки лимфоцитов периферической крови с шириной затылочного рога на нейросонограмме (r=-0,29; p=0,05 и r=-0,30; p=0,05), что подтверждает ранее полученные результаты о влиянии тяжести ишемических процессов в нервной системе на морфологию лимфоцитов периферической крови [2,5,6,7,8,9,11,12].
Проведенный математический анализ показателей нейросонограммы и морфологии лимфоцитов периферической крови позволил предложить математическую модель дифференциальной диагностики гипоксически-ишемических и травматических поражений нервной системы у доношенных новорожденных в неонатальном периоде.
Для построения данной диагностической модели использовали самообучающуюся искусственную нейронную сеть, где входными показателями нейросети были взяты 12 стандартных статистически значимых показателей нейросонограммы, а также 4 статистически значимых показателя морфологии лимфоцитов. Диагноз, определяемый нейронной сетью, представляется в ячейке выходных показателей в виде цифры, которая обозначает один из классов заболеваний. Так, при значении выходного показателя 0 диагностируется отсутствие заболевания. При значении выходного показателя 1 диагностируется гипоксически- ишемическое поражение ЦНС. При значении выходного показателя 2 диагностируется гипоксически-травматическое поражение ЦНС.
Математическая модель описывает работу уже обученной нейронной сети, осуществляя прямое распространение сигнала по закону:
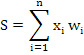
где n – число входов нейрона; xi – значение i-го входа нейрона; wi – вес i-го синапса (вес коэффициентов нейронной сети). Проведенная оценка диагностической значимости предложенного подхода показала, что полученная нами модель обладает высокой степенью распознавания: специфичность модели – 89,2 %, чувствительность – 92 %.
Выводы
Результаты проведенного исследования позволяют прийти к заключению, что в зависимости от тяжести и длительности ишемических процессов в нервной системе происходило количественное изменение хроматина в ядрах лимфоцитов периферической крови. У доношенных новорожденных с гипоксическим поражением нервной системы компенсаторно-приспособительная реакция характеризовалась сохранностью адаптационно-компенсаторных возможностей организма. У доношенных новорожденных с травматическим поражением нервной системы выявлялось наличие стрессора, сопровождающееся нарастанием тяжести ишемических процессов, проявляющееся снижением адаптационно-компенсаторных возможностей организма.
Статистически значимые показатели кариометрии лимфоцитов периферической крови и нейросонограммы позволили создать математическую модель дифференциальной диагностики гипоксически-ишемических и травматических поражений нервной системы у доношенных детей к месяцу жизни.
Данную модель дифференцирования рекомендуется использовать как дополнительный лабораторно-диагностический метод определения клинического диагноза, с целью оценки прогноза заболевания, тактики ведения и создания индивидуальной программы реабилитации для детей различных групп риска в лечебно-профилактических учреждениях амбулаторно-поликлинического этапа.
Рецензенты:
Желев В.А., д.м.н., профессор, профессор кафедры госпитальной педиатрии ГБОУ ВПО СибГМУ Минздрава России, г. Томск;
Нагаева Т.А., д.м.н., профессор, зав. кафедрой поликлинической педиатрии с курсом пропедевтики детских болезней ГБОУ ВПО СибГМУ Минздрава России, г. Томск.
Работа поступила в редакцию 24.06.2014.



