Портальная гипертензия (ПГ) – один из ведущих синдромов, характерных для цирроза печени (ЦП) [1]. При ПГ в круг патологических расстройств вовлекается сосудистое русло всех органов брюшной полости. Для данного осложнения характерны следующие проявления: пищеводно-желудочное кровотечение из варикозно расширенных вен (ВРВ) пищевода и желудка, асцит, гепато-ренальный синдром, энцефалопатия, спонтанный бактериальный перитонит [3, 6, 8]. Наиболее опасное и нередко фатальное для больного осложнение – варикозное кровотечение [4, 10].
Основные сосудистые коллекторы, в области которых чаще всего происходят такие геморрагии, располагаются в кардио-эзофагеальной зоне, а именно в нижней трети пищевода и кардиального отдела желудка. Именно здесь при ПГ формируется один из самых клинически значимых порто-кавальных анастомозов между левой желудочной веной (ЛЖВ), являющейся ветвью воротной вены (ВВ) и непарной и полунепарной венами, несущими кровь в верхнюю полую вену [2, 12].
Существует множество медикаментозных, эндоскопических и хирургических методов гемостаза при варикозных кровотечениях. Однако, несмотря на это, результаты лечения подобных пациентов в большинстве случаев остаются неудовлетворительными [9, 11]. Операция трансъюгулярного внутрипеченочного портосистемного шунтирования (TIPS/ТИПС) нашла широкое применение в клинической практике в лечении ПГ с целью остановки и профилактики рецидивов кровотечений из ВРВ пищевода и желудка ввиду миниинвазивности, отсутствия широкого хирургического доступа и многочасового анестезиологического пособия, которые могут усугубить течение фонового заболевания и смерти пациента [5, 7]. Известна разновидность выполнения TIPS/ТИПС с последующей эмболизацией ЛЖВ и пищеводных вен. После установки внутрипеченочного стента через созданный портосистемный шунт в ЛЖВ проводят ангиографический катетер и устанавливают эмболизационные спирали, тем самым редуцируя кровоток в пищеводных вариксах. Данная манипуляция приводит к снижению риска рецидива пищеводного кровотечения в случае дисфункции внутрипеченочного шунта [9].
Проведя анализ литературных данных, следует сказать, что эндоваскулярная эмболизация ЛЖВ является эффективной дополнительной манипуляцией к портосистемному шунтирующему вмешательству в лечении и профилактике варикозных пищеводно-желудочных кровотечений. Успех выполнения данного оперативного пособия зависит от особенностей анатомического строения системы ВВ и в частности ЛЖВ.
Цель исследования – оценить эффективность выполнения операции TIPS/ТИПС в сочетании с селективной эмболизацией ЛЖВ в лечении и профилактике варикозных пищеводно-желудочных кровотечений при ПГ путем клинико-анатомического обоснования данной манипуляции.
Материалы и методы исследования
Материалом для исследования послужили данные, полученные при анализе клинических, ультразвуковых, томографических и ангиографических данных. В хирургической клинике РостГМУ в период с 2007 по 2014 гг. операции TIPS/ТИПС подверглись 144 пациента с ПГ цирротического генеза. Отметим, что 102 пациентам основным показанием к оперативному вмешательству стали продолжающиеся или состоявшиеся в недавнем анамнезе пищеводно-желудочные кровотечения. В 52 случаях данное вмешательство дополнено селективной эмболизацией ЛЖВ. С целью оценки эффективности выполнения эмболизации ЛЖВ и обоснованности ее применения в профилактике варикозных кровотечений проведен ретроспективный анализ клинических случаев. Сформированы 2 сопоставимые клинические группы путем случайной выборки из общего количества больных. В каждую группу вошли по 35 больных. Больным I группы выполняли операцию TIPS/ТИПС, во II – основной этап оперативного пособия дополняли селективной эмболизацией ЛЖВ. Возраст больных – от 27 до 74 лет (в среднем 47,9 ± 6,8). Распределение больных в выборке по степени тяжести печеночной недостаточности в соответствии с критериями Чайлд-Пью было следующим: 3 человека относились к классу А, 35 – к классу В, 32 – к классу С. Отметим, что группы были сопоставимы по полу и возрасту, а также по количеству больных в зависимости от класса хронической печеночной недостаточности. Как видно, большинство больных обеих групп находились в суб- и декомпенсированных стадиях заболевания. В предоперационном периоде наряду с рутинными методами обследования всем больным выполнялось дуплексное сканирование системы ВВ и селезеночной вены для определения их диаметра, линейной, объемной скоростей кровотока, его характера. С целью оптимизации прогноза проведения TIPS/ТИПС в контексте предстоящего вмешательства и оценки внутрипаренхиматозного топографоанатомического расположения браншей ВВ, визуализации внепеченочных ветвей спленопортального ствола у больных с ЦП выполнялась компьютерная спленопортография. Также оценивались анатомические особенности ЛЖВ. Основными показаниями для выполнения эмболизации явились наличие пищеводных кровотечений в анамнезе, рентген-ангиографическое подтверждение варикозно расширенных вен (ВРВ) пищевода. Обязательным завершающим этапом хирургического пособия являлась контрольная прямая портография. Критерием адекватного выполненного вмешательства было контрастирование ВВ, внутрипеченочного стента без дефектов наполнения, а также отсутствие кровотока по ранее выявленным ВРВ пищевода.
Результаты исследования и их обсуждение
Правильная оценка рентген-анатомических особенностей ВВ и ее внутрипеченочных ветвлений в контексте предстоящей операции TIPS/ТИПС является залогом успешного создания внутрипеченочного канала с целью эффективной декомпрессии портальной системы. Весьма информативную картину представления о состоянии сплено-портального русла и особенностей анатомии ЛЖВ на дооперационном этапе дает компьютерная сплено-портография (рис. 1).
Во всех случаях было выявлено, что при ПГ в первую очередь расширяются сосуды, расположенные ближе к воротам печени. Такими сосудами являются ЛЖВ, селезеночная и мезентериальные вены. Объясняется это тем, что развивающийся гепатофугальный кровоток всегда идет по пути наименьшего сопротивления. Кроме этого, визуализировались расширенные порто-кавальные анастомозы области ворот печени и селезенки. У больных обеих групп отмечено расширение ЛЖВ (1) и извитые пищеводные вены (5) (рис. 1). В нескольких случаях контрастировались расширенные и варикозно-трансформированные венозные стволы выше диафрагмы, впадающие в систему непарной и полунепарной вен (пути оттока в систему верхней полой вены) (рис. 2). В ряде случаев для более детальной оценки анатомического строения системы ВВ и в частности ЛЖВ нами использовалась 3D-реконструкция изображения (рис. 3). Отметим, что ВРВ пищевода у пациентов визуализировались при выполнении эзофагогастродуоденоскопии (ЭГДС).
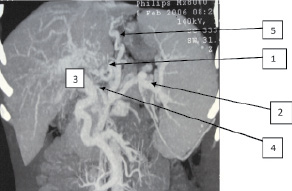
Рис. 1. Пациентка Л., 45 лет. СКТ-ангиография: 1 – варикозно трансформированная ЛЖВ; 2 – селезеночная вена; 3 – ВВ; 4 – устье впадения ЛЖВ в ВВ; 5 – нижние пищеводные вены
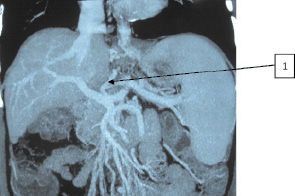
Рис. 2. Пациентка К., 54 лет. СКТ-ангиография. 1 – ЛЖВ
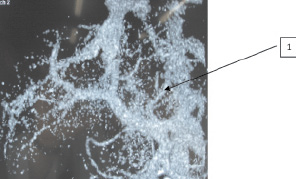
Рис. 3. Пациентка К., 54 лет. СКТ-ангиография, 3D-реконструкция. 1 – ЛЖВ
Во всех случаях II группы наблюдения этап эмболизации стал дополнением основному эндоваскулярному хирургическому мероприятию. Основными показаниями к данной манипуляции служили пищеводно-желудочные кровотечения в анамнезе и возможность технического исполнения. Непосредственно перед оперативным пособием для визуализации анатомических особенностей порто-печеночного русла применялась селективная ангиография данных венозных сосудов. После установки внутрипеченочного стента выполнялась контрольная прямая портография. Помимо оценки функционирования внутрипеченочного шунта, мы обращали внимание на наличие ВРВ пищевода и варикозно трансформированной ЛЖВ (рис. 4).
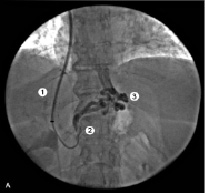
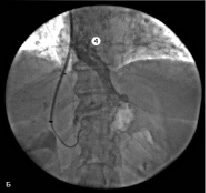
Рис. 4. Пациентка Д., 35 лет: 1 – стент; 2 – левая желудочная вена; 3, 4 – варикозно расширенные вены
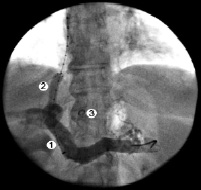
Рис. 5. Пациентка Д., 35 лет: 1 – ВВ; 2 – TIPS/ТИПС; 3 – спираль Gianturco
На представленных ангиограммах (прямая портограмма) визуализируются ВРВ пищевода. Селективно катетеризирован ствол ЛЖВ. Эмболизация производилась спиралями Gianturco, которых требовалось от одной до четырех, в зависимости от диаметра данных сосудов. Критерием ее эффективности было отсутствие ретроградного кровотока по эмболизированным сосудам и контрастирования вариксов при контрольной ангиографии (рис. 5).
У двух больных ЛЖВ была представлена несколькими стволами. В подобных случаях мы раздельно катетеризировали каждый из варикозных стволов с последующей эмболизацией.
Как видно, процедуру эмболизации ЛЖВ, дополняющую шунтирование системы ВВ, мы выполнили в 36,1 % случаев от общего количества больных. У пациентов I группы селективная эмболизация ЛЖВ в ряде случаев не выполнялась. Техническая невозможность исполнения данной манипуляции даже при рентгенологически подтвержденной картине наличия ВРВ пищевода объяснялась зависимостью от анатомических особенностей ЛЖВ и угла отхождения ее ствола ВВ. Наличие острого угла α (угол между ВВ и ЛЖВ) в 30° и менее представляло технические трудности в селективной катетеризации ЛЖВ либо вен пищевода с помощью катетера диаметром 5–6 F типа Cobra. Наличие выраженных ВРВ пищевода более 15 мм в диаметре также не являлось показанием к селективной эмболизации ЛЖВ. Объясняется это тем, что сброс портальной крови в нижнюю пищеводную вену происходил не только через ЛЖВ, но и через селезеночную вену, далее в левую желудочно-сальниковую, короткие желудочные вены, вены подслизистого слоя тела и дна желудка и далее в пищеводные. В подобных случаях пищеводные вены имели несколько венозных притоков. Кроме этого, наличие большего диаметра расширенных вен является предрасполагающим фактором к миграции эмболизационных спиралей.
Проанализировав полученные данные, мы установили следующие показания к селективной эмболизации ЛЖВ, дополняющей операцию портосистемного шунтирования:
- острое или состоявшееся в анамнезе кровотечение из ВРВ пищевода или кардиального отдела желудка;
- высокий риск кровотечения из ВРВ пищевода и/или кардиального желудка, подтвержденный при эндоскопическом исследовании;
- установленную при прямой портографии расширенную и извитую ЛЖВ и варикозно трансформированных пищеводных вен;
- массивный сброс крови из ВВ в венозную систему гастроэзофагеального бассейна и далее в непарную и полунепарную вены.
На основании проведенного ретроспективного анализа отмечено следующее. Селективная эмболизация ЛЖВ, выполняемая через созданный портосистемный канал, является эндоваскулярной процедурой, имеющей целью устранить ретроградный кровоток по венозной магистрали, соединяющей ВВ с сосудами, располагающимися в подслизистом слое нижней трети пищевода и кардиального отдела желудка. Сочетание двух этапов оперативного пособия, а именно TIPS/ТИПС и селективной эмболизации ЛЖВ, позволяет редуцировать ретроградный гепатофугальный кровоток в ВВ и сброс крови в гастроэзофагеальный бассейн, что в значительной мере снижает риск рецидива пищеводно-желудочного кровотечения даже в условиях тромбоза стента.
Тем не менее, по данным некоторых авторов, эндоваскулярная эмболизация ЛЖВ усложняет оперативное вмешательство и увеличивает время его продолжительности, что негативно может сказываться на течении основного заболевания в послеоперационном периоде [9]. Более того, с течением времени существует вероятность снижения эффективности данной манипуляции вследствие вариабельности коллатерального портального кровообращения при рецидиве ПГ [1].
Приводим результаты наблюдения по истечению 3-летнего периода. Дисфункция созданного портосистемного шунта выявлена в послеоперационном периоде у 14 больных I группы и у 12 – во II. В первой группе наблюдений рецидивы варикозных пищеводных кровотечений зарегистрированы у 12 пациентов. 360-дневная летальность составила 20 % (7 человек). Что касается второй группы больных, отметим, что в сроки от одного месяца до одного года тромбоз шунта проявился рецидивом пищеводного кровотечения у 2 пациентов (5,7 %), а на протяжении всего исследования у остальных 10 больных тромбоз шунта стал случайной находкой при плановом ультразвуковом исследовании, которому с определенной периодичностью подвергаем всех оперированных. Все 10 больных, у которых тромбоз шунта протекал без клинической манифестации пищеводных геморрагий, подверглись эмболизации ЛЖВ в дополнение к формированию TIPS/ТИПС. 360-дневная летальность в этой группе пациентов составила 11,4 % (4 человека), причем 3 из них умерло от декомпенсации основного заболевания без клинико-лабораторных признаков пищеводно-желудочного кровотечения. Трехлетняя выживаемость пациентов I группы составила 57,1 % (20 больных), во II – 68,6 % (24 пациента). Основная причина летальности больных II – декомпенсация основного заболевания с развитием тяжелых форм печеночной энцефалопатии и гепато-ренального синдрома 1 типа. Таким образом, несмотря на техническую сложность манипуляции эмболизации ЛЖВ и, как следствие, удлинение времени оперативного пособия, нам удалось снизить летальность и повысить выживаемость больных во второй группе наблюдений.
В заключение необходимо отметить следующее. Соблюдение сформулированных показаний, техническую возможность исполнения селективной эмболизации ЛЖВ позволяет надежно профилактировать пищеводно-желудочные кровотечения даже в условиях тромбированного внутрипеченочного шунта. Это позволяет не только снизить рецидив варикозных кровотечений портального генеза в отдаленном послеоперационном периоде и летальность, но и повысить выживаемость данной категории больных.
Выводы
- Операция TIPS/ТИПС – эффективный эндоваскулярный способ лечения ПГ цирротического генеза, позволяющий минимизировать развитие варикозных пищеводно-желудочных кровотечений в послеоперационном периоде.
- Наличие у пациентов в анамнезе варикозных пищеводно-желудочных кровотечений является показанием к выполнению селективной эмболизации ЛЖВ при возможности технического исполнения данной манипуляции.
- Этапное выполнение операции TIPS/ТИПС и эмболизации ЛЖВ является эффективным методом лечения и профилактики пищеводно-желудочных кровотечений портального генеза.
Рецензенты:
Черкасов М.Ф., д.м.н., профессор, главный хирург ЮФО, заведующий кафедрой хирургических болезней ФПК и ППС ГБОУ ВПО РостГМУ Минздрава России, г. Ростов-на-Дону;
Шапошников А.В., д.м.н., профессор, ФГБУ «РНИОИ» Минздрава России, главный научный сотрудник центра подготовки и переподготовки специалистов, г. Ростов-на-Дону.
Работа поступила в редакцию 18.09.2014.



