Установлено, что процессы окисления липидов биомембран тонко сбалансированы и существует множество механизмов для их поддержания и регулирования в соответствии с потребностями клетки в данный момент времени. Особую роль в этих процессах играют катионы металлов, ферменты и ингибиторы окисления. Известны многочисленные работы по тестированию активности катионов металлов, которые относятся к катализу гомогенных липидных систем [3, 9]. Эти результаты имеют ограниченное значение для описания процессов окисления, протекающих в мицеллах. Мало работ, в которых сравниваются антиоксидантные свойства соединений различных классов в безводной и водно-липидной средах, в условиях инициирования и катализа. Поскольку большинство известных моделей для тестирования антиоксидантов (АО) являются гидрофобными, представлялось актуальным подобрать гидрофильную липидную систему и проверить её эффективность на примере стандартных ингибиторов окисления: дибунола и a-токоферола. Настоящая работа является продолжением ранее начатых исследований [8].
Цель исследования – разработка кинетического метода экспресс-тестирования антиоксидантной активности различных классов органических соединений в условиях мицеллярного катализа, изучение в этой модели стандартных антиоксидантов: дибунола и α-токоферола.
Материалы и методы исследования
Окисление метиллинолеата (МЛ) изучали волюмометрическим методом поглощения кислорода в модифицированной установке типа Варбурга в присутствии (10–4–10–2 М) цетилтриметиламмоний бромида (ЦТМАБ) в качестве поверхностно-активного вещества (ПАВ), с добавками солей металлов переменной валентности (10–6–10–1 М) в пробе при t = (60 ± 0,2) °С, Wi = 6,8∙10–5 М∙с–1. Антиоксиданты добавляли в диапазоне концентраций (1∙10–8–1∙10−1) М. Соотношение липидов и воды составляло 1:3, общий объем пробы 4 мл. В качестве критериев оценки антиоксидантных свойств соединений использовали – периоды индукции (t), начальные и максимальные скорости окисления (Wнач, Wmax). Скорость инициирования определяли уравнением Wi = f[InH]/ti, где f – стехиометрический коэффициент ингибирования; [InH] – концентрация ингибитора (дибунола); ti – период индукции.
Результаты исследования и их обсуждение
Разработка кинетического метода базировалась на исследовании активности солей металлов переменной валентности: сульфата железа (II), хлорида железа (III), хлорида никеля (II), хлорида кобальта (II), хлорида меди (II) в водно-липидных субстратах. Для эмульгирования модельного субстрата использовали поверхностно-активное соединение цетилтриметиламмоний бромид.
В присутствии катализатора известны следующие реакции зарождения и продолжения цепей [2, 5], при этом наблюдается цикличность окисленной (Cu2+) и восстановленной (Cu1+) формы ионов:
RH + Cu2+ → R● + Cu1+ + H+;
ROOH + Cu1+ → RO● + OH- + Cu2+ ;
ROOH + Cu2+ → RO2● + H+ + Cu1+ .
Механизм действия катализатора при окислении липидного субстрата может быть описан по характеру кинетических кривых (КК). Из рис. 1 видно, что в сравнимых концентрациях наиболее эффективным катализатором является хлорид меди (II). Для него отмечается наибольшая скорость процесса, оцениваемая из наклона КК. При сопоставлении абсолютных значений Wмах исследуемые катализаторы располагаются в следующем порядке:
NiCl2 < FeCl3 < FeSO4 < CoCl2 < CuCl2.
Действие упомянутых выше солей было изучено в широком диапазоне концентраций для отбора среди них наиболее эффективных катализаторов. На рис. 2 приведены закономерности изменения максимальной скорости процесса от концентрации катализатора. Можно видеть, что концентрационные зависимости для всех веществ носят экстремальный характер, экстремумы проявляются в разных диапазонах. Скорости окисления липидных субстратов в присутствии хлорида никеля (II) и хлорида железа (III) выходят на максимум при 1,0∙10–3 М, далее с ростом концентрации их значение не меняется. Максимальная скорость при окислении с добавками сульфата железа (II) отмечается в диапазоне (0,1–1,0) ∙10–3 М (табл. 1). Зависимость максимальной скорости от добавок хлорида кобальта (II) имеет максимум при концентрации (9–11)∙10–3 М. Скорость окисления субстрата в присутствии хлорида меди (II) выше в 5 раз по сравнению с добавками солей других металлов и при концентрации 2∙10–3 М составляет (26,3 ± 0,3)∙10–5 М∙с–1 (табл. 1).
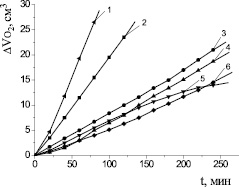
Рис. 1. Кинетика окисления метиллинолеата в водно-липидной среде в присутствии добавок солей металлов в концентрации 1∙10–3 М: 1 – CuCl2 2∙10−3 М; 2 – CuCl2; 3 – FeSO4; 4 – CoCl2; 5 – FeCl3; 6 – NiCl2; 1∙10−3 М ЦТМАБ; t = 60 °С
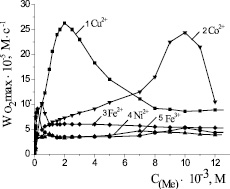
Рис. 2. Зависимость стационарных скоростей окисления метиллинолеата в присутствии солей катализаторов от их концентрации, М: 1 – CuCl2; 2 – CoCl2; 3 – FeSO4; 4 – NiCl2; 5 – FeCl3; 1∙10−3 М ЦТМАБ, t = 60 °С
Таблица 1
Кинетические параметры окисления метиллинолеата (МЛ) в присутствии металлов переменной валентности, t = 60 °С, С ЦТМАБ = 1∙10-3 М, липиды:вода - 1:3, [Kat] - концентрация катализатора
|
[Kat], М |
[Kat]/[МЛ] |
Wнач ∙10-5, М∙с-1 |
Wmax ∙10-5, М∙с-1 |
|
Хлорид железа (III) |
|||
|
1∙10-4 |
1:1000 |
2,7 |
3,7 |
|
2∙10-4 |
1:500 |
3,1 |
6,5 |
|
5∙10-4 |
1:200 |
3,0 |
3,6 |
|
7∙10-4 |
1:135 |
3,0 |
4,4 |
|
1∙10-3 |
1:100 |
2,3 |
3,2 |
|
2∙10-3 |
1:50 |
1,7 |
3,5 |
|
5∙10-3 |
1:20 |
1,7 |
3,5 |
|
1∙10-2 |
1:10 |
3,0 |
5,3 |
|
5∙10-2 |
1:2 |
2,0 |
3,9 |
|
1∙10-1 |
1:1 |
3,0 |
4,9 |
|
Сульфат железа (II) |
|||
|
1∙10-6 |
1:100000 |
3,1 |
5,1 |
|
5∙10-6 |
1:20000 |
3,4 |
5,7 |
|
1∙10-5 |
1:10000 |
7,6 |
6,6 |
|
5∙10-5 |
1:2000 |
3,8 |
7,2 |
|
1∙10-4 |
1:1000 |
8,5 |
8,3 |
|
2∙10-4 |
1:500 |
6,2 |
9,1 |
|
5∙10-4 |
1:200 |
3,8 |
4,9 |
|
1∙10-3 |
1:100 |
6,8 |
5,9 |
|
2∙10-3 |
1:50 |
6,8 |
6,1 |
|
1∙10-2 |
1:10 |
6,8 |
5,4 |
|
1∙10-1 |
1:1 |
6,8 |
5,7 |
|
Хлорид никеля (II) |
|||
|
1∙10-4 |
1:1000 |
1,3 |
3,1 |
|
2∙10-4 |
1:500 |
1,4 |
3,3 |
|
1∙10-3 |
1:100 |
3,5 |
4,1 |
|
[Kat], М |
[Kat]/[МЛ] |
Wнач ∙10-5, М∙с-1 |
Wmax ∙10-5, М∙с-1 |
|
2∙10-3 |
1:50 |
2,4 |
3,2 |
|
5∙10-3 |
1:20 |
2,3 |
3,8 |
|
1∙10-2 |
1:10 |
2,4 |
4,3 |
|
5∙10-2 |
1:2 |
2,2 |
4,6 |
|
1∙10-1 |
1:1 |
1,7 |
4,7 |
|
2∙10-1 |
1:0,5 |
3,0 |
4,4 |
|
Хлорид кобальта (II) |
|||
|
1∙10-4 |
1:1000 |
10,0 |
4,2 |
|
2∙10-4 |
1:500 |
9,1 |
4,1 |
|
5∙10-4 |
1:200 |
3,2 |
10,2 |
|
1∙10-3 |
1:100 |
11,4 |
6,8 |
|
2∙10-3 |
1:50 |
14,2 |
7,3 |
|
5∙10-3 |
1:20 |
2,3 |
10,4 |
|
1∙10-2 |
1:10 |
5,7 |
24,4 |
|
5∙10-2 |
1:2 |
14,3 |
4,5 |
|
1∙10-1 |
1:1 |
5,7 |
7,4 |
|
Хлорид меди (II) |
|||
|
1∙10-6 |
1:100000 |
3,5 |
9,6 |
|
1∙10-5 |
1:10000 |
5,7 |
4,3 |
|
1∙10-4 |
1:1000 |
3,7 |
5,7 |
|
1∙10-3 |
1:100 |
8,6 |
14,5 |
|
2∙10-3 |
1:50 |
14,4 |
26,3 |
|
5∙10-3 |
1:20 |
13,7 |
15,0 |
|
1∙10-2 |
1:10 |
12,8 |
8,6 |
|
2∙10-2 |
1:5 |
11,3 |
8,9 |
|
5∙10-2 |
1:2 |
5,7 |
15,4 |
|
1∙10-1 |
1:1 |
8,5 |
14,5 |
Ранее каталитическое действие металлов переменной валентности изучалось при окислении растительных масел, модельных липидных субстратов [9]. Был получен ряд активности катионов:
Cu2+ > Mn2+ > Fe2+ > Cr2+ > Ni2+ >> Zn2+.
Как видно из приведенных выше данных, изученные соли вписываются в указанный ряд активности металлов, а хлорид меди обладает наибольшей каталитической активностью при наименьшей концентрации 2∙10–3 М.
Следующим этапом создания модели для тестирования биоантиоксидантов был выбор концентрации ПАВ. Известно [6], что скорость окисления в гомогенных системах ниже, чем в эмульсиях, и зависит от степени ее дисперсности.
В работе [2] установлено, что соотношение констант скорости роста и обрыва цепей при инициированном окислении кумола в эмульсиях и гомогенной системе определяется 5,5:1 и равно 110 и 20 соответственно. В нашем эксперименте было установлено, что скорость окисления МЛ в водно-липидной среде в 1000 раз выше, чем в безводной среде. При выборе оптимальной добавки ЦТМАБ исследовали диапазон концентраций (10-4–10−2) М. Установлено, что с ростом концентраций ПАВ скорость процесса проходит через максимум, соответствующий концентрации 1∙10−3 М (рис. 3). Дальнейшее повышение концентрации ПАВ приводит к снижению скорости окисления. Указанную концентрацию детергента, обеспечивающую наибольшую скорость реакции, можно рекомендовать для использования в гетерогенных моделях окисления. Методом Ребиндера и рефрактометрическим методом была определена критическая концентрация мицеллообразования ЦТМАБ (1,0 ± 0,2)∙10−3 М, что соответствовало кинетическим данным. Механизм каталитического окисления углеводородов (липидов) в водно-эмульсионной среде сводится к следующему. В присутствии ЦТМАБ формируются мицеллы [4]. Добавки катионного ПАВ усиливают мицеллообразование, при этом катионы внедряются в промежутки между углеводородными «хвостами» с образованием двойного электрического слоя. С выработкой свободных радикалов высших жирных кислот катионы катализатора должны иметь доступ к гидрофобным хвостам субстрата. При низких концентрациях катионы имеют большую вероятность донорно-акцепторного взаимодействия с эфирными группами субстрата, приводящего к образованию в присутствии катализатора свободных радикалов по реакции
Me(n+1)+ + RH + O2 → Men+ + R● + HO2●
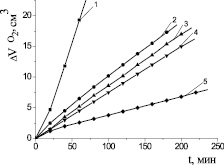
Вероятно, существуют оптимальные концентрации ЦТМАБ, при которых количество контактов катионов катализатора, сложного эфира и кислорода максимально. При увеличении концентрации ПАВ количество катионов на поверхности мицеллы возрастает, происходит их более интенсивное отталкивание, приводящее к снижению скорости зарождения цепей и скорости процесса. В соответствии с приведенной гипотезой добавки 1∙10−3 М ЦТМАБ являются оптимальными, обеспечивающими максимальный контакт катионов меди и кислорода с жирно-кислотными радикалами. Увеличение концентрации ЦТМАБ снижает количество таких контактов и скорость процесса соответственно. В результате проведенных исследований нами была предложена новая кинетическая модель для экспресс-тестирования биоантиоксидантов: модельный субстрат содержит 1 мл эфиров высших ненасыщенных жирных кислот (липиды), 1 мл водного раствора 2∙10−3 М хлорида меди (II) в конечной концентрации, 1 мл водного раствора 1∙10−3 М ЦТМАБ в конечной концентрации, соотношение липиды-вода 1:3, добавляют 1 мл воды или раствора исследуемого антиоксиданта (или точную навеску антиоксиданта), общий объем пробы 4 мл, смесь перемешивают на магнитной мешалке, помещают в термостатируемую при t = (60 ± 0,2) °С ячейку (схема манометрической установки приведена в работе [7]). Пробу насыщают кислородом, соединяют с волюмометрической системой, измеряют объем поглощенного кислорода во времени без добавок биоантиоксидантов и в присутствии их в различных концентрациях. При известных скоростях инициирования и оптимальных концентрациях ингибитора рассчитывают антирадикальную активность по величине параметра fK7, по периоду индукции (t) определяют суммарную антиоксидантную активность. Сравнение начальных и максимальных скоростей и характера КК позволяет оценить механизм действия антиоксидантов.
Для доказательства свободнорадикального механизма каталитического окисления липидного субстрата использован метод ингибиторов. Проведено исследование закономерностей окисления модельного субстрата в присутствии добавок стационарных ингибиторов окисления дибунола и a-токоферола. По результатам эксперимента рассчитаны кинетические параметры окисления субстратов. В нашем исследовании показан идентичный характер кинетических кривых окисления метиллинолеата в растворе хлорбензола в присутствии 6∙10−3 М инициатора 2,2′-азобисизобутиронитрила и водно-липидной системе в присутствии 2∙10−3 М хлорида меди при равных концентрациях дибунола (рис. 4). Показано, что в водно-липидной среде дибунол проявляет себя как сильный ингибитор: наблюдается период полного торможения, период аутоускорения и достижения максимальной скорости окисления. Периоды индукции увеличиваются пропорционально увеличению концентрации дибунола (табл. 2). Наличие торможения в присутствии добавок дибунола является признаком радикально-цепного механизма процесса, а отсутствие комплексообразующей способности с катионами меди происходит благодаря экранированию двумя трет-бутильными заместителями гидроксильной группы в его структуре. По наклону прямой в координатах t [InH] была рассчитана скорость инициирования в обеих системах, получены значения 6,2∙10–8 и 6,8∙10–5 М∙с–1 в безводной и водно-липидной среде соответственно. Максимальные скорости окисления метиллинолеата при t = (60 ± 0,2) °С, равные 2,6∙10–7 М∙с–1 и 2,6∙10–4 М∙с–1 в безводной и водно-липидной среде соответственно, различаются в 1000 раз.
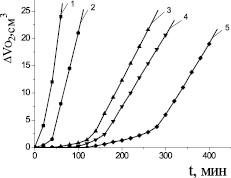
Таблица 2
Кинетические параметры окисления метиллинолеата в водно-липидной среде в присутствии 2∙10-3 М CuCl2 в зависимости от концентрации a-токоферола и дибунола, t = 60 °С, [InH] - концентрация ингибитора
|
[InH], М |
t, мин |
Wнач∙10-5, М∙с-1 |
Wmax∙10-4, М∙с-1 |
|
Контроль МЛ |
5 |
14,4 |
2,6 |
|
a-токоферол |
|||
|
1∙10-8 |
10 |
14,0 |
2,1 |
|
1∙10-7 |
15 |
11,0 |
2,1 |
|
1∙10-6 |
20 |
9,7 |
1,9 |
|
1∙10-5 |
25 |
6,8 |
1,8 |
|
1∙10-4 |
35 |
5,2 |
1,4 |
|
1∙10-3 |
15 |
14,6 |
3,2 |
|
1∙10-2 |
6 |
15,7 |
3,4 |
|
1∙10-1 |
5 |
16,8 |
5,7 |
|
дибунол |
|||
|
1∙10-6 |
30 |
13,8 |
2,5 |
|
1∙10-5 |
40 |
12,7 |
2,3 |
|
2∙10-5 |
75 |
9,8 |
2,1 |
|
5∙10-5 |
130 |
5,0 |
1,9 |
|
1∙10-4 |
160 |
4,1 |
1,8 |
|
2∙10-4 |
180 |
3,8 |
1,7 |
|
5∙10-4 |
270 |
3,1 |
1,6 |
|
8∙10-4 |
430 |
2,3 |
1,6 |
|
1∙10-3 |
590 |
1,9 |
1,5 |
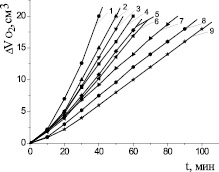
Известно, что a-токоферол характеризуется высокой константой скорости реакции с пероксильными радикалами K7 = (3,3 – 3,5)∙106 М–1∙с–1, что на два порядка превышает аналогичные константы скорости для дибунола K7 = 2,6∙104 М–1∙с–1 [1]. Известен сложный механизм действия a-токоферола в безводных углеводородных и липидных субстратах, его участие не только в реакциях обрыва цепей, но и реакциях продолжения цепей и распаде гидропероксидов. Последние реакции приводят к снижению антиоксидантной активности a-токоферола.
На рис. 5 показано, что a-токоферол в водно-липидной среде проявлял слабые антиоксидантные свойства, в концентрациях свыше 1∙10−3 М промотировал процесс окисления липидных субстратов, при концентрации (1∙10–8–1∙10–6) М a-токоферол незначительно уменьшал максимальную скорость, без заметного влияния на начальные стадии окисления. В присутствии 1∙10–5 и 1∙10–4 М a-токоферола наблюдалось замедление начальных стадий окисления и уменьшение максимальной скорости (табл. 2). В процессе окисления a-токоферол образует достаточно активные токофероксильные радикалы (In●), способные участвовать в побочных реакциях продолжения цепей с молекулами субстрата (RH) [1]:
In● + RH → R● + InH.
Не исключается возможность a-токоферола образовывать комплексные соединения с катионами меди (II), которые приводят к снижению его антиоксидантных свойств.
Выводы
1. Разработана кинетическая модель экспресс-тестирования биоантиоксидантов в водно-липидной каталитической среде, выбраны оптимальные концентрации катализатора и поверхностно-активного вещества.
2. Получен ряд каталитической активности солей металлов переменной валентности при концентрации 2∙10−3 М:
Cu2+ > Co2+ > Fe2+ > Fe3+ > Ni2+.
3. Показан идентичный механизм действия стационарного антиоксиданта дибунола при окислении безводных и водно-липидных субстратов в условиях инициирования и катализа.
4. Установлена слабая антиоксидантная активность a-токоферола при каталитическом окислении водно-липидных субстратов.
Разработанный способ тестирования биоантиоксидантов волюмометрическим методом с использованием каталитического окисления водно-липидных (эмульсионных) субстратов был внедрен в НИИ клинической и профилактической кардиологии СО РАМН.
Рецензенты:
Ерёмин Д.И., д.б.н., профессор кафедры почвоведения и агрохимии, ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень;
Грехова И.В., д.б.н., профессор кафедры общей химии, ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень.
Работа поступила в редакцию 14.12.2014.



