В научной литературе описано множество экспериментальных моделей нарушений в системе «мать ‒ плацента ‒ плод», имеющих своей целью воспроизведение на животных плацентарной недостаточности (ПН), хронической внутриутробной гипоксии (ХВГ) и синдрома задержки развития плода (СЗРП). В качестве повреждающего плаценту фактора предложены хроническая анемия за счет ежедневных кровопусканий или гемолизирующего эффекта сапонин-колларгола, гипобарическая гипоксия, модель теплового стресса, чрезмерные физические нагрузки, солевая диета, исключение из пищевого рациона аминокислот, жирных кислот и железа, умбиликоплацентарная эмболизация и другие оперативные вмешательства, направленные на нарушение маточно-плацентарного кровотока [2, 4, 5, 7, 8, 10].
Назначение этих моделей заключается не только в проверке гипотез ФПН и возможности изучения особенностей патогенеза ФПН, ХВГ и СЗРП, но и в их использовании на этапе доклинических испытаний для оценки эффективности новых лекарственных средств, разрабатываемых для коррекции вышеуказанной патологии [5].
Экспериментальных моделей, использующих в качестве повреждающего плаценту фактора аутоантитела к плацентарным антигенам, в литературе не описано, несмотря на существующие гипотезы участия аутоиммунных механизмов в формировании фетоплацентарной недостаточности (ФПН) [6].
Цель исследования. Путем предварительной до беременности иммунизации самок крыс плацентарными белками человека и крысы добиться аутоиммунной реакции к собственной плаценте в период беременности крысы и получить экспериментальную модель аутоиммунной плацентарной недостаточности (ПН) и сопутствующего ей синдрома задержки развития плода (СЗРП).
Материалы и методы исследования
В экспериментах использовали 46 самок белых крыс линии Wistar и 10 белых беспородных крыс, с 4-недельного до 3–5-месячного возраста, любезно предоставленных к.м.н., старшим научным сотрудником Давыдовым А.Г. из вивария ФГБУЗ «НИИ по изучению лепры». Для спаривания из этого же вивария временно отбирались 5–6-месячные самцы крыс Wistar. Масса самок крыс перед оплодотворением колебалась от 190 до 250 граммов. Для каждой серии экспериментов группы крыс включали по 5–10 животных.
В период экспериментальных исследований животных содержали в соответствии с «Международными рекомендациями по проведению медико-биологических исследований с использованием лабораторных животных», принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных целей (Страсбург, 1986) и приказа МЗ РФ № 267 от 19.06.2003 «Об утверждении правил лабораторной практики» [5].
Для исключения реакции на новизну обстановки самок перед началом эксперимента выдерживали 10 дней в стационарных условиях вивария. Питание и питье животные получали ad libidum. Крыс содержали в виварии с естественным освещением при температуре 20–22 °С в клетках площадью 0,6 кв.м, не более 4 самок в каждой клетке. Для серологических исследований взятие крови у самок крыс осуществляли из хвостовой вены [5]. Иммунизацию крыс плацентарными белками проводили по классической схеме с полным и неполным адьювантом Фрейнда (ПАФ и НПАФ).
Ранее не рожавшие самки крыс после иммунизации плацентарными белками подвергались процедуре оплодотворения. Определялась фаза эстрального цикла, и самок в период диэструса подсаживали к самцу из расчета 4 самки на самца. Продолжительность периода спаривания не превышала 2-х недель. Отсчет сроков беременности вели с момента обнаружения сперматозоидов в вагинальных мазках [1]. Внешние признаки беременности определялись с конца второй недели. У самок увеличивалась окружность живота, наблюдался усиленный рельеф сосков и поведенческие особенности.
На 21 день беременности, за день до предполагаемых родов, проводили эвтаназию животных с помощью этаминал-натрия в дозе 60 мг/кг, осуществляли аутопсию самок и определяли число плодов и наличие пороков развития [1]. Для обнаружения внешних видимых аномалий развития все плоды обследовали под бинокулярным микроскопом типа МБС [5]. Взвешивание последов и эмбрионов проводили при помощи весов ВЛТ-150. Всего гравиметрические и морфологические исследования проведены на 309 плодах крыс и таком же количестве последов.
Для определения в крови крыс антител к плацентарной щелочной фосфатазе (ПЩФ) применяли тест-системы, полученные самостоятельно [3]. Идентификацию антител и определение титра антител к белкам плаценты человека трофобластическому бета-глобулину (ТБГ), плацентарному лактогену (ПЛ), хорионическому гонадотропину (ХГ) и плацентарному ферритину (Фрт) проводили с помощью иммунохимических наборов из банка тест-систем кафедры биохимии Астраханского ГМУ.
Полученные результаты подвергались статистической обработке с вычислением средних величин и их ошибок (М ± m), достоверными считались различия при р < 0,05.
Результаты исследования и их обсуждение
В предварительной серии экспериментов на 10 беспородных белых крысах, длительно иммунизированных экстрактом плаценты человека, нами оценивались титры антител к важнейшим плацентарным белкам человека – ХГ, ТБГ, ПЛ, ферритину и ПЩФ. Установлено, что через полтора месяца после иммунизации небеременных самок крыс экстрактом плаценты с ПАФ титры ПЩФ и Фрт были почти на порядок выше, чем титры сывороточных белков беременности – ХГ, ТБГ, ПЛ (рис. 1).
Поэтому для разработки аутоиммунной модели ФПН нами сделан выбор в пользу самого иммуногенного белка плаценты – ПЩФ. Кроме того, выбор в качестве иммуногена органоспецифического белка плаценты ПЩФ человека, а не водорастворимых белков, секретируемых плацентой (ТБГ, ХГ, ПЛ), был связан с его большей чужеродностью для крыс. Во-первых, ПЩФ человека, в отличие от ТБГ, ХГ, ПЛ не имеет полного крысиного аналога, и, во-вторых, это тканевой, а не секретируемый в кровь белок.
С целью получения гипериммунного ответа 36 небеременных и нерожавших самок белых крыс, начиная с месячного возраста, иммунизировали очищенным ферментом ПЩФ человека в дозе 10 мг/кг массы тела еженедельно (0,4 % раствор ПЩФ в 0,4–0,5 мл) с ПАФ и НПАФ по классической схеме, двукратную реиммунизацию проводили с интервалом 1 месяц. В конце второго цикла реиммунизации в крови у всех крыс определяли титр антител к ПЩФ человека методом встречного иммуноэлектрофореза (табл. 1). Суммарная доза ПЩФ на циклы иммунизации-реиммунизации составляла 8–10 мг белка на крысу. Высокие титры антител к ПЩФ человека (1:32–1:64) перед спариванием выявлены у 21 из 36 сенсибилизированных крыс, средние титры (1:8–1:16) – у 8 животных и у остальных 7 животных обнаружены низкие титры АТ к ПЩФ человека (1:2–1:4). Животных, не отреагировавших на иммунизацию ксеногенным ПЩФ индукцией антителогенеза, в данной экспериментальной группе не было (табл. 1).
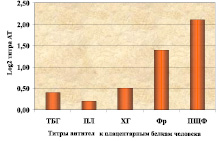
Рис. 1. Титры антител к плацентарным белкам человека в крови самок белых крыс через 1,5 месяца иммунизации экстрактом плаценты
Таблица 1
Число (n) иммунизированных до беременности самок крыс с высоким, средним и низким титрами антител к ПЩФ человека и крысы
|
Препарат для иммунизации |
АТ abs |
1:1–1:4 |
1:8–1:16 |
1:32–1:64 |
|
ПЩФ человека (n = 24) |
– |
3 |
4 |
17 |
|
ПЩФ крысы (n = 5) |
5 |
– |
– |
– |
|
Экстракт плаценты крыс (n = 7) |
6 |
1 |
– |
– |
|
Всего животных (n = 36) |
11 |
4 |
4 |
17 |
Попытки получить по той же схеме аутоантитела к аллогенной крысиной ПЩФ у небеременных самок крыс иммунизацией очищенным ферментом ПЩФ крысы или цельным экстрактом крысиной плаценты (табл. 1) не привели к выраженной аутосенсибилизации крыс – антитела к ЩФ крысиной плаценты методом ВИЭФ не выявлены ни у одной из 5 крыс, иммунизированных крысиной ЩФ, и отсутствовали у 5 из 6 крыс, иммунизированных пулом крысиных плацентарных белков. Только у одного животного, иммунизированного ЭКП, обнаруживались ААТ к ПЩФ крысы в низком титре – 1:1 (цельная сыворотка крови без разведения). Все крысы со слабым иммунным ответом на плацентарные белки также подвергались спариванию и входили в дополнительные группы контроля.
По мере оплодотворения беременные самки включались в одну из контрольных или основных экспериментальных групп. Группами контроля (табл. 2) служили 10 интактных крыс, не подвергавшихся иммунизации, и соответственно с физиологической беременностью (группа «ФБ»), а также объединенная группа, состоящая из 5 беременных крыс, безрезультатно иммунизированных ПЩФ крысы, и 7 крыс, иммунизированных крысиным плацентарным экстрактом (группа «АТ–»). Остальные 24 беременные крысы были последовательно по мере наступления беременности разделены на четыре экспериментальных группы: одну группу из 7 беременных крыс, иммунизированных ПЩФ человека и имевших перед оплодотворением низкий и средний титр АТ к ПЩФ (группа «АТ+»), и 17 крыс с высоким титром АТ к ПЩФ (группа «АТ+++»). Из 17 крыс группы «АТ+++» было сформировано 3 подгруппы, из которых две подгруппы (11 животных) в период беременности получали дополнительное корригирующее воздействие и в данной работе не описываются. Данные по 6 интактным крысам крыс группы «АТ+++» представлены в табл. 2.
Ни у одной из крыс во всех экспериментальных группах беременность самопроизвольно не прерывалась и донашивалась до 21 дня.
Средний двоичный логарифм титра в группе «АТ+» составил 2,7 ± 0,42, а в группе «АТ+++» 5,5 ± 0,12. Различия в логарифмах титров антител к ПЩФ между группами крыс «АТ+» и «АТ+++» высоко достоверны (p < 0,001).
Объектом нашего исследования, являлись плоды крыс в конце периода беременности, масса которых характеризует СЗРП, и их плаценты, масса которых отражает степень ПН. Во избежании самопоедания последов самкой крыс всем крысам из групп контроля и опыта на 21 день беременности проводилась эвтаназия.
После эвтаназии подсчитывали число крысят, у извлеченных плодов определяли основной параметр физического развития – массу тела (табл. 2). При визуальном исследовании последов оценивали степень кровенаполнения, изменения формы, цвета, консистенции. Длины новорожденных крысят и индексы массы тела (ИМТ) крысят в табл. 2 не приведены, так как эти показатели статистически менее информативны массы крысят. То, что ИМТ при ЗРП менее информативен, чем масса плодов, подтверждается литературными данными [9].
Таблица 2
Гравиметрические признаки ФПН (M ± m) в конце срока беременности у крыс с различным титром антител к ПЩФ
|
Группа, число животных, число плодов и последов |
Среднее число плодов |
Масса плодов (мг) |
Масса плаценты (мг) |
|
«ФБ» (n = 10, 72) |
7,2 ± 0,36 |
4030 ± 63,1 |
525,9 ± 5,29 |
|
«АТ–» (n = 12, 81) |
6,8 ± 0,35 |
4107 ± 80,1** |
522,8 ± 5,04** |
|
«АТ+» (n = 7, 46) |
6,6 ± 0,37 |
3976 ± 116,1** |
509,1 ± 8,10 |
|
«АТ+++» (n = 6, 39) |
6,5 ± 0,43 |
3625 ± 100,8* |
496,9 ± 9,17* |
Примечания:
* – р < 0,001 статистически значимые различия по сравнению с интактной группой крыс (ФБ);
** – р < 0,01 статистически значимые различия по сравнению с группой «АТ+++» с высоким титром антител к ПЩФ до беременности.
От 10 самок контрольной группы «ФБ» (табл. 2, рис. 2) было получено 72 плода со средней массой 4030 ± 68,3 мг. Средняя масса 72 последов крыс этой контрольной группы составила 525,9 ± 5,29 мг. Среднее число плодов и последов на интактную самку составило 7,2 ± 0,36, что выше, чем во всех остальных группах, однако статистически незначимо (табл. 2).
От 12 беременных крыс объединенной группы «АТ–», иммунизированных крысиными плацентарными белками (табл. 2, рис. 2), был получен 81 плод при среднем числе плодов и последов в помете 6,8 ± 0,35 на одну самку. Средняя масса новорожденных крысят составила 4107 ± 80,1 мг, что на 2 % выше, чем у плодов интактных крыс, и статистически достоверно не отличалась от средней массы крысят в группе интактных беременных крыс. Средняя масса 81 последа крысят этой группы не отличалось от контрольной группы и составила 522,8 ± 5,04 мг.
От 7 самок контрольной группы «АТ+», с низким титром антител к ПЩФ (табл. 2, рис. 2) было получено 46 плодов со средней массой 3976 ± 80,1 мг, то есть почти со значениями массы контрольных крысят. Средняя масса 46 последов крыс была на 3 % ниже массы плацент в контрольной группы и составила 530,33 ± 5,88 мг. Различие между группами статистически недостоверно (табл. 2).
От 6 самок группы «АТ+++», с высоким титром антител к ПЩФ (табл. 2, рис. 2) было получено 39 плодов со средней массой 3625 ± 100,8 мг, что статистически достоверно на 10 % ниже, чем в контрольной группе «ФБ» (р < 0,001), на 12 % ниже, чем в контрольной группе «АТ–» (р < 0,001), и на 9 % ниже, чем в группе «АТ+» (р < 0,01). Полученные результаты свидетельствуют об отрицательном влиянии на эмбрион эффективной иммунизации самок крыс ПЩФ человека с развитием гипотрофии плода и СЗРП у беременных крыс этой группы.
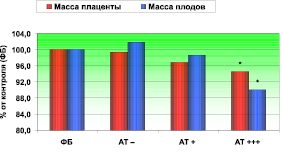
Рис. 2. Масса плодов и последов (в % к контролю) от беременных крыс, иммунизированных плацентарными белками крысы и человека
Средняя масса 39 последов крыс группы «АТ+++» составила 496,9 ± 9,17 мг, что статистически достоверно на 6 % ниже, чем в контрольной группе «ФБ» (р < 0,01), на 5 % ниже, чем в контрольной группе «АТ–» (р < 0,01), и статистически недостоверно на 2 % ниже, чем в контрольной группе «АТ+». Это свидетельствует о признаках ПН у беременных крыс группы «АТ+++».
Таким образом, в процессе проведенных экспериментов на крысах установлено, что длительная иммунизация чужеродным плацентарным белком ПЩФ человека, индуцирует у самок крыс до беременности гиперпродукцию антител к ПЩФ, а в период беременности крыс оказывает угнетающее действие как на плод, так и на плаценту крыс с развитием аутоиммунной фетоплацентарной недостаточности. То есть преиммунизацией самок крыс препаратом ксеногенной ПЩФ мы добились срыва иммунологической толерантности к антигенам собственной плаценты крыс и получили новую аутоиммунную модель ФПН.
Показателем качества моделирования аутоиммунной ФПН на крысах является статистически достоверная задержка внутриутробного развития плодов с уменьшением массы плодов на 10 % и плацентарная недостаточность с уменьшением массы последов на 6 % по сравнению с параметрами при физиологическом течении беременности. Предлагаемая простая модель ФПН на крысах открывает новые перспективы в экспериментальном акушерстве.
Выводы
1. Установлено, что длительная иммунизация небеременных самок крыс очищенным чужеродным белком ПЩФ человека с адьювантом в дозе 10 мг/кг приводит к гиперпродукции антител к ПЩФ, которые в период беременности крыс оказывают депрессивное действие как на плод, так и на плаценту.
2. Следствием моделирования аутоиммунной фетоплацентарной недостаточности на крысах является статистически достоверная задержка внутриутробного развития плодов с уменьшением массы плодов на 10 % и плацентарная недостаточность с уменьшением массы последов на 6 % по сравнению с параметрами при физиологическом течении беременности.
3. Предлагаемая аутоиммунная модель ФПН на крысах может быть использована в экспериментальном акушерстве при оценке эффективности новых лекарственных средств, разрабатываемых для коррекции ПН и СЗРП.
Рецензенты:
Мамиев О.Б., д.м.н., профессор кафедры акушерства и гинекологии лечебного факультета, Астраханский государственный медицинский университет, г. Астрахань;
Тризно Н.Н., д.м.н., профессор, заведующий кафедрой патологической физиологии, Астраханский государственный медицинский университет, г. Астрахань.
Работа поступила в редакцию 29.12.2014.



