Известно множество продуцентов бактериальной целлюлозы (БЦ): Agrobacterium, Achromobacter, Aerobacter, Enterobacter, Sarcina, Rhizobium, Pseudomonas, Salmonella, Alcaligenes – при этом в промышленности чаще всего используется Gluconoacetobacter [7]. Поиск новых продуцентов и оптимизация технологического процесса получения БЦ являются основопологающими для успешного синтеза БЦ.
Эффективность любого биотехнологического процесса может быть оценена по конверсии субстрата: необходимо выбрать оптимальную начальную концентрацию субстрата и подобрать такие условия, чтобы конверсия субстрата была полной, а выход целевого продукта максимальным. Для каждого продуцента и конкретного штамма необходимо уточнять технологические параметры, нельзя перенести оптимальные условия, выявленные для одного штамма на другой; имеющиеся в литературе расхождения по рекомендуемым начальным концентрациям субстрата объясняются биосинтетическими особенностями продуцентов.
Например, группой авторов была изучена зависимость выхода БЦ, синтезируемой Acetobacter xylinum IFO 13693 от различных концентраций глюкозы: 6, 12, 24 и 48 г/л. Было установлено, что выход БЦ уменьшается с увеличением начальной концентрации глюкозы в питательной среде, что объясняется увеличением концентрации глюконовой кислоты в процессе культивирования. Таким образом, при высоких концентрациях глюкоза не используется для синтеза целлюлозы, а метаболизируется в глюконовую кислоту. Авторы приходят к выводу, что высокая концентрация глюкозы в среде снижает выход БЦ, низкая концентрация глюкозы предпочтительнее для культивирования [8].
Другие авторы [6] также исследовали проблему зависимости выхода БЦ от концентрации глюкозы. Использовался продуцент Acetobacter sp. V6. По их данным, максимальный выход БЦ достигается при концентрации глюкозы 1 %, минимальный выход – при концентрациях 2 и 3 %. Использование в данной работе многовидовой культуры бактерий рода Acetobacter, а не отдельного штамма, объясняется стремлением использовать в производстве устойчивой к фаговым инфекциям и изменениям состава среды культуры. Естественные симбиотические культуры ещё более устойчивы к неблагоприятным условиям и контаминации фагами и посторонней микрофлорой.
В институте теоретической и экспериментальной биофизики РАН (г. Пущино, 1999–2003 гг.) были проведены фундаментальные исследования физиологии и метаболизма Мedusomyces gisevii J. Lindau [5], показаны его уникальная способность к адаптации в неблагоприятных условиях (тяжелая вода [3], холодовой стресс [5]). Авторы подробно рассматривают микробиологический состав симбиоза, взаимовлияние партнёров на метаболические пути трансформации субстратов, идентифицируют метаболиты. Решающим условием для нормального роста и накопления активных веществ Мedusomyces gisevii J. Lindau авторы считают интенсивность образования гель-плёнки БЦ. Однако авторы не ставили целью поиск оптимальных условий для биосинтеза БЦ, а рассматривали всю совокупность биохимической трансформации глюкозы в этанол, уксусную кислоту, глюконовую кислоту и глицерин [5].
Целью работы являлось выявление зависимости биосинтеза БЦ с помощью симбиотической культуры Мedusomyces gisevii J. Lindau от концентрации исходного субстрата – глюкозы. Результаты, полученные на модельных синтетических средах, будут использованы для биосинтеза БЦ на средах ферментативных гидролизатов целлюлозосодержащего сырья, технология получения которых достаточно детально изучена в ИПХЭТ СО РАН [4].
Материалы и методы исследования
Мedusomyces gisevii J. Lindau, в быту известен как «чайный гриб», – это симбиотическая культура, в состав которой входят 8–10 родов уксусно-кислых, таких как Acetobacter sp., Acetobacter aceti, Acetobacter aceti subspecies xylinum, Acetobacter xylinodies и др., 15–30 родов дрожжей Zygosaccharomeces sp., Schizosaccharomyces pombe, Candida tropicalis и др. Медузомицет представляет собой толстую, слоистую, желтовато-коричневого цвета пленку, плавающую на поверхности культуральной жидкости. Часть клеток микроорганизмов иммобилизованы на поверхности гель-плёнки целлюлозы, часть находится в культуральной жидкости [5].
В экспериментах использовались синтетические питательные среды, приготовленные растворением глюкозы в экстракте черного чая (12 г чая на 1 л воды), с разными начальными концентрациями глюкозы 5, 10, 15, 25, 35, 45, 55 г/л. В качестве инокулята использовалась семидневная симбиотическая культура, выращенная на глюкозной среде, доза внесения составляла 10 %. Культивирование проводилось в статических условиях при (32 ± 2) °С в течение 21 суток. Убыль глюкозы контролировалась спектрофотометрически (спектрофотометр «UNICOUV-2804», США) с использованием динитросалицилового реактива, прирост пленки БЦ оценивался гравиметрически (весы лабораторные аналитические Explorer EX-224), уровень активной кислотности контролировался с помощью иономера (иономер И-160 МИ).
Результаты исследования и их обсуждение
На рис. 1 представлена зависимость доли утилизированной глюкозы от продолжительности культивирования при различных начальных концентрациях.
При начальной концентрации 5, 10, 15 и 20 г/л доля неутилизированного субстрата на 7 сутки культивирования составила менее 10 %; при исходной концентрации 25 г/л – на 9 сутки; при исходной концентрации 35 г/л – на 13 сутки. При 45 и 55 г/л скорость утилизации глюкозы становится ещё меньше и остаются неутилизированными 18 и 23 % субстрата соответственно.
Для обоснования выбора начальной концентрации глюкозы была рассчитана скорость её утилизации, согласно уравнению [1]:
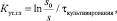
где Кут.гл – константа скорости утилизации субстрата, сутки–1; τкультифирования – фиксируемый период времени от начала культивирования, сутки; s0 и s – концентрации РВ в начале культивирования и во время τкультивирования.
Зависимость скорости утилизации от начальной концентрации глюкозы представлена на рис. 2. Данная зависимость отражает ингибирование скорости утилизации субстрата его высокими начальными концентрациями. Максимальная скорость утилизации субстрата наблюдается при начальной концентрации глюкозы 15 г/л и составляет 0,784 ч–1, а концентрация 25 г/л и выше приводит к снижению скорости утилизации глюкозы в 2,6 раза по сравнению с максимальной. Дальнейшее повышение концентрации субстрата приводит к ещё большему снижению скорости его утилизации.
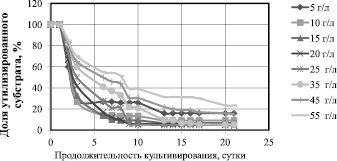
Рис. 1. Зависимость доли утилизированного субстрата от продолжительности культивирования
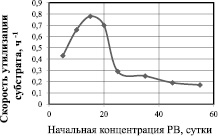
Рис. 2. Зависимость скорости утилизации глюкозы от начальной концентрации (скорость определена на 7 сутки культивирования)
Можно предположить, что высокие концентрации глюкозы ингибируют биосинтез гель-плёнки симбиотической культурой Мedusomyces gisevii J. Lindau. Известно, что высокие концентрации глюкозы приводят к активации синтеза побочного продукта – глюконовой кислоты (через 2, 5 – кетоглюконат) для Gluconoacetobacter xylinum [9]. Для симбиотической культуры Мedusomyces gisevii J. Lindau побочным продуктом может быть не только глюконовая кислота, но и этанол, уксусная кислота, глицерин и ряд других соединений (янтарная, молочная, яблочная кислоты), поскольку это многовидовая многоштаммовая культура. Изменения активной кислотности, представленные на рис. 3, косвенно свидетельствуют о накоплении вторичных метаболитов.
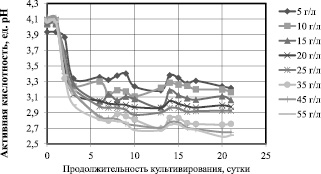
Рис. 3. Изменения активной кислотности сред при культивировании Мedusomyces gisevii J.Lindau
Кинетика утилизации глюкозы и выход БЦ для продуцента Мedusomyces gisevii J. Lindau
|
Начальная концентрация глюкозы, г/л |
5 |
10 |
15 |
20 |
25 |
35 |
45 |
55 |
|
Конечная концентрация глюкозы через 21 сутки, г/л |
0,80 |
0,91 |
1,00 |
0,90 |
1,20 |
1,83 |
6,73 |
12,82 |
|
Скорость утилизации субстрата через 7 суток культивирования, сутки–1 |
0,43 |
0,66 |
0,78 |
0,70 |
0,29 |
0,25 |
0,19 |
0,17 |
|
Выход БЦ на 7 сутки культивирования, % |
4,84 |
4,90 |
7,04 |
8,40 |
8,25 |
6,52 |
4,32 |
4,44 |
|
Выход БЦ на 21 сутки культивирования, % |
6,50 |
5,30 |
7,00 |
8,40 |
8,00 |
8,20 |
6,20 |
5,50 |
Если для начальной концентрации 5 и 10 г/л к концу культивирования рН составляет 3,2, то для 45 и 55 г/л эта величина снижается до 2,65 рН. Предположительно, что при высоких концентрациях глюкозы в среде для синтеза БЦ расходуется не весь субстрат, поэтому излишек глюкозы идет на синтез побочного продукта такого, как глюконовая кислота. Глюконовая кислота снижает уровень рН питательной среды.
Иногда выведение из системы продуктов метаболизма или их связывание приводят к повышению скоростей утилизации субстрата и накопления продукта [1]. Решением представляется поддержание рН на заданном оптимальном уровне. Однако для Мedusomyces gisevii J. Lindau в отношении синтеза БЦ этот приём проводить нецелесообразно. Ранее нами была исследована зависимость скорости утилизации глюкозы от активной кислотности среды в диапазоне от 3 до 6 и показано, что в условиях искусственного поддержания рН выше 3,0 (с помощью раствора гидроксида аммония) скорость утилизации глюкозы значительно снижалась. Симбиотическая культура саморегулировала уровень рН среды и образование гель-пленки БЦ при отсутствии внешних вмешательств, в этом случае рН естественным образом снижалась в процессе культивирования от 4 до 3 [2].
В таблице и на рис. 2 приведены выходы очищенной БЦ, зарегистрированные через 7 сут культивирования (расчёт на сухое вещество). Наиболее высокий выход зафиксирован при начальной концентрации глюкозы 20 и 25 г/л – 8,4 и 8,3 % соответственно. Сопоставляя данные по скорости утилизации субстрата и выходу БЦ, можно сделать вывод, что целесообразной является начальная концентрация глюкозы 20 г/л, при этом наблюдается максимальная скорость утилизации субстрата и максимальный выход БЦ – 8,4 % уже через 7 суток культивирования. Повышение концентрации глюкозы в среде приводит к снижению выхода БЦ.
Сравнивая выход БЦ через 7 суток и через 21 сутки культивирования, можно сделать вывод, что увеличение продолжительности культивирования Мedusomyces gisevii J. Lindau на питательных средах не приводит к существенному повышению выхода БЦ.
Визуальная оценка гель-пленок БЦ на 7 и 21 сутки показывает, что длительное культивирование оказывает негативное влияние на качество пленок: структура гель-плёнок становится неоднородной, на поверхности наблюдаются дефекты (бугристость, слоистость), снижается эластичность.
Выводы
Выявлена зависимость биосинтеза БЦ с помощью симбиотической культуры Мedusomyces gisevii J. Lindau от концентрации исходного субстрата – глюкозы. Экспериментально определены скорости утилизации глюкозы и выходы бактериальной целлюлозы в интервале начальной концентрации глюкозы от 5 до 55 г/л. Показано, что скорость утилизации глюкозы ингибируется её высокими концентрациями: при концентрации глюкозы выше 15 г/л скорость утилизации снижается, а при концентрации выше 45 г/л – 18 % субстрата и более остаётся неутилизированным. Установлено, что повышение концентрации глюкозы выше 20 г/л приводит к снижению выхода бактериальной целлюлозы. Показано, что при начальной концентрации глюкозы 20 г/л скорость утилизации субстрата составляет 0,70 ч–1, субстрат расходуется целевым образом на синтез гель-плёнки, а выход бактериальной целлюлозы максимален и составляет 8,4 %.
Рецензенты:
Новожилов Е.В., д.т.н., профессор, заведующий кафедрой биотехнологии и биотехнических систем, Северный (Арктический) федеральный университет, г. Архангельск;
Сечин А.И., д.т.н., профессор, Томский политехнический университет, г. Томск.
Работа поступила в редакцию 28.01.2015.



