Биологическое поведение злокачественной опухоли, которое характеризует скорость ее роста, способность к инвазии и распространению, а, в конечном итоге, и прогноз заболевания, зависит от многих причин, связанных как с ее особенностями, так и с эффективностью или неэффективностью системных защитных механизмов, среди которых важное место занимают иммунные. По-видимому, свойства опухоли и реакции иммунной системы организма на нее тесно взаимосвязаны. С учетом значения иммунокомпетентных клеток в процессах апоптоза, пролиферации, неоангиогенеза (в частности, через продукцию цитокинов), их роль в микроокружении опухоли представляется существенной, однако, не полностью проясненной. Иммунная защита организма от опухоли осуществляется не только на системном, но и на локальном уровне. Участие в ней различных клеточных факторов, главным образом, Т- и NК-клеток, а также их растворимых продуктов, в настоящее время не подлежит сомнению [4, 6, 7]. Однако, хотя присутствие иммунокомпетентных клеток и гуморальных факторов в микроокружении опухоли давно описано, их роль в очаге расценивается двояко, т.е. они рассматриваются как факторы, не только способствующие ее регрессии, но и могущие стимулировать ее рост, тем более, при распространенных стадиях [1, 8, 9].
Оценка факторов локального иммунитета у онкологических больных, в частности, при раке слизистой полости рта и языка, представляет собой важную проблему, могущую иметь теоретические и прикладные аспекты.
Цель исследования
Провести сравнительную оценку факторов клеточного и гуморального иммунитета в тканевых образцах опухоли и ее перитуморальной зоны у больных раком слизистой полости рта и языка без метастазов, с регионарными метастазами и с рецидивами.
Материалы и методы исследования
Объектом исследования были 69 больных раком слизистой полости рта и языка (55 мужчин, 14 женщин; возраст 40–77 лет), которые были разделены на 3 группы по 23 человека: 1-я группа больных без регионарных метастазов и рецидивов, 2-я – с наличием метастазов, 3-я – с рецидивами. Больные проходили лечение в отделении опухолей головы и шеи ФГБУ «РНИОИ» МЗ РФ в 2006–2014 гг. Распространенность процесса у больных первых двух групп составила: со II стадией (T2N0M0) было 10 человек, с III – 25 (T2N1M0 – 4, T3N0M0 – 13, T3N1M0 – 8), с IV – 11 (T3N2M0 – 2, T4N0M0 –5, T4N1M0 – 4). У 57 (82,6 %) больных опухолевым процессом был поражен язык, у 12 (17,4 %) – слизистая дна полости рта. На языке опухоль располагалась чаще на боковой поверхности (52,2 %). У всех больных был плоскоклеточный рак, с высокой степенью дифференцировки (G1) у 18 больных, средней (G2) – у 34 и низкой (G3) – у 17.
В тканевых гомогенатах образцов опухоли и перитуморальной зоны (неизмененная ткань на расстоянии 1–3 см от опухоли) проводили определение уровней про- и противовоспалительных цитокинов (IL-1ß, IL-1RА, IL-2,IL-6, IL-8, IL-10, IFN-α, IFN-γ, TNF-α) методом ИФА с тест-системами производства «Вектор-Бест» (Новосибирск); результаты выражали в пг/мл; удельное содержание цитокинов вычисляли путем пересчета полученных данных на 1 г белка. В срезах тканей оценивали содержание основных субпопуляций Т-лимфоцитов методом ИГХ с антителами к CD4, и CD8, CD68 фирмы DAKO.
Результаты исследования и их обсуждение
Сравнительная характеристика удельных уровней цитокинов в тканях опухоли и перитуморальной зоны (ПЗ) представлена в таблице. Вариабельность значений оказалась существенной; несмотря на это, удалось установить ряд статистически достоверных различий содержания провоспалительных цитокинов.
Удельное содержание цитокинов в тканях опухоли и ПЗ больных различных групп (пг/мл/г белка)
|
Цитокины |
Группы больных, образцы тканей |
|||||
|
1-я |
2-я |
3-я |
||||
|
Опухоль |
ПЗ |
Опухоль |
ПЗ |
Опухоль |
ПЗ |
|
|
TNF-α |
2,32 ± 1,16 |
1,47 ± 0,24 |
2,83 ± 0,91 |
3,1 ± 0,96 |
2,82 ± 0,78 |
2,32 ± 0,357 |
|
IL-8 |
16,3 ± 3,5* |
5,5 ± 2,33 |
26,7 ± 7,2* |
7,3 ± 2,78 |
17,0 ± 7,4 |
12,7 ± 7,2 |
|
IL-6 |
7,1 ± 3,2* |
0,71 ± 0,158 |
5,95 ± 2,03* |
1,23 ± 0,49 |
13,3 ± 7,3 |
1,4 ± 0,56 |
|
IL-10 |
2,5 ± 0,33 |
2,42 ± 0,33 |
2,92 ± 1,1 |
3,64 ± 1,69 |
1,23 ± 0,4 |
1,84 ± 0,5 |
|
IL-1ß |
14,4 ± 3,8* |
4,7 ± 0,71 |
19,0 ± 4,2* |
6,7 ± 2,1 |
17,5 ± 8,2 |
26,5 ± 10,7 |
|
IL-1RА |
492 ± 83 |
397 ± 33,4 |
– |
– |
– |
– |
|
IFN-α |
0,576 ± 0,1 |
0,548 ± 0,09 |
0,442 ± 0,11 |
0,47 ± 0,08 |
– |
– |
|
IFN-γ |
1,3 ± 0,2 |
1,576 ± 0,19 |
1,26 ± 0,17 |
2,35 ± 0,76 |
– |
– |
|
IL-2 |
0,533 ± 0,06 |
0,5 ± 0,06 |
0,884 ± 0,24 |
1,19 ± 0,56 |
– |
– |
Примечание. * – статистически достоверные отличия от показателей ПЗ (Р < 0,05).
Как видно из таблицы, в опухолевой ткани по сравнению с ПЗ отмечено статистически значимо более высокое содержание провоспалительных цитокинов IL-1ß, IL-6, IL-8 в группе больных без регионарных метастазов; у больных с регионарными метастазами наблюдались сходные различия. При рецидивах подобная разница отмечена только по уровню IL-6, но она оказалась статистически недостоверной вследствие высокой индивидуальной вариабельности показателей. Тканевые уровни интерферонов, IL-2 и IL-10 в опухоли и в ПЗ были невысоки и не имели статистически достоверных различий.
Сопоставление исследованных показателей в ткани опухоли выявило отсутствие статистически значимых различий между данными больных различных групп. В ткани ПЗ сравниваемых групп обнаружены некоторые отличия, например, у больных 3-й группы по сравнению с больными 1-й группы отмечено более высокое содержание TNF-α (2,32 ± 0,357 против 1,47 ± 0,24 пг/мл/г белка) и IL-1ß (26,5 ± 10,7 против 4,7 ± 0,71 пг/мл/г белка); для обоих показателей различия статистически достоверны (Р < 0,05).
Таким образом, показан ряд статистически значимых различий тканевого уровня цитокинов между тканью опухоли и перитуморальной области с преобладанием содержания провоспалительных цитокинов IL-1ß, IL-6, IL-8 в опухолевой ткани. При рецидивах в тканевых образцах ПЗ и опухоли утрачиваются различия по IL-1ß, IL-6 и IL-8, выраженные в двух других группах, что говорит о приближении иммунологических характеристик визуально немалигнизированной ткани к опухолевой и может косвенно свидетельствовать об утрате ею свойств, ограничивающих пролиферативный потенциал опухоли.
Вероятно, избыток провоспалительных цитокинов, у которых описаны ростостимулирующие свойства [1], наблюдается за счет их продукции опухолевыми клетками, а также присутствующими в очаге активированными макрофагами, что способствует росту и распространению опухоли.
При морфологическом исследовании в строме и паренхиме опухолевой ткани выявлено наличие лимфоцитарно-макрофагальной инфильтрации различной степени выраженности: от незначительной (одиночно рассеянные лимфоциты и мелкие лимфоцитарные инфильтраты) до более выраженной преимущественно расположенной на границе опухоли с ПЗ.
Иммуногистохимическое (ИГХ) исследование с использованием моноклональных антител к Т-лимфоцитарным субпопуляциям: Т-хелперам (CD4) и Т-цитотоксическим (CD8) лимфоцитам, а также макрофагам (СD68) позволило оценить состав иммунокомпетентных клеток, инфильтрирующих опухоль.
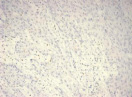
Результаты ИГХ-исследования выявили ряд общих черт для опухолей сравниваемых групп. Так, во всех группах отмечено преобладание в лимфоцитарно-макрофагальном инфильтрате CD8+ лимфоцитов над CD4+ клетками, а также выраженная инфильтрация CD68+ макрофагами, тогда как инфильтрация CD4+ клетками была представлена в виде одиночных лимфоцитов, разрозненно расположенных как в строме, так и в зонах сплошного опухолевого роста (рис. 1).
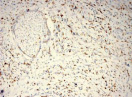
Были обнаружены и некоторые различия между сравниваемыми группами. Так, в 1-й группе выявлена наиболее выраженная инфильтрация CD8+ лимфоцитами (рис. 2), как в строме опухоли, так и в паренхиме. Инфильтрация CD68+ макрофагами была также ярко выражена, составляя в паренхиме опухоли до 20 %, в инфильтратах на границе опухоль – ПЗ от 20 до 40 % инфильтрата (рис. 3).
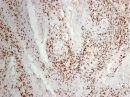
В группах с метастазами и рецидивами отмечено более низкое содержание CD8+ лимфоцитов как в строме, так и в паренхиме опухоли, в сравнении с 1-й группой больных (рис. 2). В отдельных образцах ткани из 2-й группы выявлены только единичные CD8+ лимфоциты в паренхиме опухоли и более выраженная инфильтрация ими на границе опухоль – ПЗ. В образцах ткани больных 3-й группы на отдельных участках в зонах сплошного опухолевого роста отмечено формирование из CD8+ лимфоцитов скоплений по типу лимфоидных фолликулов.
 а)
а) 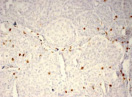 б)
б) 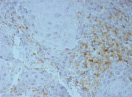 в)
в)
Рис. 1. Инфильтрация единичными CD4+ лимфоцитами опухолевой ткани: а) 1-я группа; б) 2-я группа; в) 3-я группа. Ув. х 200
 а)
а) 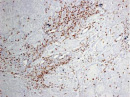 б)
б) 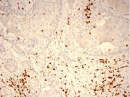 в)
в)
Рис. 2. Инфильтрация CD8+ лимфоцитами опухолевой ткани: а) 1-я группа; б) 2-я группа; в) 3-я группа. Ув. х 100
 а)
а) 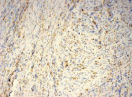 б)
б) 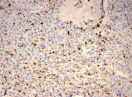 в)
в)
Рис. 3. Инфильтрация CD68+ макрофагами опухолевой ткани: а) 1-я группа; б) 2-я группа; в) 3-я группа. Ув. х 200
Инфильтрация опухоли CD68+ макрофагами опухоли без метастазов также была выше, чем при их наличии. Так, на долю CD68+ макрофагов в лимфоцитарно-макрофагальном инфильтрате больных 1-й группы в паренхиме приходилось от 10 до 20 %, на границе опухоли – ПЗ от 20 до 40 %. В образцах ткани больных 2-й группы выявлено снижение доли CD68+ макрофагов до 10 % как в строме опухоли, так и в ее паренхиме. Напротив, в группе с рецидивами отмечена обильная диффузная инфильтрация макрофагами и в строме и в паренхиме, составляющая до 40 % инфильтрата (рис. 3, в).
Итак, инфильтрация опухолей и пертуморальных зон иммунокомпетентными клетками формируется, главным образом, за счет макрофагов и предшественников цитотоксических Т-лимфоцитов, содержание которых преобладает в группе больных, не имеющих метастазов, над метастатической и рецидивной. Скопление CD8+ и CD68+ клеток отмечено на границе опухоли и перитуморальной зоны. Сопоставляя данные, полученные по уровням провоспалительных цитокинов и по содержанию макрофагов в исследованных образцах, мы предполагаем, что, по-видимому, основной вклад в формирование высокого тканевого содержания цитокинов вносит продукция их опухолевыми клетками (несмотря на сопутствующее воспаление во многих случаях, связанное с активацией макрофагального звена). В опухолях метастатической группы присутствует меньшее количество макрофагов по сравнению с группой без метастазов, однако, высокие уровни IL-1ß, IL-6, IL-8 отмечены в образцах обеих групп; такое несоответствие можно объяснить преимущественной продукцией этих цитокинов опухолевыми клетками.
Вклад СD8+ лимфоцитов в продукцию исследованных нами лимфокинов, вероятно, невелик, поскольку их основными продуцентами среди лимфоцитов считаются активированные СD4+ клетки, присутствие которых в тканевых образцах оказалось незначительным.
По данным литературы, оценка роли лимфоцитарной инфильтрации опухоли представляется неоднозначной, по-видимому, в связи с антигенной неоднородностью опухоли. Наличие или отсутствие экспрессии опухолевыми клетками различных антигенов, в частности, HLA I и II класса некоторые авторы связывают с различной степенью вовлеченности иммунокомпетентных клеток в противоопухолевый ответ [3]. В этих работах прослеживается (на примере рака молочной железы) положительная корреляция между Т-клеточной инфильтрацией опухоли (включая СD4+ и СD8+ лимфоциты) и положительным клиническим прогнозом, однако, судя по данным авторов, это относится к HLA-DR II позитивным опухолям [3]. В других исследованиях подчеркивается однозначно позитивная прогностическая роль инфильтрации СD8+ Т-клетками как предшественниками цитотоксических Т-лимфоцитов – эффекторов адаптивного иммунитета [5]. Преобладание СD8+ над СD4+ клетками, по-видимому, является общим свойством тканей, в отличие от крови, что подтверждено на примере рака слизистой полости рта и языка. Высокие уровни провоспалительных цитокинов, как показано в данной работе, отличают опухолевую ткань рака слизистой полости рта и языка от немалигнизированной, и могут быть неблагоприятным фактором ее развития и распространения, как было ранее продемонстрировано нами на примере опухолей других локализаций [2, 10].
Итак, установлен ряд особенностей локального иммунитета у больных первичным, рецидивирующим и метастазирующим раком слизистой полости рта и языка.
Выводы
1 Формирующийся высокий уровень провоспалительных цитокинов (IL-1ß, IL-6, IL-8) в ткани опухоли слизистой полости рта и языка, могущий вносить вклад в прогрессию и диссеминацию опухоли, является вероятным следствием их продукции опухолевыми клетками; уровни этих цитокинов в ткани опухоли превышают их содержание в перитуморальной зоне.
2. Различия между перитуморальными зонами первичной и рецидивной опухолей по содержанию TNF-α и IL-1ß свидетельствуют о приближении их цитокиновых характеристик к опухолевой ткани при рецидиве.
3. Преобладающей Т-лимфоцитарной субпопуляцией в опухоли являются CD3+СD8+ клетки, найденные в наиболее высоком количестве в опухолях больных без наличия метастазов и в минимальном – у больных с регионарными метастазами.
4. Присутствие макрофагов СD68+ является наиболее выраженным на границе опухоли и перитуморальной зоны у больных без наличия метастазов.
Рецензенты:
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии Ростовского Государственного Медицинского Университета, г. Ростов-на-Дону;
Владимирова Л.Ю., д.м.н., профессор, руководитель отделения противоопухолевой лекарственной терапии № 1, ФГБУ «РНИОИ» МЗ РФ, г. Ростов-на-Дону.



