Нарушение функции поджелудочной железы является причиной возникновения тяжелых заболеваний, в частности сахарного диабета, развитие которых может привести к летальному исходу. Поэтому идентификация новых веществ, регулирующих основные процессы жизнедеятельности в поджелудочной железе, является исключительно актуальной проблемой современной биологии. В связи с этим вызывает интерес группа мембранотропных гомеостатических тканеспецифических биорегуляторов (МГТБ), влияющих в сверхмалых дозах на такие важнейшие биологические процессы, как клеточная адгезия, миграция, пролиферация и дифференцировка клеток [4]. Биорегуляторы данной группы локализованы в межклеточном пространстве тканей, и их биологическое действие характеризуется отсутствием видовой, но наличием тканевой специфичности. МГТБ имеют сложное строение: в их состав входят пептиды, определяющие активность биорегуляторов, а также белки, модулирующие биологическое действие данных пептидов [7]. Установлено, что МГТБ способствуют процессам восстановления и репарации в патологически измененных тканях [4, 5].
Целью исследования было изучение ряда физико-химических свойств и биологическое действие низкомолекулярной компоненты биорегулятора, выделенного из поджелудочной железы крупного рогатого скота.
Материалы и методы исследования
Получение и очистка тканевого экстракта. В работе использовалась свежевыделенная ткань поджелудочной железы крупного рогатого скота (бойный материал ОАО «Мясокомбинат Раменский»). Фрагменты ткани экстрагировали в растворе Рингера (0,15 М NaCl, 1mM CaCl2, 5 mM KCl, 1 mM Hepes) 2 часа при 4 °С. Полученный экстракт центрифугировали 15 мин при 3000 об/мин. Далее в тканевой экстракт добавляли сухой сернокислый аммоний (780 г/л) до образования насыщенного раствора и инкубировали в течение 72 ч при 0–4°. Надосадочную жидкость (супернатант) и осадок собирали и диализовали до полного удаления ионов аммония и исследовали адгезиометрическим методом, в основе которого лежит оценка параметра, характеризующего изменение вязкоупругих свойств плазматической мембраны клеток при стандартном деформационном воздействии [6].
Адгезиометрический метод. Эксперименты проводили in vitro на органных культурах печени мышей – гибридов С57Bl/CBA F1 (18–20 г, самцы), содержавшихся в виварии Института биологии развития им. Н.К. Кольцова РАН. Фрагменты ткани массой от 0,7 до 2 мг инкубировали в течение 120 мин при 37 °С в пенициллиновых флаконах, содержащих 1 мл раствора исследуемой фракции различной концентрации после 10-кратного последовательного разведения её в среде 199. Контрольная серия содержала фрагменты ткани, культивируемые в 1 мл среды 199. Для приготовления растворов исследуемых образцов к 0,1 мл каждой фракции добавляли 0,9 мл среды 199, интенсивно перемешивали, отбирали аликвоту объемом 0,1 мл, к которой добавляли 0,9 мл той же питательной среды. Разведение повторяли до разбавления исходного раствора в 1015 раз. Вследствие высокого содержания воды образцы с 10- и 100-кратным разведением исходного раствора не исследовали. После инкубации фрагменты извлекали, осушали, взвешивали и диспергировали в 0,1 мл 0,1 %-го раствора трипанового синего в среде 199, используя стеклянный гомогенизатор с зазором 50 мкм. Полученную суспензию клеток и клеточных ядер помещали в камеру Горяева. Для каждой экспериментальной точки (отдельная доза) просчитывали не менее 5 фрагментов ткани. Мембранотропную активность рассчитывали по формуле
Ма = 200 % – [(Nоп/Nк)∙100 %],
где Ма – параметр, отображающий мембранотропную активность; Nоп и Nк – количество клеточных ядер, выделившихся из 1 мг ткани, в опытных сериях (тканевые культуры в присутствии исследуемого вещества) и в контрольной соответственно.
О наличии мембранотропной активности судили по превышению значения параметра Ма более чем на 125 %. Каждый эксперимент проводили не менее 3-х раз. Полученные данные обрабатывали статистически (критерий Стьюдента).
Концентрацию белка в исследуемых фракциях определяли спектрофотометрически по методике Варбурга и Кристиана [1].
SDS-электрофорез в 12,5 %-м ПААГ проводили на приборе для вертикального электрофореза по методу Лэммли. В качестве маркеров молекулярных весов использовали реактив фирмы «Sigma-Aldrich» (США): апротинин из легкого быка – 6500 Да, α-лактальбумин – 14200 Да, соевый ингибитор трипсина – 20000 Да, трипсиноген из поджелудочной железы быка – 24000 Да, карбоангидраза – 29000 Да, глицеральдегид – 3 – фосфатгидрогеназа – 36000 Да, овальбумин – 45000 Да, альбумин – 66000 Да. Окраску гелей проводили с помощью Кумасси G-250.
Обращенно-фазовую ВЭЖХ проводили с использованием хроматографа высокого давления фирмы «Agilent 1100 Series» (США) и колонки фирмы «Биохиммак» С8-200 (4,6×150 мм) (Россия). В качестве элюента применяли 0,1 %-й смесь трифторуксусная кислота – ацетонитрил, которую подавали на колонку в виде градиента ацетонитрила от 5 % до 70 % со скоростью элюции 1 мл/мин, 40 мин с 10-й мин. Детекцию белковых фракций осуществляли спектрофотометрически при 280 нм.
Масс-спектрометрический анализ осуществляли на MALDI-TOF масс-спектрометре «UltraFlex 2» фирмы «Bruker Daltonics» (Германия), оснащенном азотным лазером 337 нм и частотой импульса до 20 Гц. Все измерения проводили в линейном режиме, детектируя положительные ионы. Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции-ионизации образца. Параметры масс-спектрометра оптимизировали для диапазона m/z от 1000 до 20000. Внешнюю калибровку проводили с использованием точных значений масс известных белков. Образец наносили на три ячейки планшета, для каждой из которых записывали спектр, полученный в результате суммирования 10 серий спектров по 50 импульсов лазера для каждой. Для записи, обработки и анализа масс-спектров использовали программное обеспечение фирмы «Bruker Daltonics» (Германия): flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11). Точность измерения масс составляла ± 2 Да.
Динамическое лазерное светорассеяние. Определение размеров частиц в исследуемых фракциях осуществляли методом лазерного динамического светорассеяния на приборе «Zetasizer Nano» фирмы «Malvern» (Англия). Фракции предварительно обеспыливали с помощью мембранного фильтра «Millipore» (США) с размером пор 0,22 мкм. Каждый эксперимент проводили не менее 3-х раз. Полученные данные обрабатывали с помощью программы «Zetasizer v.7.01».
Специфическую биологическую активность изучаемой фракции супернатанта определяли на модели стрептозотоцин-индуцированного экспериментального сахарного диабета у крыс Wistar in vivo. Животные содержались в условиях вивария Института биологии развития им. Н. К. Кольцова РАН при свободном доступе к воде и пище.
Экспериментальный диабет у крыс Wistar in vivo. Животным обоего пола, весом 160–180 г, внутрибрюшинно вводили стрептозотоцин фирмы «SIGMA» (ХЧ, США) в виде раствора в 0,1 М фосфатном буфере (рН 6,5) в концентрации 30 мг/кг. Инъекции стрептозотоцина производили трижды с интервалом в 24 часа. Животных разделяли на четыре группы:
- контроль № 1 (n = 10) – интактные животные;
- контроль № 2 (n = 15) – крысы получали внутрибрюшинно по 0,1 мл физ. раствора в течение 14 дней;
- контроль № 3 (n = 15) – крысы получали стрептозотоцин и ежедневно внутрибрюшинно по 0,1 мл физ. раствора течение 14 дней;
- опыт № 1 (n = 15) – крысы получали стрептозотоцин и ежедневно внутрибрюшинно по 0,1 мл раствора фракции супернатанта, выделенной из экстракта поджелудочной железы, в дозе 10–14 мг белка в течение 14 дней.
Введение раствора супернатанта, а также физ. раствора проводили ежедневно, начиная с того же дня, что и введение стрептозотоцина. Концентрацию глюкозы в крови определяли с помощью глюкозооксидазного метода. Для этого после 12-часового голодания внутрибрюшинно вводили раствор глюкозы в дозе 1 г/кг массы животного. После этого из хвостовой вены крыс брали пробы крови натощак, через 1 и 2 часа и определяли концентрацию глюкозы. Концентрацию инсулина в плазме крови определяли с помощью радиоиммунного метода, используя стандартные наборы. На 14-е сутки проведения эксперимента животных выводили из эксперимента (эфирный наркоз), удаляли поджелудочные железы и фиксировали их в 4 %-м формалине. Парафиновые срезы поджелудочной железы приготавливали от 5 крыс каждой группы. Препараты окрашивали гематоксилин-эозином и исследовали с помощью световой микроскопии. Полученные в работе данные были статистически проанализированы с помощью критерия Стьюдента.
Результаты исследования и их обсуждение
Тканевой экстракт поджелудочной железы КРС, а также биологически активную пептидсодержащую фракцию получали согласно ранее разработанному экспериментальному подходу [4].
Данная фракция (супернатант, полученный после высаливания тканевого экстракта поджелудочной железы КРС) проявляла мембранотропную активность в дозе, соответствующей концентрации 10–15 мг/мл, причем вид зависимости значений параметра Ма от степени разбавления исходного препарата приближен к полимодальной (рис. 1), что является характерным признаком МГТБ [1]. Осадок, образовавшийся после высаливания тканевого экстракта, данный вид активности не проявлял и поэтому в данной работе исследован не был.
SDS-электрофорез в 12,5 %-м ПААГ фракции супернатанта показал, что в данной фракции присутствуют низкомолекулярные компоненты (меньше 14200 Да). Полученные данные согласуются с результатами других исследований МГТБ, выделенных из различных тканей животных и растений [1, 3]. Методом MALDI-TOF масс-спектрометрии было доказано присутствие в исследуемой фракции пептидов молекулярной массы от 1331 и до 12282 Да. (табл. 1).
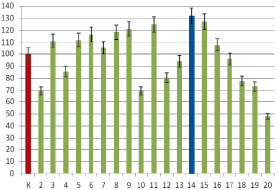
Рис. 1. Мембранотропная активность фракции супернатанта, выделенного из тканевого экстракта поджелудочной железы КРС. Исходная концентрация белка 0,1 мг/мл. По ординате – значение параметра Ма, отражающего мембранотропную активность в %; по абсциссе – степень последовательного 10-кратного разбавления препарата; К – контроль, принятый за 100 %
Таблица 1
Характеристики фракции супернатанта и фракций ВЭЖХ, полученные с помощью MALDI TOF масс-спектрометрии, и их мембранотропная активность
|
Название фракции/время удерживания, мин |
Молекулярная масса, Да |
Проявление мембрано-тропной активности |
|
Супернатант |
1331, 1445, 1900, 2300, 2700, 5786, 6863, 10303, 11573, 12282 |
+ |
|
ВЭЖХ/5,6 |
1004, 1072, 1185, 1418, 1552, 1731, 1859, 2088, 2213, 2540, 2971 |
– |
|
ВЭЖХ/8,4 |
1005, 1202, 1673, 1869, 2694 |
+ |
|
ВЭЖХ/27,2 |
1342, 1613, 2083, 2370, 2675 |
+ |
Методом динамического лазерного светорассеяния показано присутствие в растворе данной фракции наноразмерных частиц (около 200 нм). Ранее было установлено, что наноразмерное состояние МГТБ в водных растворах связано с их способностью проявлять биологическую активность в сверхмалых дозах [1, 3].
Обращенно-фазовой ВЭЖХ фракции супернатанта, выделенного из тканевого экстракта поджелудочной железы КРС, были получены 3 фракции со временем удерживания соответственно 5,6; 8,4 и 27,2 мин (рис. 2). Фракции 8,4 и 27,2 мин проявляли мембранотропную активность в сверхмалых дозах, характерную для МГТБ, фракция же с временем удерживания 5,6 такую активность не проявляла. MALDI-TOF масс-спектрометрией активных фракций было показано присутствие в них нескольких низкомолекулярных пептидов (табл. 1).
Таким образом, было показано, что во фракции супернатанта, выделенной из тканевого экстракта поджелудочной железы КРС, обнаруживаются вещества пептидной природы, имеющие МГТБ-подобные физико-химические свойства и проявляющие характерную для данной группы веществ мембранотропную активность.
На следующем этапе работы изучали специфическую биологическую активность данной пептидсодержащей фракции. Для этого была использована экспериментальная модель сахарного диабета у крыс in vivo. В качестве токсина использовался стрептозотоцин [8]. Как показывают данные, приведенные в табл. 2, фракция супернатанта оказывала в сверхмалых дозах протекторное действие на поджелудочную железу крыс при экспериментальном стрептозотоцин-индуцированном сахарном диабете in vivo: статистически достоверные отличия были обнаружены между показателями, полученными при исследовании крыс 3-й и 4-й групп (р < 0,05). Следует отметить, что у всех животных контрольной группы № 3 были обнаружены признаки глюкозурии, т.е. у всех животных этой группы развился диабет, причем две крысы пали во время проведения опыта. У животных опытной группы № 4 (воздействие стрептозотоцина и фракции супернатанта) диабет развился только у 7 (при повторе у 8) из 15 животных. Обращает на себя внимание тот факт, что показатели содержания глюкозы у этих 7 (аналогично у 8 при повторе) животных группы № 4 имеют более низкие значения, а показатель содержания инсулина – более высокие по сравнению с контрольной группой № 3, хотя эти различия оказались статистически недостоверными (р > 0,05).
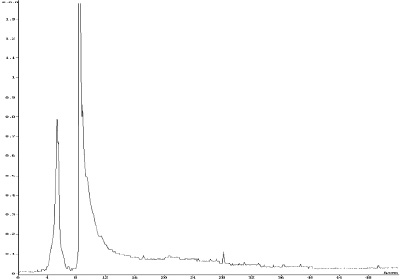
Рис. 2. Обращенно-фазовая ВЭЖХ фракции супернатанта, выделенного из тканевого экстракта поджелудочной железы КРС. По оси абсцисс – время элюции (мин); по оси ординат – поглощение при длине волны 280 нм
Таблица 2
Исследование протекторного действия изучаемой фракции на модели экспериментального сахарного диабета у крыс in vivo
|
№ п/п |
Группа животных |
Количество животных с признаками диабета |
Содержание глюкозы в сыворотке крови (ммоль/л) |
Содержание инсулина в сыворотке крови (мкЕД/л) |
||
|
0 час |
1 час |
2 час |
||||
|
1 |
Контроль № 1 (n = 10) |
0 |
4,2 ± 0,4 |
5,0 ± 1,2 |
4,6 ± 0,8 |
8,7 ± 0,9 |
|
2 |
Контроль № 2 (n = 15) |
0 |
4,4 ± 0,5 |
5,7 ± 1,1 |
4,9 ± 0,7 |
9,2 ± 1,3 |
|
3 |
Контроль № 3 (n = 15) |
13 (2 пали) |
12,1 ± 2,3 |
16,9 ± 1,6 |
16,1 ± 1,4 |
3,3 ± 1,1 |
|
4 |
Опыт № 1 (n = 15) |
7 |
6,5 ± 0,7 |
8,1 ± 0,8 |
6,7 ± 0,4 |
6,2 ± 1,3 |
|
8 |
4,7 ± 1,3 |
5,9 ± 1,7 |
5,0 ± 1,5 |
8,9 ± 1,6 |
||
Результаты исследования гистологических срезов животных этих групп свидетельствуют о принципиальных различиях в состоянии ткани поджелудочной железы у крыс, получавших стрептозотоцин и физ. раствор, и у животных, которые вместе со стрептозотоцином получали инъекции раствора супернатанта в сверхмалых дозах. В контрольной группе № 3 в поджелудочной железе было отмечено развитие дистрофических признаков в значительной части β-клеток. Наблюдали деструкцию островков Лангерганса, особенно в центральной зоне. Кроме того, их размер и количество были явно меньшими, чем у интактных животных. Были также выявлены признаки воспаления: вокруг островков Лангерганса обнаруживались обширные инфильтраты лимфоцитов. Совершенно иную картину наблюдали у животных группы № 4, у которых отсутствовали признаки диабета. Не было обнаружено деструктивных изменений в ткани поджелудочной железы этих животных. Состояние островков Лангерганса, их размеры и число соответствовали таковым у крыс групп № 1 и 2. Признаки воспаления отсутствовали. Состояние поджелудочной железы по данным гистологического исследования 7 (при повторе у 8) крыс с признаками диабета группы № 4 было похоже на состояние ткани у крыс группы № 3. Полученные данные, как и данные исследований, полученных для МГТБ из других источников, показывают протекторное действие данной пептидсодержащей фракции МГТБ на ткань поджелудочной железы, которое заключается в процессах восстановления и репарации в патологически измененных тканях [2, 3].
Заключение
Результаты проведенного исследования показали, что, во-первых, в ткани поджелудочной железы крупного рогатого скота присутствуют биологически активные в сверхмалых дозах МГТБ; во-вторых, было продемонстрировано протекторное свойство пептидной компоненты данного МГТБ на модели экспериментального сахарного диабета у крыс in vivo. Последнее может служить доказательством отсутствия тканевой специфичности МГТБ, выделенного из тканевого экстракта поджелудочной железы, что является еще одним свойством, характерным для всей группы данных биорегуляторов.
Рецензенты:
Брага Э.А., д.б.н., профессор, заведующая лабораторией патогеномики и транскриптомики, ФГБНУ «Научно-исследовательский институт общей патологии и патофизиологии», г. Москва;
Шарова Н.П., д.б.н., заведующая лабораторией биохимии процессов онтогенеза, зам. директора, ФГБУ «Институт биологии развития им. Н.К.Кольцова» РАН, г. Москва.
Работа поступила в редакцию 10.04.2015.



