В настоящее время в Российской Федерации ежегодно на предприятиях энергетики сжигается 650 млн т угля, вследствие чего образуется 300 млн т зольных техногенных отходов. Содержащие различные полезные компоненты золошлаковые отвалы переполнены, и проблема по утилизации является весьма актуальной. Существующие методы переработки [1, 7 и другие] позволяют извлекать незначительные количества ценных компонентов, содержащихся в золошлаковых отвалах. В то же время по вещественному составу зольные техногенные отходы можно рассматривать как комплексное сырье нерудных и рудных полезных ископаемых. Оно находится на поверхности, не требует расходов на добычу из недр, запасы значительны и постоянно увеличиваются.
Цель исследований – изучение физико-химических процессов переработки зольных техногенных отходов и разработка гидрохимического метода обогащения с комплексным извлечением полезных компонентов.
Материалы и методы исследования
Большими перспективами для комплексной переработки зольных техногенных отходов обладает золоотвал Благовещенской теплоэлектростанции (ТЭЦ), расположенный в 3 км западнее ТЭЦ в пади Горбуниха, которая использована в качестве естественного резервуара для хранения золы. Четыре котла Благовещенской ТЭЦ потребляют ежегодно около 1 млн т угля, годовое поступление зольных отходов на золоотвал составляет 150 тыс. т, и в настоящее время их объем составляет более 3 млн т.
Для экспериментального изучения из золоотвала были отобраны 3 пробы общим весом 141 кг, которые после сушки были разделены на магнитную, электромагнитную и немагнитную фракции. Средняя влажность проб составляла 39,5 % по массе. Среднее содержание магнитной фракции составляет 9,1 %, электромагнитной – 88,7 %, немагнитной – 2,2 % по массе. Магнитная фракция в основном представлена шариками магнетита; в электромагнитной фракции преобладают прозрачные и полупрозрачные частицы раскристаллизованного пузырчатого стекла силикатного состава и их шлакоподобные агрегаты, присутствуют зерна полевых шпатов и кварца с включениями магнетита и гематита; в немагнитной фракции наблюдаются зерна кварца, полевых шпатов и частицы несгоревшего угля.
Объектом исследования являлась преобладающая в золе электромагнитная фракция состава, масс. %: SiO2 - 54,27; Al2O3 - 21,01; Fe2O3 - 8,09; TiO2 - 0,66; CaO - 8,24; MnO - 0,30; MgO - 2,49; Na2O - 0,40; K2O - 1,23; P2O5 - 0,08; SO3 - 0,27; п.п.п. - 2,91. Перед опытами исходный материал измельчался до размеров менее 0,25 мм.
Для переработки электромагнитной фракции золы, состоящей по данным рентгенофазового анализа в основном из минералов кварца (SiO2) и муллита (Al6Si2O13), применялись водные растворы гидродифторида (NH4HF2) и фторида (NH4F) аммония, аммиачная вода (NH4OH) и соляная кислота (35 % HCl). Обогащение зольных техногенных отходов осуществляли на лабораторной установке, состоящей из блоков: выщелачивания, гидролиза, пирогидролиза, кальцинации и регенерации, которые обеспечивают непрерывный и малоотходный технологический процесс [5].
Исходное сырье, промежуточные фазы и конечные продукты исследовали химическим, рентгенофазовым, спектральным и электронно-микроскопическим методами анализов, применяемыми в Аналитическом центре минералого-геохимических исследований ИГиП ДВО РАН.
Кинетическими опытами установлены оптимальные физико-химические параметры (концентрации растворов, время выдержки, температура и другие) с определением констант скоростей и энергий активации прохождения химических реакций. Расчеты термодинамических и кинетических параметров осуществлялись с применением программ, разработанных нами на основе приложения Microsoft Access 2007.
Результаты исследования и их обсуждение
Перед проведением экспериментальных работ был проведен термодинамический расчет вероятности протекания химических реакций комплексной переработки электромагнитной фракции золы. По данным расчетов реакции протекают в сторону образования конечных продуктов.
Экспериментально исследованы кинетические кривые гидрохимического выщелачивания гексафторсиликата аммония ((NH4)2SiF6) при температурах 25, 75 и 100 °С, исходной концентрации 25 масс. % NH4HF2 или NH4F в водных растворах и временах выдержки от 0,5 до 7,5 ч. Реакции идут в нормальных условиях даже без перемешивания реакционной смеси, подогрев которой существенно уменьшает продолжительность фторидного выщелачивания. Температура кипения концентрированных водных растворов фторидов аммония составляет 108 °С. Количество фторидов аммония в растворах соответствует стехиометрическому. Уменьшение их концентрации приводит к интенсивному кипению растворов, а увеличение – к образованию избытка водного раствора аммиака и ухудшению качества конечного продукта. Далее хорошо растворимый (NH4)2SiF6 отделяется путем фильтрования от выпадающего при рН = 5,5–6,0 шламового осадка, состоящего из гексафторалюмината ((NH4)3AlF6)) и гексафторферрата ((NH4)3FeF6) аммония, фторидов кальция, магния и других соединений.
Анализ экспериментальных и кинетических данных свидетельствует, что максимальное извлечение (NH4)2SiF6 (более 98,5 %) достигается при температуре 100 °С, времени выдержки 3 ч и при концентрации в водном растворе 25 масс. % NH4HF2 (Кс = 0,010565 мин–1 при 100 °С, Еа = 27,4 кДж/моль). При уменьшении температуры, времени выдержки и замене NH4HF2 на NH4F степень извлечения (NH4)2SiF6 уменьшается. В 25 масс. % водном растворе фторида аммония при температуре 100 °С и времени выдержки 3 ч степень извлечения (NH4)2SiF6 составляет 86,3 масс. %, и достигает максимума (более 98 масс. %) при выдержке 6,5 ч (Кс = 0,009737 мин–1 при 100 °С, Еа = 34,48 кДж/моль).
При гидрометаллургическом выщелачивании осуществляются следующие реакции основных компонентов с водными растворами гидродифторида аммония:
SiO2 + 3NH4HF2 = (NH4)2SiF6 + 2H2O + NH3; (1)
Al2O3 + 6 NH4HF2 = 2(NH4)3AlF6 + 3H2O; (2)
Fe2O3 + 6NH4HF2 = 2(NH4)3FeF6 + 3H2O; (3)
CaO + NH4HF2 = CaF2 + H2O + NH3; (4)
MgO + NH4HF2 = MgF2 + H2O + NH3. (5)
Отделенный раствор (NH4)2SiF6 выпаривается с образованием кристаллического (NH4)2SiF6, а летучие компоненты NH3 и H2O улавливаются в устройстве, заполненном водным раствором, с образованием аммиачной воды. Далее из шламового осадка выщелачивается растворимый в воде (NH4)3AlF6 при рН = 6–6,5, который путем фильтрования отделяется от труднорастворимого гексафторферрата аммония, фторидов кальция и магния. Примесные соединения щелочных металлов при гидрометаллургическом выщелачивании образуют фториды NaF и KF, хорошо растворимые в воде, которые на разных этапах также выделяются из реакционной массы.
Отделенный раствор (NH4)3AlF6 выпаривается с образованием кристаллического гексафторалюмината аммония. По данным рентгенофазового, химического и спектрального анализов образовавшиеся кристаллические фазы (NH4)2SiF6 и (NH4)3AlF6 содержат незначительное количество примесей – менее 10–2 масс. % (Fe, Ti, Na, K и другие). На следующем этапе гексафторсиликат и гексафторалюминат аммония подвергаются гидролизу в воднощелочных растворах.
Водный раствор гексафторсиликата аммония (3–33 масс. % (NH4)2SiF6) взаимодействует с аммиачной водой (25 масс. % NH3) при температурах 20–80 °С по реакции
(NH4)2SiF6 + 4NH4OH = SiO2↓ + 6NH4F + 2H2O
до образования осадка при pH = 8–9, который выдерживали при заданной температуре в течение 1 ч. Затем осадок путем фильтрования отделяется от раствора фторида аммония, который поступает на регенерацию гидродифторида аммония по реакции
2NH4F = NH4HF2 + NH3↑. (7)
В результате происходит синтез нанодисперсного аморфного кремнезема высокой химической чистоты со средним размером наночастиц 17–89 нм. По данным анализа на атомно-силовом микроскопе наименьшего среднего значения (17 нм) размер наночастиц достигает в условиях синтеза при исходной концентрации 3 масс. % (NH4)2SiF6 и температуре 80 °C; наночастицы увеличиваются до средних размеров 61 и 89 нм при концентрациях 20 и 33 масс. % (NH4)2SiF6 соответственно для аналогичной температуры. При концентрации 3 масс. % (NH4)2SiF6 понижение температуры синтеза до 20 °C способствует увеличение среднего размера наночастиц до 33 нм.
В разбавленных растворах при концентрации 3 масс. % (NH4)2SiF6 и температуре 80 °C достигается максимальное извлечение аморфного кремнезёма, равное 92,36 масс. %, которое уменьшается до 71,47 масс. % при концентрации 33 масс. % (NH4)2SiF6 для аналогичной температуры. При концентрации 3 масс. % (NH4)2SiF6 и температуре 20 °С степень извлечения аморфного кремнезёма составляет 82,35 масс. %, и она уменьшается до 68,53 масс. % с повышением концентрации (NH4)2SiF6 до 20 масс. % для аналогичной температуры.
Спектральный анализ нанодисперсных порошков аморфного кремнезема подтверждает наличие в них минимального количества вредных примесей (менее 102 масс. %); на дифрактограммах наблюдается рентгеноаморфное гало с отсутствием кристаллических фаз. По данным химического анализа в аморфном кремнеземе содержится 99,99 масс. % SiO2 и обнаружены следы фтора [4].
В водном растворе (0,5–3 масс. % (NH4)3AlF6) гексафторалюминат аммония взаимодействует с аммиачной водой (25 масс. % NH3) при температурах 20–80 °С по реакции
(NH4)3AlF6 + 3NH4OH = Al(OH)3↓ + 6NH4F (8)
до образования осадка гидроксида алюминия (Al(OH)3) при pH = 8–9, который выдерживали при заданной температуре в течение 1 ч. Затем осадок путем фильтрования отделяется от раствора фторида аммония, который поступает на стадию регенерации (реакция 7).
В результате прохождения процесса (реакция 8) происходит образование микрочастиц гидроксида алюминия с размерами фракций до 10 мкм 2–10 %, от 10 до 50 мкм 10–60 %, микрочастицы крупнее 50 мкм – более 30 % по массе. Спектральный анализ микрочастиц гидроксида алюминия показал наличие в них минимального количества микропримесей (менее 10–1 масс. %), на дифрактограммах фиксируется кристаллическая фаза гиббсит.
В разбавленных растворах при концентрации 0,5 масс. % (NH4)3AlF6 и температуре 80 °C достигается максимальное извлечение гидроксида алюминия, равное 97,10 масс. %, которое уменьшается до 88,91 масс. % при концентрации 3 масс. % (NH4)3AlF6 для аналогичной температуры. При концентрации 0,5 масс. % (NH4)3AlF6 и температуре 20 °C степень извлечения гидроксида алюминия составляет 91,88 масс. %, и она уменьшается до 77,62 масс. % с повышением концентрации (NH4)3AlF6 до 2 масс. % для аналогичной температуры.
Математическая обработка результатов экспериментов проводилась в предположении о том, что массовая степень извлечения аморфного кремнезема или гидроксида алюминия зависит от температуры по уравнению Аррениуса [6]:
а = а0 ехр(–Еа/RT),
а энергия активации вычислялась по формуле
Eа = R∆lnа/∆(1/Т).
Средняя величина Eа составляет 1,6 кДж/моль для реакции 6 и 1,75 кДж/моль для реакции 8, что свидетельствует о протекании этих реакций в диффузионной области.
Далее гидроксид алюминия подвергается кальцинации по реакции
2Al(OH)3 = Al2O3 + 3H2O (9)
при температурах 1100–1200 °C в течение 20–40 мин с получением кондиционного металлургического глинозема, состоящего из смеси фаз: 60–80 % γ-Al2O3 и 20–40 % αAl2O3. По данным химического, электронно-микроскопического и спектрального анализов, полученный глинозем содержит 99,8 масс. % Al2O3 и следующие примеси (масс. %): SiO2 – 0,02; Fe2O3 – 0,03; TiO2 – следы; CaO, MgO, Na2O и K2O не обнаружены, соответствует маркам ГО и Г1 [3]. Из такого продукта возможно извлечение технического алюминия марок А5–А-85.
По известной методике [2] шламовый осадок подвергается термической обработке перегретым водяным паром при 300–650 °С в течение 1,5–2,5 ч с образованием диоксида железа по реакции
2(NH4)3FeF6 + 3H2O = Fe2O3 + 6NH3↑ + 6HF↑, (10)
а фториды кальция и магния не подвергаются пирогидролизу. Далее полученный осадок выщелачивают разбавленным раствором соляной кислоты при температуре 50–60 °С и выдержке 2–3 ч с образованием раствора хлорида железа (FeCl3) по реакции
Fe2O3 + 6HCl = 2 FeCl3 + 3H2O, (11)
который путем фильтрования отделяется от нерастворимого в соляной кислоте остатка, состоящего по данным рентгенофазового анализа из фторидов кальция и магния.
Хлорид железа подвергается гидролизу в водных растворах под действием аммиачной воды (25 масс. % NH3) при температурах 20–80 °C и pH = 7–8 по реакции
2FeCl3 + 3NH4ОН = Fe2O3↓ + 6 NH4Сl + 3H2O (12)
с образованием красного железооксидного пигмента (Fe2O3), который выпадает в осадок, выдерживается при заданной температуре не менее 1 ч и отделяется путем фильтрования от хлорида аммония (NH4Cl). Из NH4Cl регенерируются соляная кислота и аммиак по реакции
NH4Cl = HCl↑ + NH3↑, (13)
которые поступают на определенные стадии технологического процесса.
На рисунке изображена технологическая схема выщелачивания зольных техногенных отходов под действием растворов гидродифторида аммония. На схеме в скобках обозначены химические реакции комплексной переработки электромагнитной фракции (ЭМ) угольной золы, вероятности прохождения которых подтверждены термодинамическими расчетами. Применяемые дополнительные компоненты легко восстанавливаются с отсутствием твердых, жидких и газообразных отходов (реакции 7, 13), что позволяет многократно использовать их в технологическом процессе. При комплексной переработке 100 кг угольной золы теоретически можно извлечь 54,27 кг аморфного кремнезема, 21,01 кг глинозема, 8,09 кг красного железооксидного пигмента и другие полезные компоненты. Среднемировая стоимость ($/кг) золы составляет 0,06, гидродифторида аммония – 2,0, аммиачной воды – 0,1, соляной кислоты – 0,2, а конечных продуктов: аморфного кремнезема – 5,0, глинозема – 0,45, пигмента – 3,0.
Аморфный кремнезем широко используется в резинотехнической, строительной, медицинской и косметических отраслях промышленности, для производства полупроводникового кремния, основы оптоволоконного кабеля и других целей. Глинозем широко применяется для производства технического алюминия электролитическим способом, специальных видов керамики и электрокерамики, изготовления конструкционных и диэлектрических материалов для машиностроительной, энергетической и электронной отраслей промышленности. Пигмент предназначается для получения высококачественных красок и в производстве бумаги, резины, пластмасс и других продуктов.
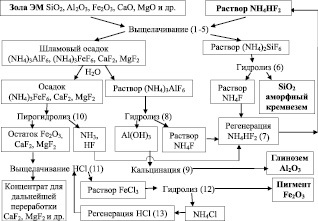
Технологическая схема комплексной переработки угольной золы
Заключение
Теоретическими и экспериментальными исследованиями выявлены оптимальные физико-химические условия переработки зольных техногенных отходов предприятий теплоэнергетики в водных растворах гидродифторида и фторида аммония. В результате разработан гидрохимический метод извлечения нанодисперсного аморфного кремнезема, гидроксида алюминия, глинозема, красного железооксидного пигмента и других полезных компонентов из угольной золы, который позволяет значительно уменьшить материальные и энергетические затраты и обеспечивает более экологически чистое и безопасное получение конечной продукции по сравнению с существующими способами.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 14-05-00239а).
Рецензенты:
Стриха В.Е., д.г.-м.н., профессор, кафедра геологии и природопользования, ФГБОУ «Амурский государственный университет», г. Благовещенск;
Остапенко Н.С., д.г.-м.н., доцент, заведующий лабораторией, ФГБУН «Институт геологии и природопользования Дальневосточного отделения Российской академии наук», г. Благовещенск.



