В структуре заболеваемости злокачественными новообразованиями женского населения как России, так и большинства других стран мира рак молочной железы (РМЖ) занимает лидирующую позицию. За последнее десятилетие с 2002 по 2012 год заболеваемость раком молочной железы в РФ выросла на 29,6 % с 60,22 до 76,74 случаев на 100 тыс. населения. В России в 2013 году выявлено 60 701 новых случаев рака молочной железы [7]. В связи с этим не теряет своей актуальности поиск новых методов лечения данной онкологической патологии. Например, для повышения эффективности химиотерапии больных РМЖ в Ростовском НИИ онкологии использовались методы введения химиопрепаратов на естественных средах организма (крови, лимфе, костном мозге), что достоверно улучшало результаты лечения [1, 2]. В настоящее время достигнуты успехи в исследовании иммунопатологии и иммунотерапии злокачественных опухолей, в том числе рака молочной железы. Если в основу химиотерапии изначально заложено токсическое воздействие на здоровые и больные клетки, то иммунотерапия осуществляет эффект посредством активации собственных механизмов защиты организма [4]. А сочетание химиотерапии с иммунотропными веществами может значительно снижать токсический и иммуносупрессивный эффект цитостатиков [3]. К числу иммунокорригирующих препаратов относится рекомбинантный фактор некроза опухоли – тимозин-α1 (ФНО-Т), который представляет собой уникальное соединение – гибридную молекулу двух биологически активных агентов – цитокина фактора некроза опухолей (ФНО) и гормона тимозина. Рекомбинантный ФНО-Т обладает прямым противоопухолевым действием in vitro на различных линиях опухолевых клеток и in vivo. По спектру цитотоксического и цитостатического действия на опухолевые клетки препарат соответствует ФНО человека, однако рекомбинантный ФНО-Т имеет в 100 раз меньшую общую токсичность, чем ФНО, обладает способностью угнетать ангиогенез в противоположность ФНО, сохраняя при этом способность повышать проницаемость эндотелия сосудов, запускать процесс апоптоза опухолевых клеток, активировать каскад химических реакций коагуляционной системы крови [8]. Благодаря входящему в состав тимозину-α1 рекомбинантный ФНО-Т способен оказывать воздействие на Т-клеточное звено иммунной системы, которое играет ключевую роль в противоопухолевом иммунитете, а также участвует в реакциях гуморального иммунитета [5]. В 2008–2009 гг. на базе ФГУН НИИ онкологии им. проф. Н.Н. Петрова было проведено сравнительное рандомизированное исследование рекомбинантного ФНО-Т в комбинации с полихимиотерапией (ПХТ) в режиме FEC при местно-распространенном и метастатическом раке молочной железы (фаза II/III), которое продемонстрировало улучшение результатов ПХТ в комбинации с рекомбинантным ФНО-Т [6]. В многочисленных исследованиях показано, что регионарное введение ФНО не только вызывает некроз и последующее разрушение кровеносных сосудов опухоли, но и повышает эффективность химиотерапии [9]. По данным литературы после инъекции рекомбинантного ФНО-Т в течение суток вокруг опухоли развивается местная воспалительная реакция, которая внешне проявляется в виде очага гиперемии, слегка болезненного, без инфильтрации в месте введения препарата, благодаря чему непосредственно рядом с опухолью увеличивается интенсивность кровотока и облегчается доставка вводимых системно химиопрепаратов к опухолевому очагу [8]. Также перитуморальное применение рекомбинантного ФНО-Т обладает иммунокорригирующим действием [3]. Поэтому в отличие от стандартного подкожного метода введения рекомбинантного ФНО-Т нами было предложено вводить рекомбинантный ФНО-Т перитуморально.
Целью настоящего исследования являлось изучение влияния рекомбинантного ФНО-Т на эффективность ПХТ у больных местно-распространенным РМЖ, частоту и выраженность побочных явлений, оценить рентгенологические изменения, в том числе изменение размеров опухолевого узла, выраженность радиарной тяжистости, количество микрокальцинатов в опухоли и перитуморальной ткани под влиянием неоадъювантной ПХТ на фоне применения рекомбинантного ФНО-Т.
Материалы и методы исследования
Исследование проводилось на базе отделения химиотерапии № 1 ФГБУ «РНИОИ» МЗ РФ. Основными критериями включения больных раком молочной железы IIB-IIIB стадии были: ECOG ≤ 1, нормальные показатели общеклинических исследований, отсутствие отдаленных метастазов. За период с апреля 2012 года по октябрь 2013 года в исследование было включено 82 больных местно-распространенным раком молочной железы IIB-IIIB стадии, в возрасте от 29 до 69 лет; средний возраст 53,3 ± 1,1 лет. В основную группу вошли 30 пациенток, которым проводилась системная неоадъювантная ПХТ в режиме FAC (5-фторурацил 500 мг/м2 + доксорубицин 50 мг/м2 + циклофосфан 500 мг/м2; интервал между курсами 21 день) или в режиме РА (паклитаксел 175 мг/м2 + доксорубицин 50 мг/м2; интервал между курсами 21 день) в комбинации с перитуморальным введением рекомбинантного ФНО-Т по 200000 МЕ в 1-е сутки (за 30 минут до введения цитостатиков) и далее 1 раз в день во 2–5-е сутки каждого курса ПХТ. В контрольной группе наблюдались 52 пациентки, которым проводилась системная неоадъювантная ПХТ в тех же режимах, но без рекомбинантного ФНО-Т. В основной группе было проведено от 2 до 4 курсов ПХТ каждой пациентке. В группе контроля было проведено от 2 до 6 курсов ПХТ каждой больной. Основная и контрольная группы больных по стадиям заболевания и по характеристикам менструальной функции были сопоставимы (табл. 1).
По данным иммуногистохимического исследования больные основной и контрольной групп тоже существенно не отличались (табл. 2).
Результаты исследования и их обсуждение
Нами было выявлено, что объективный противоопухолевый эффект чаще наблюдался в основной группе больных, чем в контрольной (80 и 71,1 % соответственно; p ≤ 0,05), в том числе за счет увеличения частоты полной регрессии в 2,2 раза: 16,6 % против 7,7 %. Стабилизация была достигнута у 20 % больных в группе с применением рекомбинантного ФНО-Т и у 23,1 % пациентов в группе со стандартной ПХТ без рекомбинантного ФНО-Т. Прогрессирование заболевания (появление отдаленных метастазов в кости) на этапе неоадъювантной терапии было выявлено у 5,8 % больных группы контроля, двум из них в связи с этим хирургический этап лечения выполнить не удалось. Прогрессирования среди больных основной группы зарегистрировано не было. В основной и контрольной группе больных наблюдались побочные эффекты низкой и средней степени выраженности. У больных основной группы были выявлены специфические для рекомбинантного ФНО-Т побочные явления: отмечалась реакция на введение рекомбинантного ФНО-Т в виде очага гиперемии 0–1 степени слегка болезненного, без инфильтрации в месте введения препарата; а также у 16 % пациенток отмечалось повышение температуры тела от 37,2 до 37,8 °С (1 степень по шкале NCIC-CTC) через 6–12 часов после введения рекомбинантного ФНО-Т со снижением до нормальной температуры в течение 24 часов без применения жаропонижающих средств. Местная реакция возникала, как правило, через 6–12 часов после введения препарата, а продолжительность ее варьировала от 24 часов (на 1–2 курсе ПХТ) до 48 часов (при последующих курсах ПХТ). По интенсивности данные нежелательные явления расценивались как слабые, т.е. не нарушали повседневной активности больных, легко переносились (рис. 1).
Таблица 1
Клиническая характеристика больных основной и контрольной групп
|
Группы больных |
Стадия |
Менструальная функция |
|||||
|
IIB |
IIIA |
IIIВ |
Сохранена |
Менопауза (годы) |
|||
|
1–5 |
5–10 |
> 10 |
|||||
|
Основная (кол-во, %) |
5 16,7 % |
11 36,7 % |
14 46,6 % |
13 43,3 % |
7 23,3 % |
5 16,7 % |
5 16,7 % |
|
Контрольная (кол-во, %) |
10 19,2 % |
15 28,8 % |
27 51,9 % |
20 38,5 % |
7 13,5 % |
18 34,6 % |
7 13,4 % |
Таблица 2
Иммуногистохимическая характеристика опухолей больных основной и контрольной групп
|
Группы больных |
Люминальный А |
Люминальный В (HER-2-) |
Люминальный В (HER-2+) |
СErb-B2-сверхэкспрессирующий |
Базально-подобный |
|
Основная (кол-во, %) |
4 13,3 % |
12 40 % |
4 13,3 % |
8 26,7 % |
2 6,7 % |
|
Контрольная (кол-во, %) |
5 9,6 % |
22 42,3 % |
8 15,4 % |
12 23,1 % |
5 9,6 % |
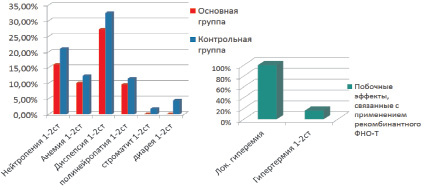
Рис. 1. Характеристика побочных реакций неоадъювантной ПХТ у больных основной и контрольной групп
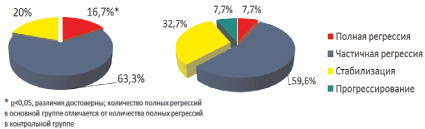
Рис. 2. Характеристика рентгенологического эффекта неоадъювантной ПХТ у больных основной и контрольной групп
Проведена оценка маммограмм 82 пациенток с гистологически верифицированным местно-распространенным раком молочной железы (Т0-1N0-3Мо). Маммограммы выполнялись в прямой и боковой проекции. Рентгенологически в основной группе в большей степени отмечалось значительное уменьшение выраженности радиарной тяжистости, количества микрокальцинатов в опухоли и перитуморальной области, по сравнению с контрольной группой. Выявлено увеличение числа полных и частичных рентгенологических регрессов в основной группе больных по сравнению с группой контроля; стабилизация чаще регистрировалась в контрольной группе (рис. 2).
Клинический пример. Больная И., 1954 г.р. Диагноз: Рак левой молочной железы, сТ2N2М0, stIIIа, Кл. гр. II. Из анамнеза: опухоль в левой молочной железе и левой подкрыльцовой области обнаружила в 2010 году. Обратилась в ФГБУ РНИОИ МЗ РФ 14.05.2012 г., при пункционной биопсии: протоковая карцинома, в 3-х подкрыльцовых лимфоузлах слева метастазы карциномы. СРКТ от 17.05.2012 г.: аксиллярные лимфоузлы слева (3) до 2,7 см; данных за отдаленные метастазы не выявлено. Локальный статус: в верхне-наружном квадранте левой молочной железы опухоль до 2,5 см, без четких контуров; в левой подкрыльцовой области 3 увеличенных лимфатических узла: 2,0; 2,5; 3,0 см в диаметре, плотные, ограниченно подвижные; правая молочная железа без патологии. 21.05.2012 г.: трепан-биопсия опухоли левой молочной железы: медуллярный рак с воспалением. Иммуногистохимический анализ: экспрессия рецепторов эстрогена – отсутствует; экспрессия рецепторов прогестерона – в единичных ядрах; Ki67 – 95 % ядер; Her2/neu 3(+). С мая по июль 2012 года проведено 3 курса ПХТ по FAC схеме с перитуморальным введением рекомбинантного ФНО-Т в дозе 200 000 МЕ с 1 по 5 день лечения. Локальный статус после 3 курсов ПХТ: в верхне-наружном квадранте левой молочной железы образование четко не определяется; правая молочная железа без особенностей; лимфоузлы не пальпируются. Рентгенологически исходно на маммограммах от 14.05.2012 г.: на границе верхне-латерального и верхне-медиального квадрантов (более в верхне-медиальном) левой молочной железы визуализируется плотное теневое образование неправильной звездчатой формы размером до 2,5×2,0 см с выраженной радиарной тяжистостью к коже, соску, ретромаммарной области; субаксиллярно визуализируются тени увеличенных до 1,5 см лимфоузлов сливного характера, свидетельствующих в пользу метастатического поражения; заключение: рак левой молочной железы. После лечения на маммограммах от 21.08.12 г. описанное ранее теневое образование не визуализируется; на его месте нерезко выраженный фиброз без четких контуров; метастатические лимфоузлы не определяются; заключение: полная резорбция (рис. 3).
06.09.2012 г. выполнена радикальная модифицированная бездренажная мастэктомия слева с пластическим компонентом. Гистологический анализ: после ПХТ признаков опухолевого роста в молочной железе не отмечается, метастазов в лимфоузлах нет (лечебный патоморфоз IV степени). С 15.10.2012 по 02.11.2012 г. курс дистанционной гамма-терапии на послеоперационный рубец и пути лимфооттока, СОД 40 изоГр. Далее: 3 курса адъювантной ПХТ. В настоящее время клиническая группа 3.
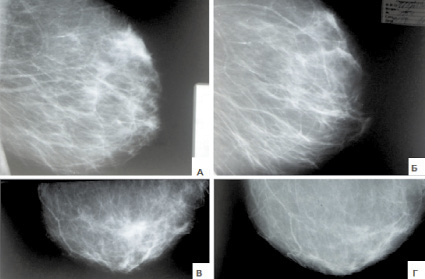
Рис. 3. Маммограммы левой молочной железы больной И., 1954 г.р. в прямой (В, Г) и боковой (А, Б) проекциях (А, В – до лечения; Б, Г – после лечения)
Все пациентки основной группы были прооперированы, никаких послеоперационных осложнений, связанных с использованием рекомбинантного ФНО-Т, не наблюдалось. В настоящее время медиана выживаемости не достигнута, но общая выживаемость в основной группе 28,4 ± 1,1 месяцев, а в контрольной – 26,1 ± 1,4 месяцев; бессобытийная выживаемость в основной группе достоверно выше, чем в контроле (26,9 ± 1,3 и 22,9 ± 1,2 месяцев соответственно; p < 0,05).
Заключение
Таким образом, проведенное исследование показало, что перитуморальное применение рекомбинантного ФНО-Т обладает хорошей переносимостью. Оно позволяет увеличить эффективность терапии больных местно-распространенным РМЖ, снизить частоту и степень выраженности системных побочных реакций, достоверно увеличить число полных и частичных рентгенологических регрессов новообразований, уменьшить выраженность радиарной тяжистости, микрокальцинатов в опухолевой и перитуморальной ткани.
Рецензенты:
Шихлярова А.И., д.б.н., профессор, главный научный сотрудник Южного научного центра РАН, г. Ростов-на-Дону;
Ващенко Л.Н., д.м.н., профессор, заведующая отделением опухолей мягких тканей, костей и молочной железы, ФГБУ РНИОИ МЗ РФ, г. Ростов-на-Дону.



