Оланзапин (2-Метил-4-(4-метил-1-пиперазинил)-10Н-тиено [2,3-b] [1, 5] бензодиазепин) относится к группе «атипичных» нейролептиков. Спектр психотропного действия оланзапина характеризуется наличием инцизивного антипсихотического эффекта и способностью редуцировать не только продуктивную, но и негативную симптоматику. Наряду с этим препарат оказывает благоприятное воздействие на протекание нейрокогнитивных функций у больных шизофренией и в клинически эффективных дозах практически не вызывает экстрапирамидных и нейроэндокринных побочных явлений, что позволяет рекомендовать препарат как средство выбора как для купирования острых психозов, так и для проведения длительной противорецидивной терапии [1, 5]. Исследователями отмечаются случаи передозировки и отравлений оланзапином с летальным исходом [6, 7]. Для точной диагностики отравления оланзапином необходимо разработать методики его изолирования, обнаружения и количественного определения в биологических объектах.
Целью настоящего исследования явилась разработка методик изолирования, обнаружения и количественного определения оланзапина в биологических объектах при острых отравлениях лабораторных животных.
Материалы и методы исследования
Изучение влияния некоторых факторов экстракции (природа органического растворителя, рН, природа электролита, время и кратность экстракции) проводили по следующей методике: 1 мл раствора оланзапина в 96 % этаноле с концентрацией 10 мкг/мл помещали в коническую колбу объемом 25 мл, добавляли 0,1 М раствор хлористоводородной кислоты до рН 6; 5; 4; 3; 2 или 25 % раствор аммиака до рН 8; 9; 10; 11; 12; 13; 14 и 3 мл органического растворителя. Содержимое колбы взбалтывали и помещали в делительную воронку. После разделения фаз отделяли слой органического растворителя. Растворители удаляли при комнатной температуре. Сухие остатки, полученные после испарения экстрагента, растворяли в 5 мл 96 % этанола. Количественное содержание оланзапина определяли спектрофотометрическим методом при длине волны 270 нм [2].
Распределение оланзапина во внутренних органах и биологических жидкостях после острого отравления изучали на белых мышах обоего пола массой 21,0–28,0 г. Оланзапин был введен в виде суспензии в желудок в концентрации, являющейся токсической – 450 мг/кг [8]. По истечении 24 часов животных вводили в наркоз, декапитировали и отбирали внутренние органы и кровь. Мочу собирали в течение суток.
Оланзапин из желудка с содержимым, кишечника с содержимым, печени, почек, головного мозга, сердца изолировали по методу А.А. Васильевой.
Для обнаружения оланзапина в извлечениях методом ТСХ использовали следующую методику [3, 4]: на линию старта хроматографической пластины «Сорбфил» ПТСХ-АФ-В-УФ наносили по 20 мкл исследуемых извлечений с помощью микрошприца. Пластину с нанесенными пробами высушивали на воздухе в течение 10 минут, затем помещали в камеру с системой растворителей, предварительно насыщенную их парами в течение 30 минут и хроматографировали восходящим способом в системах растворителей: этанол-вода – 25 % раствор аммиака (8:1:1); хлороформ-диоксан-ацетон – 25 % раствор аммиака (45:47,5:5:2,5); толуол – ацетон-этанол – 25 % раствор аммиака (45:45:7,5:2,5); диоксан-хлороформ-ацетон – 25 % раствор аммиака (47,5:45:5:2,5); ацетонитрил-изопропанол-вода (5:3:2); этанол – 25 % раствор аммиака (100:1,5); хлороформ-ацетон (90:10); метиленхлорид-метанол – 25 % раствор аммиака (85:15:1); этилацетат – 25 % раствор аммиака – уксусная кислота (26:1,6:3,3); хлороформ-метанол (100:10); этилацетат-хлороформ – 25 % раствор аммиака (85:10:5); бензол-этанол – 25 % раствор аммиака (50:10:0,5); метанол – 25 % раствор аммиака (100:1,5). После прохождения фронта растворителей 10 см пластину вынимали и сушили на воздухе в течение 15 мин. Детекцию пятен проводили с помощью УФ-света при длине волны 254 нм с последующей обработкой реактивом Драгендорфа.
Идентификацию оланзапина в извлечениях методом дифференциальной спектрофотометрии проводили по следующей методике: сухой остаток извлечения растворяли в 5 мл 96 % этанола, количественно переносили в мерную колбу вместимостью 100 мл, доводили полученный раствор до метки растворителем, измеряли спектр поглощения полученного раствора в области 200–300 нм с помощью спектрофотометра в кюветах с длиной рабочего слоя 10 мм относительно спиртового раствора извлечения из соответствующего биологического объекта.
Для обнаружения и количественного определения оланзапина методом ВЭЖХ были использованы следующие условия хроматографирования: хроматографическая колонка размером 2×75 мм, заполненная обращеннно-фазовым сорбентом «ProntoSil 120-5-C18 AQ»; подвижная фаза: элюент А – 0,1 % раствор кислоты трифторуксусной, элюент Б – ацетонитрил; скорость потока – 100 мкл/мин; время измерения 0,18 с; температура термостата колонки – комнатная, объем пробы 2 мкл, длина волны – 270 нм. Для выяснения характеристик удерживания оланзапина выполняли анализ в градиентном режиме от 10 % элюента Б до 90 % за 15 мин.
Полученные данные статистически обрабатывали с помощью пакета программ EL.
Результаты исследования и их обсуждение
Для разработки оптимальной методики изолирования оланзапина из биологических объектов изучено влияние некоторых факторов на его экстракцию из растворов. Влияние природы органического растворителя и рН среды представлено на рис. 1.
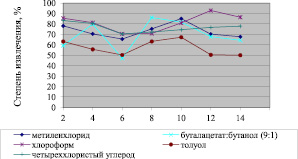
Рис. 1. Зависимость степени извлечения оланзапина от рН среды и природы органического растворителя
Установлено, что оптимальным органическим растворителем для экстракции оланзапина из растворов является хлороформ, который экстрагирует исследуемое вещество при рН = 2 и 12 в максимальном количестве. Этилацетат и бензол оланзапин не экстрагируют. Данные о влиянии природы электролита на экстракцию оланзапина из растворов представлены в табл. 1.
Таблица 1
Определение степени экстракции оланзапина в зависимости от природы электролита
|
Используемый электролит |
Степень экстракции, % |
|
Раствор натрия хлорида 20 % |
34,70 |
|
Раствор натрия хлорида насыщенный |
37,06 |
|
Раствор натрия сульфата 5 % |
65,21 |
|
Раствор натрия сульфата насыщенный |
93,26 |
|
Раствор аммония сульфата 20 % |
46,50 |
|
Раствор аммония сульфата насыщенный |
75,93 |
|
Раствор натрия карбоната 10 % |
66,8 |
|
Раствор натрия карбоната насыщенный |
60,3 |
Полученные данные свидетельствуют о том, что раствор натрия сульфата насыщенный обладает высаливающим действием для оланзапина, а раствор натрия хлорида 20 % – всаливающим действием. Увеличение времени экстракции оланзапина с 3 до 7 минут приводит к уменьшению количества изолируемого вещества с 93,31 до 45,42 %, так как равновесие в концентрациях вещества между твердой и жидкой фазами достигается в течение 3 минут. На степень экстракции оланзапина кратность экстракции не влияет.
Влияние изученных факторов экстракции использовалось нами при разработке методики изолирования оланзапина из плазмы крови и мочи. Методика изолирования оланзапина из плазмы крови: к 0,2 мл центрифугата добавляли 25 % раствор аммиака до рН 12,1 мл раствора натрия сульфата насыщенный и 3 мл хлороформа. Содержимое взбалтывали в течение 3 минут и помещали в делительную воронку. Экстракцию проводили 5 мл хлороформа. После разделения фаз отделяли слой органического растворителя. Растворители удаляли при комнатной температуре. Сухие остатки, полученные после испарения экстрагента, растворяли в 5 мл 96 % этанола. Методика изолирования оланзапина из мочи: к 0,5 мл мочи добавляли 0,2 мл кислоты хлористоводородной концентрированной и кипятили в течение 1 ч на водяной бане. После охлаждения добавляли 25 % раствор аммиака до рН 12, 1 мл натрия сульфата насыщенный и 3 мл хлороформа. Содержимое взбалтывали в течение 3 минут и помещали в делительную воронку. Экстракцию проводили 5 мл хлороформа. После разделения фаз отделяли слой органического растворителя. Растворители удаляли при комнатной температуре. Сухие остатки, полученные после испарения экстрагента, растворяли в 5 мл 96 % этанола.
Для обнаружения оланзапина в извлечениях из внутренних органов и биологических жидкостей использовали физико-химические методы: ТСХ, дифференциальную спектрофотометрию и ВЭЖХ.
Для предварительного исследования оланзапина выбраны системы растворителей: этанол-вода – 25 % раствор аммиака (8:1:1); хлороформ-диоксан-ацетон – 25 % раствор аммиака (45:47,5:5:2,5); толуол – ацетон-этанол – 25 % раствор аммиака (45:45:7,5:2,5), так как величина Rf оланзапина находится в пределах 0,63–0,88. Нами рекомендуется использовать системы растворителей хлороформ-метанол (100:10) и этилацетат-хлороформ-25 % раствор аммиака (85:10:5) для проведения основного исследования оланзапина, а системы этанол – 25 % раствор аммиака (100:1,5); бензол-этанол – 25 % раствор аммиака (50:10:0,5); метанол – 25 % раствор аммиака (100:1,5) целесообразно использовать для хроматографической очистки, так как пятно оланзапина находится в средней хроматографической зоне, что позволяет отделить соэкстрактивные вещества от основного.
Обнаружение оланзапина в извлечениях методом дифференциальной спектрофотометрии проводили после предварительной хроматографической очистки. Спектр извлечения стандартного раствора характеризуется наличием максимума при длине волны 230 ± 2 и 275 ± 2 нм и минимума при 255 ± 2 нм. Спектры извлечений из внутренних органов и биологических жидкостей совпадали с таковыми по положению максимумов и минимумов.
Для обнаружения оланзапина в извлечениях из биологических объектов нами предложено также использовать метод ВЭЖХ. На хроматограмме стандартного раствора оланзапина обнаружен один основной пик со временем удерживания 7,75 мин. На хроматограммах извлечений из биологических объектов обнаруживался пик, совпадающий с основным на хроматограмме стандартного образца.
Данные и статистическая обработка результатов количественного определения оланзапина методом ВЭЖХ во внутренних органах представлены в табл. 2.
Таблица 2
Степень извлечения оланзапина из биологических объектов
|
Внутренний орган |
Степень извлечения, % |
Метрологические характеристики |
|
Печень |
7,80; 8,64; 7,15; 8,62; 7,35; 7,09 |
|
|
Почки |
8,60; 8,51; 10,99; 8,96; 10,68; 9,69 |
|
|
Мозг |
10,46; 11,16; 12,38; 13,09; 12,18; 11,69 |
|
Таблица 3
Степень извлечения оланзапина из биологических жидкостей
|
Биологическая жидкость |
Степеь извлечения, % |
Метрологические характеристики |
|
Плазма крови |
14,90; 13,71; 12,33; 16,00; 15,46; 14,71 |
|
|
Моча |
1,80; 1,87; 1,54; 1,47; 1,35; 1,63 |
|
Как следует из представленных данных, в течение 24 часов после острого отравления оланзапин в максимальном количестве накапливается в мозге (11,83 ± 0,98 %). В печени и почках оланзапин обнаруживался в меньших количествах. В извлечениях из желудка с содержимым, кишечника с содержимым и сердца оланзапин не обнаруживался. Поэтому нами в качестве оптимального биологического объекта при исследовании внутренних органов на оланзапин при остром отравлении рекомендуется использовать мозг.
Данные и статистическая обработка результатов определения оланзапина методом ВЭЖХ в биологических жидкостях представлены в табл. 3.
Как следует из представленных данных, в течение 24 часов после острого отравления оланзапин в неизмененном виде в максимальном количестве обнаруживался в плазме крови (14,52 ± 1,39 %). В моче оланзапин в неизмененном виде обнаруживался в концентрации 1,61 ± 0,21 %.
Выводы
1. Изучено влияние факторов экстракции (природы органического растворителя, рН среды, природы электролита, кратность и время экстракции) на изолирование оланзапина из растворов.
2. Предложены методики обнаружения и количественного определения оланзапина в извлечениях из биологических объектов методами дифференциальной спектрофотометрии, ТСХ и ВЭЖХ.
3. Разработаны методики изолирования оланзапина из плазмы крови и мочи.
4. Предложены оптимальные биологические объекты для проведения судебно-химического анализа оланзапина при остром отравлении.
Рецензенты:Оганесян Э.Т., д.фарм.н., профессор, заведующий кафедрой органической химии, Пятигорский медико-фармацевтический институт, филиал, ГБОУ ВПО «Волгоградский медицинский университет» Минздрава РФ, г. Пятигорск;
Коновалов Д.А., д.фарм.н., заместитель директора по науке, заведующий кафедрой фармакогнозии, Пятигорский медико-фармацевтический институт, филиал, ГБОУ ВПО «Волгоградский медицинский университет» Минздрава РФ, г. Пятигорск.




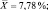 SD = 0,71;
SD = 0,71;
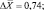 ε = 9,55 %
ε = 9,55 %
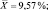 SD = 1,07;
SD = 1,07;
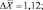 ε = 11,70 %
ε = 11,70 %
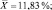 SD = 0,93;
SD = 0,93;
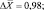 ε = 8,28 %
ε = 8,28 %
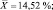 SD = 1,32;
SD = 1,32;
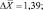 ε = 9,54 %
ε = 9,54 %
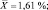 SD = 0,20;
SD = 0,20;
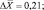 ε = 12,91 %
ε = 12,91 %