В плодовом виноделии одним из важных аспектов является наличие в составе сырья высокомолекулярных полимеров, таких как протопектин, гемицеллюлоза, а также белковые и фенольные вещества [1, с. 76; 2, с. 5–9]. С одной стороны, они участвуют в формировании вкуса и аромата продукции, с другой, являются источниками помутнений. Переход этих веществ и их комплексов в соки и виноматериалы определяет не только качество виноматериалов, но и стабильность готовых изделий при хранении [5, с. 25].
Материалы и методы исследования
Целью настоящей работы явилось применение метода планарной гельпроникающей хроматографии (ПГПХ) в исследовании полимолекулярных соединений и их комплексов в процессе ферментативной обработки плодово-ягодного сырья.
В качестве объекта исследования выбраны соки из яблочного, сливового и черносмородинового сырья.
Исследуемые соки концентрировали упариванием на роторном испарителе ИР-1М2 при 35 °С в 10 раз. Остаток хроматографировали на сефадексе G-25 для удаления низкомолекулярной фракции. Полученный элюат снова концентрировали на роторном испарителе при тех же условиях.
Биополимеры (белки и полисахариды) удаляли осаждением, действуя последовательно хлорными и вольфрамовыми кислотами с последующим центрифугированием.
Для планарной гельпроникающей хроматографии использовали стеклянные пластины с размером 100?120 мм.
Для нанесения гелевой суспензии на пластину применяли простое размазывающее устройство в виде стеклянного стержня с диаметром 10 мм. По краям пластины закреплена липкая лента, толщина которой не превышает 0,5 мм. После всех приготовлений камера устанавливалась на нужный угол для проведения опыта. При нанесении образцов биополимеров камера находилась в горизонтальном положении.
Образцы, содержащие не более 100 мкг исследуемого вещества в объеме 1–3 мкл, наносили на стартовую линию капилляром в виде капли, не прикасаясь к поверхности, во избежание повреждения слоя. Устанавливали камеру с пластинами на определенный угол и выдерживали в течение 1–3 часов. Поскольку при элюировании фронт растворителя неразличим, скорость движения растворителя определяли с помощью соединений с заранее известной массой – маркеров. Для этой цели использовали окрашенные белки природного происхождения, например гемоглобин, цитохром С. В зависимости от скорости движения маркеров регулировали угол наклона камеры, задавая тем самым скорость движения элюента.
Для обнаружения веществ в тонком слое использовалась методика [4, с. 54].
После детектирования путь миграции для неизвестных веществ рассчитывали относительно пути миграции стандартных веществ – маркеров ? и наносили на диаграмму против их молекулярных масс или, что удобнее, их десятичного логарифма (lg). Молекулярную массу можно тогда легко вычислить по таблице антилогарифмов.
Для выбора оптимального угла наклона и проведения дальнейших экспериментов в условиях наиболее эффективного разделения и определения молекулярных масс исследуемых объектов нами в условиях планарной гельпроникающей хроматографии со стандартными белками были проведены следующие экспериментальные изыскания. Оптимальным углом наклона оказался угол от 10 до 20°, при котором вещества, мигрирующие в так называемом «свободном объеме», имеют скорость 1–5 см/ч.
Для проведения анализа были использованы сефадексы марки: G-50, G-75, G-100, G-150 и G-200 «Суперфайн» при разных углах наклона камеры.
Величину молекулярных масс (ММ) определяли по стандартным белкам в качестве которых применяли: инсулин (цепь Б) – ММ 5800; рубониклеазу – ММ 13700; химотрипсин – ММ 25000; трипсин – ММ 25500, овальбумин – ММ 45000; бычий сывороточный альбумин – ММ 67000. Элюирующими системами были: фосфатный буфер (рН 8,0), раствор хлорида натрия и вода.
Результаты исследования и их обсуждение
Была установлена прямая зависимость скорости миграции веществ от угла наклона камеры. Оценку эффективности воздействия ферментов и на высокомолекулярные полимеры соков и виноматериалов осуществляли подобранным нами методом планарной гельпроникающей хроматографии.
Чем больше был угол наклона, тем быстрее мигрировали вещества на пластине.
Ранее было установлено [3, с. 107], что при одинаковом угле наклона скорость на слабо сшитых сефадексах, таких как G-100 и G-200 – «Суперфайн», меньше, чем на сефадексах с более высокой степенью сшивки, таких как G-50 и G-75».
При работе на сефадексе G-200 скорость веществ, мигрирующих со «свободным объемом» (т.е. не проникающих в гранулы геля), не должна превышать 2см/ч; на гелях сефадекса с высокой степенью сшивки скорость может быть несколько больше. Указать заранее оптимальный угол наклона для данного типа геля невозможно, поскольку он зависит от многих факторов, например от свойств партии геля и консистенции суспензии. Пробег для веществ, мигрирующих со «свободным объемом», должен составлять не менее 15 см, при большем пробеге (до 30–40 см) наблюдается лучшее разрешение и вместе с тем не происходит заметного размывания зон [4, с. 17].
В табл. 1 представлены данные миграции образцов, полученные при оптимизации угла наклона на примере сефадекса G-75.
Аналогично были проведены исследования для сефадексов G-100, G-150, G-200, полученные результаты сведены в табл. 2 и 3.
Таблица 1
Характеристика миграции белковых метчиков при оптимизации угла наклона (сефадекс G-75, рН = 8,0, время элюирования 90 мин)
|
Длина пробега белков, миллиметры |
||||||
|
Угол наклона |
Инсулин |
Рибонуклеаза |
Химотрипсин |
Трипсин |
Овальбумин |
Бычий сывороточный альбумин |
|
10° |
42,3 |
61 |
75 |
77 |
91 |
104,5 |
|
12° |
49 |
68 |
84 |
84 |
99 |
109 |
|
15° |
53 |
71 |
88 |
88 |
103,5 |
114 |
|
18° |
56 |
75,5 |
92 |
91 |
108 |
120 |
|
20° |
60 |
81 |
103 |
104 |
120 |
140 |
Таблица 2
Характеристика миграции белковых метчиков при оптимизации угла наклона (сефадекс G-100, рН = 8,0, время элюирования 150 мин)
|
Длина пробега белков, миллиметры |
||||||
|
Угол наклона |
Инсулин |
Рибонуклеаза |
Химотрипсин |
Трипсин |
Овальбумин |
Бычий сывороточный альбумин |
|
10° |
33 |
50 |
63 |
64 |
78 |
85 |
|
12° |
37,5 |
51 |
66,5 |
67 |
81 |
91 |
|
15° |
42 |
58 |
71,5 |
72 |
86 |
96 |
|
18° |
46 |
43,5 |
76 |
76 |
90 |
101 |
|
20° |
52 |
69 |
83 |
84 |
97 |
108 |
Таблица 3
Характеристика миграции белковых метчиков при оптимизации угла наклона (сефадекс G-200, рН = 8,0, время элюирования 180 мин)
|
Длина пробега белков, миллиметры |
||||||
|
Угол наклона |
Инсулин |
Рибонуклеаза |
Химотрипсин |
Трипсин |
Овальбумин |
Бычий сывороточный альбумин |
|
10° |
27 |
34 |
42 |
43 |
49 |
55 |
|
12° |
31 |
41 |
48 |
49 |
56 |
82 |
|
15° |
35 |
45 |
54 |
53 |
61 |
67 |
|
18° |
40 |
50 |
59 |
60 |
67 |
73 |
|
20° |
46 |
57 |
66 |
67 |
75 |
85 |
Выявленные закономерности при определении скорости миграции стандартных белков позволяют рекомендовать для сефадексов с большей степенью сшивки: G-50, G-75 углы наклона камеры от 12 до 15°, даже наклон 15° позволяет проводить разделения на сефадексе G-75 белков с ММ до 80000; дальнейшее увеличение угла наклона нецелесообразно, так как приводит к уменьшению разрешающей способности, особенно высокомолекулярных биополимерных фракций. Для сефадексов с меньшей степенью сшивки G-100 и G-200 рекомендуется применять угол наклона камеры не меньше 15°, так как определяемые на этих сефадексах биополимеры имеют ММ > 6000; уменьшение скорости разделения приводит к значительному увеличению длительности анализа (до 5 часов), что не соответствует технологическим задачам метода.
На основании полученных данных для сефадексов G-75 и G-100 был выбран угол наклона камеры 15°, для сефадексов G-150 и G-200 – угол наклона 20°.
Таблица 4
Средняя скорость миграции стандартных белков с разной ММ в зависимости от марки сефадекса в оптимальных условиях (угол наклона)
|
Марки геля |
G-75 |
G-100 |
G-150 |
G-200 |
|
Угол наклона |
? = 15° |
? = 15° |
? = 20° |
? = 20° |
|
ММ белка |
Средняя скорость миграции, см/ч |
|||
|
5800 |
2,0 |
1,8 |
1,5 |
1,1 |
|
13700 |
3,0 |
2,6 |
2,4 |
1,9 |
|
25000 |
3,5 |
3,1 |
2,8 |
2,3 |
|
25500 |
3,5 |
3,1 |
2,8 |
2,3 |
|
45000 |
3,6 |
3,7 |
3,4 |
2,9 |
|
67000 |
4,2 |
4,3 |
4,0 |
3,4 |
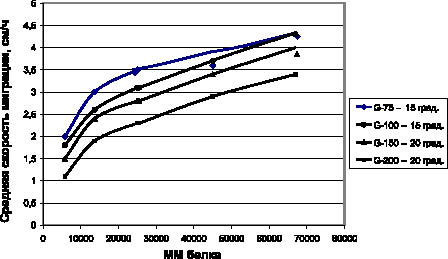
Рис. 1. Калибровочный график для определения молекулярных масс белковых фракций
Средняя скорость миграции стандартных белков с разной молекулярной массой в зависимости от марки сефадекса в оптимальных условиях (угол наклона) представлена в табл. 4.
На основании данных табл. 4 был построен калибровочный график (рис. 1), который в дальнейшем использовали для определения молекулярных масс белковых фракций соков (до и после осветления).
Аналогично строится калибровочный график для определения молекулярных масс обнаруженных фракций полисахаридов (рис. 2).
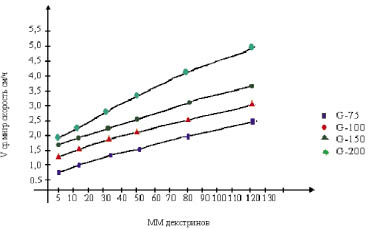
Рис. 2. Калибровочный график для определения молекулярных масс полисахаридных фракций
Таблица 5
Средняя скорость миграции стандартных декстринов с разной ММ в зависимости от марки сефадекса в оптимальных условиях (угол наклона)
|
Марки геля |
G-75 |
G-100 |
G-150 |
G-200 |
|
Угол наклона |
? = 15° |
? = 15° |
? = 20° |
? = 20° |
|
ММ декстринов |
Средняя скорость миграции, см/ч |
|||
|
800 |
1,8 |
1,5 |
1,3 |
0,8 |
|
16000 |
2,3 |
1,8 |
1,5 |
1,0 |
|
35000 |
2,8 |
2,3 |
1,8 |
1,4 |
|
51000 |
3,5 |
2,6 |
2,1 |
1,7 |
|
80000 |
4,3 |
3,3 |
2,5 |
2,1 |
|
120000 |
5,2 |
4,0 |
3,0 |
2,8 |



