Одной из ключевых проблем, требующей решения при осуществлении технологии глубокой очистки отходящих газов карбонатным расплавом щелочных металлов [3, 6–9], является разработка заключительной ее стадии – регенерации получаемых карбонатно-сульфатных расплавов с извлечением серы в товарный продукт. Принципиальное решение данного вопроса предложено в работах [1, 2]. На основании экспериментальных исследований разработаны два способа регенерации карбонатно-сульфатных расплавов: химический – путем восстановления их монооксидом углерода (СО), и электрохимический – путем электролиза карбонатно-сульфатных расплавов при высоких температурах. Оба способа обеспечивают высокое, до 99 %, извлечение серы в товарный продукт и позволяют использовать каждый из них в зависимости от имеющихся условий и возможностей практики.
Учитывая то обстоятельство, что для практического осуществления технологии не менее важным и необходимым представляется изготовление износоустойчивого к агрессивным карбонатно-сульфатным расплавам реактора и/или электролизера, нами были проведены исследования по выбору материала для их изготовления. Результаты исследований, приведенные в работе [2], показали, что в условиях высоких температур (900 °С и более), реактор и электроды, изготовленные из титана, вполне износоустойчивы к агрессивным карбонатно-сульфатным расплавам щелочных металлов. Установлено, что при температуре 450–550 °С и выдержке титанового листа в течение 24 ч в карбонатно-сульфатном расплаве, содержащем до 7,2 % серы, растворения титана в расплаве практически не наблюдается. Полученные результаты показывают возможность применения титана в качестве материала для изготовления реактора при осуществлении регенерации карбонатно-сульфатных расплавов на основе химического способа. Однако, хотя полученные в работе результаты показали высокую износоустойчивость титана к агрессивному карбонатно-сульфатному расплаву при высоких температурах, на практике, при конструировании ячеек электролизера, целесообразнее подбирать другие, более доступные электроизолирующие керамические материалы. Это связано с тем, что при организации процесса электрохимической регенерации необходимо создавать стойкие к высоким температурам и агрессивным средам токовые вводы для электродов. В этой связи применение керамических материалов создает возможность конструирования биполярных электродов (одной стороной которого является анод, а второй – катод).
Практическое осуществление регенерации карбонатно-сульфатных расплавов электрохимическим способом требует создания мощных электролизеров, в конструкции которых наиболее целесообразно применять принцип секционного устройства путем набора повторяющихся элементов – ячеек или секций. При последовательном включении таких секций может быть получен мощный электролизер с биполярным включением электродов. Использование такого типа электролизера имеет свои преимущества по сравнению с однополярным вариантом включения электродов: нет необходимости в чрезмерном повышении силы тока, облегчается ошиновка и запуск/выключение электролизера. Кроме того, электролизеры с биполярным включением электродов более компактны и занимают незначительные производственные площади. При их изготовлении требуется меньший расход конструкционных материалов. В процессе эксплуатации они отличаются большей простотой обслуживания, так как имеют незначительное количество точек контроля и регулирования.
Из вышеизложенного следует, что для изготовления электролизера и токовых вводов электродов необходимо рассмотрение использования других, помимо титана, более доступных керамических материалов, которые обеспечили бы высокую износоустойчивость к агрессивным карбонатно-сульфатным расплавам.
Цель настоящей работы – исследование износоустойчивости керамических материалов на основе оксидов циркония, бериллия и магния к воздействию карбонатно-сульфатных расплавов при высоких температурах.
Материалы и методы исследования
Суть проведенных экспериментов по изучению износоустойчивости керамических материалов в расплаве карбоната лития и расплаве карбонатной эвтектики щелочных металлов заключалась в следующем. В расплав общим объемом 100 (± 5 %) см3, находящийся в титановом контейнере, погружали керамические материалы и выдерживали их от 2 до 33 часов при температуре 900 °С.
По истечении необходимого времени выдержки, с помощью холодного металлического стержня, отбирались пробы расплава (V = 0,1 – 0,4 мм3), которые подвергались минералогическому, рентгеноструктурному и др. видам анализа.
В качестве исходных керамических материалов выбраны оксиды циркония, магния и бериллия.
Оксид циркония чистотой 93,5 %, приобретенный из компании Retsch GmbH, содержал: 5,2 % Y2О3, менее 0,3 % другие оксиды и ~ 1 % (ат.) гафния. Оксиды бериллия и магния чистотой 99,5 % (ат.) и более 99,9 % (ат.) были приобретены из института высокотемпературной электрохимии Уральского филиала Российской академии наук.
Оксиды бериллия и магния представлены в виде тонких, керамических пластин с общей площадью 100–120 мм2, а образцы оксида циркония, частично стабилизированные оксидом иттрия, имели форму короткого цилиндра диаметром ~ 12 мм, длиной ~ 9 мм и площадью поверхности 550–600 мм2.
Кристаллическая структура образца оксида циркония до опыта была тетрагональной; после погружения в расплав происходил фазовый переход в моноклинную форму. Охлажденный образец имел двухфазную форму, характерную для слабо легированного оксида циркония.
До опытов, все исходные расплавы проверялись на содержание в них Mg, Zr и Be. В экспериментах использовались только те расплавы, которые не содержали Mg, Zr и Be. Это связано с тем, что в одном килограмме карбоната лития, в зависимости от чистоты, может иногда содержаться от 0,5 до 100 мг магния [5]. Наличие магния в расплаве может представлять серьезную проблему при проведении опытов.
Для определения многоэлементного и фазового состава исследуемых материалов использован прибор Agilent 7700 Series ICP-MS (Agilent Technologies, USA). Рентгеноструктурный анализ образцов проводился прибором Rigaku, Ultima III (Rigaku Corporation, USA). Для минералогических исследований проб использован прибор SEM (Scanning Electron Microscope) Leo Supra (Carl Zeiss AG, Germany).
Результаты исследования и их обсуждение
Изучение стойкости оксида циркония в расплаве Li2CО3 – Li2О (содержание Li2О = 0,2 % (моль.)) проводили в условиях окислительной атмосферы (CО2). Оксид циркония выдерживался в расплаве при температуре 900 °С в течение 9 ч. По истечении необходимого времени отбиралась проба, которая подвергалась рентгеноструктурному методу анализа. XPS спектры анализированной пробы расплава показаны на рис. 1.
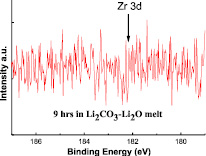
Рис. 1. XPS спектры пробы расплава
Известно, что 3d-фотоэлектронные пики циркония, если они присутствуют в исследуемой пробе, появляются при электрохимическом потенциале равном Е = 182,5 эВ (5/2) и Е = 184,9 эВ (3/2). Однако, как видно на рис. 1, при этих значениях электрохимического потенциала никаких признаков присутствия в расплаве даже незначительно детектируемого количества циркония не обнаружено.
Отрицательные результаты по растворимости циркония были получены и в условиях выдержки образца оксида титана и циркония в расплаве Li2CО3 – Li2О в течение 33 ч, как в атмосфере СО2, так и в атмосфере воздуха. Следовательно, можно утверждать, что в условиях взаимодействия оксида циркония с расплавом Li2CО3 – Li2О, образования цирконата лития либо вообще не происходит, либо он образуется, но при этом он не растворяется в расплаве Li2CО3 – Li2О, а остается на поверхности циркония.
Визуальный осмотр проб оксида циркония, полученного после каждого опыта, показал, что на светло-желтой поверхности оксида циркония образовывался тонкий слой материала серого цвета, который полностью или частично покрывал его поверхность.
Полученный после опытов оксид циркония тщательно промывался в течение 24 ч для полного удаления от него остатков карбонатного расплава и далее подвергался исследованию методом дифракционного рентгеновского анализа (XRD). Рентгенограмма исследуемой пробы оксида циркония, полученная методом XRD анализа, представлена на рис. 2.
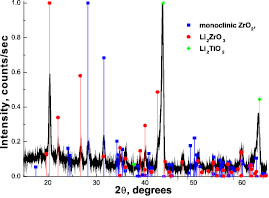
Рис.2. Штрих-диаграмма оксида циркония, выдержанного в расплаве Li2CО3 – Li2О в атмосфере воздуха: τ = 31 ч, t = 900 °С
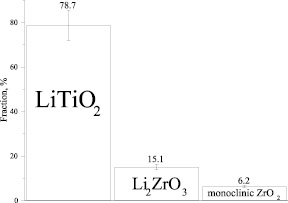
Рис. 3. Результаты количественного соотношения фаз, образующихся при температуре 900 °С и выдержке оксидов титана и циркония в течение 31 ч в расплаве Li2CО3 – Li2О
Вероятно, в условиях проведения опытов (t = 900 °С), реакция взаимодействия оксида циркония с расплавом происходит на поверхности циркониевой керамики, что подтверждается данными работ [4, 5]. Авторами установлено, что образование цирконата лития при 700 °С происходит в результате протекания следующей реакции:
ZrО2 (тв.) + Li2CО3 (тв.) = = Li2ZrО3 (тв.) + CО2^. (1)
В результате обработки данных рентгенограммы, показанной на рис. 2, установлены количественные соотношения образующихся фаз, полученные при взаимодействии оксида титана и циркония с расплавом карбоната лития (рис. 3).
Как показывают результаты количественного анализа данных XRD, даже при минимальном содержании титана в расплаве, равном, 0,3 %, содержание образующегося титанита лития в пять раз больше, чем цирконата лития (рис. 3).
Полученные результаты XRD анализа полностью совпали с данными, полученными методом XRF спектроскопии, согласно которым, на поверхности оксида циркония было обнаружено эквивалентное количество титана. Установлено, что толщина образующихся покрытий на поверхности оксида циркония растет пропорционально времени выдержки образцов керамики в расплаве.
При изучении стойкости оксида магния MgО (tпл. = 2852 °C), XPS спектры проб расплава были получены в области Mg (1s) при электрохимическом потенциале равном Е = 1303 эВ. Пробы расплава для исследований были отобраны после выдержки пластины MgО в расплаве в течение 6 ч при парциальном давлении 1 атм. в атмосфере СО2 и времени выдержки в течение 31 ч на воздухе.
Как видно на рис. 4, наличия магния в полученном XPS спектре пробы расплава обнаружить не удалось. Полученный результат доказывает, что оксид магния при высоких температурах (900 °С) обладает высокой износоустойчивостью к агрессивным расплавам Li2CО3 – Li2О.
Несколько иная картина наблюдалась в случае изучения стойкости оксида бериллия. При анализе пробы расплава, отобранного после выдержки пластины из оксида бериллия в расплаве Li2CО3 – Li2О, на XPS спектре было получено легко определяемое количество бериллия (рис. 5).
Установлено, что интенсивность пика (содержание бериллия в расплаве) находится в прямой зависимости от времени выдержки и повышается при увеличении времени выдержки керамики в расплаве от 3 ч до 9 ч. Содержание бериллия в расплаве после трех часовой выдержки составило 0,47 % (ат.), а после 9 ч. – 1,44 % (ат.). Установленный факт может быть объяснен тем, что оксид бериллия, являясь амфотерным оксидом с сильно выраженными кислотными свойствами, может вступать во взаимодействие с Li2О с образованием устойчивого химического соединения, которая и повышает растворимость бериллия в расплаве.
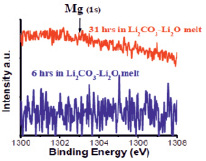
Рис. 4. XPS спектры пробы расплава (определение магния)
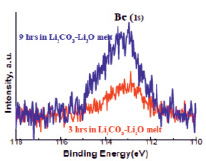
Рис. 5. XPS спектры проб расплава (определение бериллия)
Выводы
1. На поверхности оксида циркония при длительной его выдержке (6 ч) в расплаве при 900 °C появляется покрытие, состоящее из цирконата лития, толщина которого растет с увеличением времени пребывания в расплаве. Установленный факт делает невозможным применение оксида циркония для изготовления реактора и токовых вводов для электродов.
2. Керамика на основе оксида бериллия испытывает сильную коррозию при выдержке в расплаве, что делает ее непригодной для использования в качестве изолирующего материала.
3. Наиболее приемлемым керамическим материалом для использования в качестве изолирующего материала является оксид магния, который практически не реагирует с расплавом и не растворяется в нем.



