В [1] был предложен и проанализирован механизм твердофазного разложения (ТР) азида серебра (АС). По предложенному механизму проведен расчет кинетики ТР азида серебра при различных температурах. Рассчитанные характеристики процесса: стационарная скорость газовыделения, её энергия активации, кинетические зависимости N2(t) хорошо совпадают с экспериментальными [2]. Сравнение расчетных и экспериментальных кривых газовыделения позволило уточнить параметры модели: эффективную массу зонной дырки mр = (3,1 ± 0,1)∙m0, термическую ширину запрещенной зоны: Eg = (1,8 ± 0,06) эВ и константу скорости реакции превращений локализованных на вакансии азид-радикалов в молекулярный азот k14 = (3 ¸ 7)∙105 с-1 при Т = 400 К, оценить положение уровня Ag0 в запрещенной зоне E1 ≈ (0,56 ± 0,04) эВ. Предложенный механизм позволил с единой точки зрения и качественно и количественно объяснить результаты по исследованию кинетики изотермических режимов ТР и электрофизических характеристик АC. В настоящей работе рассмотрено разложение кристаллов АС при наложении поля градиента температур. В работе [3] проведено экспериментальное исследование термического разложения нитевидных кристаллов АС размерами 10´0.1´0.03 мм при наложении в течении 20 минут поля градиента температур(ΔT = 80-150 градус/см). Экспериментально показано:
- Максимум удержанного газа (при растворении) приходится на первую треть кристалла от холодного конца.
-
Образование термолитического серебра (почернение), наблюдалось в нагретой части кристалла.
- Кинетика внешнего газовыделения в эксперименте не регистрировалась.

В рамках предложенных ранее моделях ТР АС данные экспериментальные факты не находят своего объяснения.
На основании проведенных нами [4] квантово-химических расчетов реакции диспропорционирования азидрадикалов показано: реакция протекает через образование стабильного интермедиата, для распада которого требуется преодоление потенцииального барьера.
В той же работе показано, что в решетке азида серебра возможно образование стабильного плоского (с энергией активации распада U = 1,65 эВ) и лабильного линейного (U = 0,45 эВ) комплексов N6. Линейный комплекс легко распадается с достаточно большой константой и относительно малой энергией активации, и плоский - практически не распадающийся при комнатной температуре, однако из-за большой энергии активации (1,65 эВ), распадающийся с большой константой при повышенной температуре. После введения двух типов промежуточных комплексов схема элементарных стадий механизма [1] принимает вид:
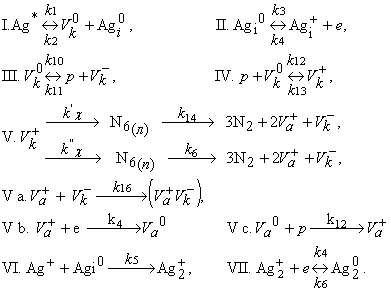
Для моделирования процесса разделили кристалл на 50 ячеек, с определённой температурой в каждой. Температуру охлаждаемой торцевой грани примем равную 273 К, нагреваемой торцевой грани 373 К. Температура по образцу распределена линейно. Потоки носителей заряда в ячейке уравновешены.
Комплекс N6 (плоский) - стабильный промежуточный продукт, накапливающийся за время воздействия в образце, дающий молекулярный N2 при растворении.
При расчётах воспользовались параметрами, приведёнными выше, за исключением k•, величина которого оценивалась по формуле:
![]()
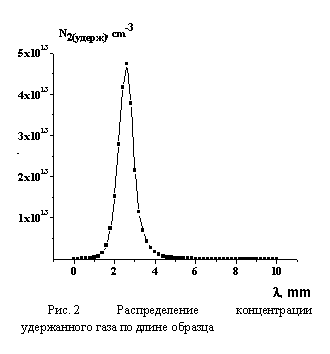
На рис. 1 представлено распределение концентрации продуктов реакции (металла) и выделяющегося при воздействии азота по длине образца. На рис. 2 показано распределение концентрации удержанного газа по длине образца. Из результатов расчёта, следует вывод о качественном подтверждении экспериментальных фактов, обнаруженных в работе [3].
Учёт образования N6 в кристалле 2 двух формах: устойчивый N6(п) и лабильной N6(л) приводит к тому, что в условиях градиента температуры удержанный газ образуется вблизи холодной части, а металл преимущественно у нагретой части кристалла.
[1] Кригер В.Г., Ханефт А.В., Колпаков О.Л.// - В кн.: Химия твердого состояния. Кемерово: Госуниверситет, 1981, с.56 -68.
[2] Кригер В.Г., Каленский А.В., Морейнс Ю.Р. // Тезисы докладов конференции: Эволюция дефектных структур в конденсированных средах. 25-29 июня 2003. Усть-Каменогорск Барнаул -С.103-105.
[3] Звеков А.А., Кузьмина Л.В.//Тезисы докладов 25 Всероссийской школы-симпозиума молодых учёных по химической кинетики. Москва,14-17марта, 2006.-С.32.
[4] V. Kriger, A. Kalensky, L. Bulusheva the MNDO simulation of the reaction 2N3 → 3N2 in the heavy metal azides.// 1st. International congress on radiation physics, high current electronics and modification of materials. 11th international conference on radiation physics and chemistry of condensed matter. Tomsk, Russia,24-29 September 2000.-p.58-60.


