C. trachomatis - один из самых распространенных возбудителей бактериальных инфекций, передаваемых половым путем (ИППП). По данным ВОЗ заболеваемость урогенитальным хламидиозом (УГХ) за период с 2000 по 2006 гг. в развитых странах имеет тенденцию к возрастанию. Эпидемиологическая ситуация в России неблагоприятная: в период с 2000 по 2006 г регистрируется более 90 случаев УГХ на 100 тысяч населения, что составляет около 20 % в структуре всех ИППП. Официальная статистика не отражает истинной ситуации о распространении УГХ, т. к. не полностью учитываются случаи хронического течения болезни.
Хроническая урогенитальная хламидийная инфекция, вызывает весьма широкий спектр осложнений, связанных с диссеминацией C. trachomatis из первичного очага инфекции в отдаленные органы. На данный момент достаточно хорошо изучены интраканаликулярный, лимфогенный пути распространения патогена, а также интранатальный, при прохождении плода через родовые пути матери [3]. Экстрагенитальную патологию и внутриутробное инфицирование плода, обусловленные C. trachomatis, рассматривают как следствие диссеминации патогена гематогенным путем [2]. Однако на сегодняшний день практически отсутствуют микробиологические исследования, доказывающие ключевую роль данного пути в развитии экстрагенитальных патологий хламидийной этиологии.
При хламидиозе отсутствуют специфические клинические симптомы, поэтому методы лабораторной диагностики имеют первостепенное значение [1]. К настоящему времени проблема диагностики хронической формы хламидийной инфекции определяется несколькими факторами. Во-первых, персистирующие формы хламидий, ответственные за развитие хронических инфекций, с трудом выявляются с помощью классических микробиологических и иммунологических методов вследствие нарушения метаболизма и антигенной структуры [5]. Во-вторых, при осложненных формах, связанных с восходящей и экстрагенитальной инфекцией, возбудитель мало доступен для анализа. При этом постановка диагноза урогенитального хламидиоза возможна только при обнаружении C. trachomatis прямыми методами. В-третьих, иммунный ответ при хронической хламидийной инфекции подавлен, что ограничивает возможность использования вспомогательных методов серологической диагностики. В связи с этим, разработка новых методов детекции возбудителя на основе понимания механизмов распространения C. trachomatis в организме при хроническом течении инфекции приобретает особую актуальность.
Цель работы
Изучение гематогенного пути распространения Chlamydia trachomatis и разработка метода диагностики хронических форм хламидиоза экстрагенитальной локализации.
Материалы и методы
Материалом для исследования служили клинические образцы, взятые у пациентов (сыворотка крови, соскобный материал). Из сыворотки крови хламидии выявляли культуральным тестом [4]. Детекцию результатов теста проводили одновременно двумя методами: РИФ и ПЦР с ДНК, выделенной из монослоя зараженных клеток. ДНК из сыворотки выделяли из объема 200 мкл после предварительного концентрирования материала, объемом 1 мл путем центрифугирования при 13 000 об / мин в течение 45 минут при t+4ºC. Выделение проводили набором QIAamp DNA Blood Mini Extraction Kit (Qiagen, Inc). Выявление ДНК проводили методом количественной детекции ДНК с помощью тест-системы «C. trachomatis-количество» (ЗАО «Синтол») на основе Real-time PCR с использованием TaqMan зондов на приборе «АНК-32» (Институт Аналитического Приборостроения, Санкт-Петербург). В данном наборе используются четыре независимых реакции, которые проводятся в одной пробирке одновременно. Первая реакция позволяет обнаружить и определить количество специфического фрагмента 16S рРНК C. trachomatis вторая - детектировать специфический фрагмент криптической плазмиды C. trachomatis. Две другие реакции направлены на определение эффективности выделения ДНК путем детекции гена b-актина человека и внутреннего положительного контроля (ВПК).
Для электронно-микроскопической характеристики циркулирующих в крови хламидий сыворотки больных в объеме 15-20 мл центрифугировали при 14 000 об / мин в течение 1 часа. Осадок сыворотки фиксировали по методу Ито-Карновски. Ультратонкие срезы получали на ультратоме LKB 3 толщина срезов 200-300Аº, помещали на никелевые сетки с формваровой подложкой. Срезы окрашивали по методу Рейнольдса и анализировали в электронном микроскопе JEM-100B.
При иммуноцитохимической детекции ретикулярных и элементарных телец в препаратах сыворотки крови больных процедура иммуномечения проводилась по стандартному протоколу [7] в режиме post embedding (LR White embedding media) на ультратонких срезах с использованием моноклональных видоспецифических антител к C. trachomatis.
Выделение РНК из культуры клеток проводили с использованием реагента Trizol (Invitrogen). Для постановки реакции обратной транскрипции использовали набор «Reverse Transcription System» (Promega, США).
ПЦР с полученной кДНК проводили с выбранными праймерами на следующие гены (табл. 1).
Таблица 1
Последовательности праймеров, выбранных для анализа экспрессии генов C. trachomatis
|
Ген |
Белок |
Праймеры |
|
16 S rRNA |
- |
forward 5'-GGCGTATTTGGGCATCCGAGTAACG-3' reverse 5'-TCAAATCCAGCGGGTATTAACCGCCT-3' |
|
groEL |
HSP60 |
forward 5'- TCTGCGAACGAAGGATATGA -3' reverse 5'- ATAGTCCATTCCTGCGCCAGG -3' |
|
omp1 |
MOMP |
forward 5'-CGTTCGTTGCAGACTTACCA-3' reverse 5'-GTTCCTCGCATACCGAATGT-3' |
|
omcA |
OMP3 |
forward 5' - GTTGCTTCGAAGATCCATGC-3' reverse 5'- GGGCCATGTTTAGCATCTTG-3' |
|
omcB |
OmcB |
forward 5'- CTGCAACAGTATGCGCTTGT-3' reverse 5' -CACGCTGTCCAGAAGAATGA-3' |
|
pmpA |
PmpA |
forward 5'- GCATTTAGCGGCAATACCAT-3' reverse 5'- TGACAATGCCATGACAGGAT-3' |
|
pmpB |
PmpB |
forward 5'-GAAGGCGGTGCTATCTTCTCTC-3' reverse 5'- TCGCTTGCTGTTTGAGCTTTAG-3' |
|
pmpC |
PmpC |
forward 5'- CACCTACGACAACACCAACG-3' reverse 5'- GGAGCAATATCACCCGTCAG-3' |
|
pmpD |
PmpD |
forward 5'- GTTAGACCAAATTCGAGATC-3' reverse 5'- AAGATTCTCCGTCACGAGGA -3' |
|
pmpE |
PmpE |
forward 5'-CTAACTGCTATCTCGATAACC-3' reverse 5'- TCACGAATCTCCACGGTAGG-3' |
Для выявления видоспецифических иммуноглобулинов классов G / M / A использовали тест-системы «ХламиБест-C. trachomatis» и «ХламиБест cHSP60-IgG» для определения IgG к HSP60 производства ЗАО «Вектор-Бест» (Новосибирск).
Результаты исследований
Выявление C. trachomatis в сыворотке крови больных.
Для выявления C. trachomatis в сыворотке крови объектами нашего исследования служили группа больных из 40 человек активного репродуктивного возраста с установленным диагнозом УГХ (18 мужчин и 22 женщины). Критерием включения в исследуемую группу явилось выявление ДНК C. trachomatis с помощью ПЦР в соскобном материале из уретры и цервикального канала
C. trachomatis из образцов сыворотки крови выявляли культуральным методом. Результаты культивирования оценивали 2-мя методами: прямой иммунофлуоресценции (ПИФ) и ПЦР-РВ.
Методом ПИФ в 77,5 % сывороток выявляли единичные внутриклеточные хламидийные включения, мелких и средних размеров, характерные для персистирующих форм (рис. 1).
 а
а  б
б
Рис 1. Выделение C. trachomatis из сыворотки крови культуральным методом.
а- атипичные хламидийные включения, выделямые из сыворотки крови, 72 часов п. и.
б- типичные хламидийные включения, C. trachomatis Bu-434, 48 часов п. и. Линейка 10 µm.
При выделении ДНК из культуры клеток, методом ПЦР-РВ C. trachomatis была выявлена в 92,5 % случаев.
Видовая принадлежность, выделяемых из сыворотки крови C. trachomatis, была подтверждена:
- секвенированием ампликонов области 16S рРНК, показавшим 100 % гомологию с референс штаммами
- положительными результатами амплификации с праймерами к различным областям генома C. trachomatis: генам ompA, omcB, groEL.
Для морфологической характеристики C. trachomatis, выделенной из сыворотки крови у исследуемой группы больных с подтвержденной хламидийной инфекцией было проведено электронно-микроскопическое исследование осадков положительных в ПЦР сывороток. Во всех образцах были выявлены бактериальные клетки размером от 0,2 до 0,3 мкм, имеющие характерную для элементарных телец хламидий структуру, а именно: двухслойную мембрану клеточной стенки и электронно-плотную цитоплазму (рис. 2).
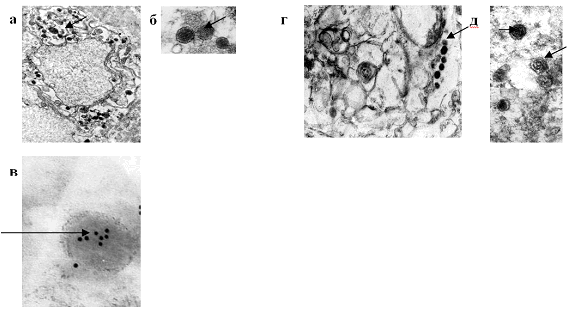
Рис. 2. Электронная микрофотография ультратонкого среза препарата элементарных телец C. trachomatis L2 / 434 / Bu и элементарных телец, выделенных из сыворотки крови больного.
а - элементарные тельца, выявленные в сыворотке больного - общий вид. Ув. 32 000
б - элементарные тельца, выявленные в сыворотке больного. Ув. 60 000
в - элементарные тельца, выявленные методом непрямой реакции иммуномечения в сыворотке больного Ув. 240 000
г- C. trachomatis L2 / 434 / Bu - общий вид. Ув. 35 000
д - C. trachomatis L2 / 434 / Bu. Ув. 60 000
Методом непрямой реакции иммуномечения с использованием моноклональных антител к Chlamydia trachomatis (1 антитела) и антимышиных антител, конъюгированных с коллоидным золотом размером 10 нм (Invitrogen USA) (2 антитела) в препаратах сыворотки крови больных были визуализированы элементарные тельца хламидий.
Изоляты C. trachomatis, выделенные из сыворотки, были культивируемыми, что было подтверждено при их пассировании на клеточной культуре. Включения, образующиеся на 1-ом и 2-ом пассажах, сохраняли измененную морфологию и плохо выявлялись при окрашивании препаратов анти-МОМР моноклональными антителами. Применение количественного метода ПЦР показало, что в процеcсе культивирования образцов сывороток происходит увеличение количества возбудителя на два порядка по сравнению с содержанием патогена в исходном образце.
Для изолятов C. trachomatis 1 пассажа через 48 час после инфицирования (п. и.) была выполнена качественная оценка экспрессии конститутивных генов (16 S rRNA и groEL), генов, кодирующих белки наружной мембраны, средней фазы жизненного цикла (omp1, omcA, pmpA, pmpB, pmpC, pmpD, pmpE) и позднего гена, кодирующего цистеин богатый белок OmcB [6]. Контролем служили лабораторный штамм Bu-434 через 48 час п. и. и персистирующие формы хламидий, индуцированные IFN-γ, через 48 час п. и.
При оценке экспрессии генов у референс штамма была выявлена активность всех анализирумых генов, за исключением гена pmpA, для которого характерно снижение экспрессии на 48 час п. и. У выделенных изолятов не выявляли экспрессию 2-х генов, кодирующих белки наружной мембраны (pmpA и pmpC), а также гена, детерминирующего синтез позднего белка OmcB, подавление экспрессии которого является маркером персистирующих форм. Экспрессия этого гена отсутствовала также у индуцированных действием IFN-γ персистирующих форм.
Отработка метода выделения и детекции ДНК C. trachomatis и изучение диагностической значимости определения возбудителя в сыворотке крови больных с различными формами урогенитальной и экстрагенитальной патологии.
На основании полученных данных становится очевидной необходимость разработки метода диагностики хронических форм УГХ с использованием сыворотки крови в качестве материала для выделения возбудителя. Это особенно актуально в случае развития осложнений экстрагенитальной локализации, когда использование соскобного материала является неинформативным в силу перехода возбудителя в верхние отделы УГТ либо в органы, удаленные от первичного очага инфекции. Для этой цели нами была проведена сравнительная оценка выявления C. trachomatis в соскобах и сыворотке крови методом ПЦР у больных с различными формами урогенитальной и экстрагенитальной патологии.
Были выбраны следующие группы больных:
- 36 человек с хроническими заболеваниями урогенитального тракта и осложненными формами восходящей инфекции
- 33 человека с артрологической патологией
- 20 человек (контрольная группа) без жалоб на заболевания мочеполовой системы.
У этих групп больных были исследованы соскобы из УГТ и сыворотка крови с помощью ПЦР-РВ, а также проведен анализ сыворотки крови на наличие специфических антител классов IgG / M / A к основному белку наружной мембраны (МОМР) C. trachomatis и к белку теплового шока БТШ 60.
В группе больных с хроническими заболеваниями УГТ методом ПЦР-РВ ДНК C. trachomatis была обнаружена в 16,7 % (6 человек) в соскобном материале и в 61,1 % (22 человека) в сыворотке крови. У всех пациентов, положительных по соскобному материалу, ДНК C. trachomatis выявляли также в сыворотке. При выявлении специфических антител к МОМР C. trachomatis диагностически значимые титры антител класса IgG детектировались в 19,5 %. Антитела к белку теплового шока 60 были выявлены у 13,8 % пациентов (5 человек).
В группе с артрологической патологией в соскобе ДНК C. trachomatis была обнаружена в 33 % случаев (11 человек), в то время как в сыворотке - в 63,5 % (21 человек). При этом, у 9 человек, имеющих ДНК C. trachomatis в соскобе, патоген был также детектирован в сыворотке крови. В 30 % случаев в сыворотке крови данной группы больных были определены диагностические титры антител класса IgG. У одного пациента выявляли также антитела класса IgA. Антитела к БТШ60 не был выявлены ни у одного пациента.
В контрольной группе (20 человек) у пациентов в соскобе методом ПЦР-РВ ДНК C. trachomatis выявляли только в 5 % случаев, а в сыворотке - в 10 %.
Обсуждение
Таким образом, в ходе работы впервые был доказан гематогенный путь распространения C. trachomatis на основании культурального выделения инфекционных форм патогена в сыворотке крови больных с диагнозом УГХ.
Оценка экспрессии генов свидетельствуют о метаболической активности выделяемых из сыворотки крови форм C. trachomatis. Кроме того, отсутствие экспрессии гена средней фазы (pmpC) и гена поздней фазы (omcB) может указывать на более медленный цикл развития таких изолятов по сравнению с референс штаммом, что характерно для атипичных персистирующих форм C. trachomatis.
Исходя из полученных данных, наша гипотеза циркуляции C. trachomatis в крови сводится к следующему. C. trachomatis из слизистой оболочки УГТ, вследствие нарушения проницаемости эндотелия сосудов, попадает в кровь и там захватывается моноцитами. Однако патоген не элиминируется клетками иммунной системы, а переходит в персистирующее состояние и завершает свой жизненный цикл с формированием атипичных ЭТ и выходом их в сыворотку крови. Циркуляция инфекционных форм C. trachomatis в крови является условием генерализации инфекции и диссеминации патогена в органы и ткани, удаленные от первичного очага инфекции.
В ходе параллельного выявления C. trachomatis в соскобах и сыворотке крови методом ПЦР у больных с различными формами урогенитальной и экстрагенитальной патологии, впервые было обнаружено, что у пациентов с хроническими и осложненными формами заболеваний УГТ и артрологической патологией ДНК хламидий обнаруживаются в сыворотке крови в 2-3,5 раза чаще, чем в соскобном материале. Это связано с тем, что возбудитель не всегда доступен для анализа в очаге инфекции. Тем самым, выявление ДНК C. trachomatis в сыворотке крови больных, особенно в случае осложненных и восходящих форм хламидиоза, имеет важное диагностическое значение. Применение данного, принципиально нового подхода позволяет выявлять возбудитель вне зависимости от локализации очага инфекции. Кроме того, применение количественного формата ПЦР дает возможность определять бактериальную нагрузку и проводить оценку эффективности антимикробной терапии.
СПИСОК ЛИТЕРАТУРЫ
- Инфекции, передаваемые половым путем. Клиника, диагностика, лечение / Под ред. В. А. Молочкова - М.: Медицина, 2006.
- Мавров Г. И. Chlamydia trachomatis в просвете капилляров маточных труб: возможность гематогенного распространения инфекции // Журн. АМН України, 1996; 4:704-711.
- Савичева А. М. Генитальный хламидиоз: исходы беременности и проявление инфекции у доношенных новорожденных Актуальные микробиологические и клинические проблемы хламидийных инфекций / А. М. Савичева, М. А. Башмакова// Науч. труды, М., 1990. С. 52-55.
- Шаткин А. А. Урогенитальные хламидиозы / А. А. Шаткин., И. И. Мавров // Здоров'я, Київ, 1983; 200 с.
- Belland, R. J. Transcriptome analysis of chlamydial growth during IFN-γ-mediated persistence and reactivation // Proc. Natl. Acad. Sci. USA 2003; 100:15971-15976.
- Hogan RJ,. Chlamydial persistence: beyond the biphasic paradigm // Infect Immun. 2004; 72: 1843-55.
- Zollinger M. Localization of nuclear subunits of cyclic AMP-dependent protein kinase by the immunocolloidal gold method / M. Zollinger, M. Bendayan // J Cell Biol. 1982 Jan; 30 (1):81-85.



