В настоящее время все более актуальным становится разработка систем интегрированной биологической защиты и стимуляции роста растений, не нарушающих экологического равновесия в почве и не загрязняющих окружающую среду. Особое внимание уделяется изучению микробиологических процессов, протекающих в почве, в ризосфере растений, и использованию ризосферных бактерий в качестве агентов контроля различных заболеваний сельскохозяйственных культур [8]. Агротехнические приемы возделывания различных сельскохозяйственных культур − ежегодная обработка почвы, использование химических фунгицидов и т.д., изменяют условия почвенной среды, что оказывает влияние, в первую очередь, на микробоценоз агрогенных почв [9].
Почва, пронизанная корневой системой растений, представляет собой сложную экологическую нишу, заселенную полезными, вредными и нейтральными для растений микроорганизмами [3]. Активная секреция клетками корня различных веществ обеспечивает питательными субстратами микроорганизмы, образующие с ним прочные ассоциации как внутри корневых тканей, так и на корневой поверхности (ризоплане), а также в почве, непосредственно окружающей корни (ризосфере). В ризосфере много грам- отрицательных бактерий, среди которых, в свою очередь, преобладают флуоресцирующие виды бактерий рода Pseudomonas, такие как P. putida, P. fluorescens, P. aureofaciens (chlororaphis), P. сorrugate и др. Некоторые штаммы этих бактерий способствуют значительному улучшению роста и развития растений. Они используются для создания биопрепаратов (содержащих живые клетки этих бактерий), защищающих растения от фитопатогенов, стимулирующих их рост и повышающих продуктивность растений [4].
Целью данной работы явилось изучение влияния биопрепарата на основе Pseudomonas chlororaphis subsp. aureofaciens (Pseudomonas aureofaciens) на состояние микробоценоза почвы, а также сравнение действий экспериментальных биопрепаратов и химического препарата на количественный состав микробного пула почвы.
Материал и методы исследования
Для исследования из коллекции музея лаборатории микробиологии факультета биологических наук ЮФУ брали штамм бактерий Pseudomonas chlororaphis subsp. аureofaciens (Pseudomonas aureofaciens), выделенный в 2009 году из почв промышленной зоны города Ростова-на-Дону. Данный штамм непатогенных псевдомонад обладает высокой биологической активностью по отношению к фитопатогенным грибам [2].
Экспериментальные партии биопрепарата получали глубинным культивированием бактерий Pseudomonas chlororaphis subsp. aureofaciens в колбах при температуре 27 °С в течение 2 суток на оптимизированных питательных средах № 1 и № 2. Титр готового бактериального препарата составил 6,0 ± 0,08·109 кл/мл. Изучили эффективность следующих форм биологических препаратов: жидкая форма 1, жидкая форма 2, торф 1, торф 2, вермикулит 1, вермикулит 2, перлит 1 и перлит 2.
Полевые исследования проводили на опытном участке в Ботаническом саду Южного Федерального университета. Почва опытного участка – чернозем обыкновенный. Перед севом семена обрабатывали биопрепаратами вручную в жидкой форме в норме 1 л/т. Экспериментальные образцы биологических препаратов на носителях вносили по 50 г на 1 м2. В качестве химического препарата был взят «Дивиденд Стар», который вносили в соответствии с рекомендованными нормами расхода (10 л рабочего раствора на тонну семян). «Дивиденд Стар» – комбинированный протравитель для защиты семян зерновых колосовых культур от грибных заболеваний, распространяющихся с семенами и почвой. Контроль − семена без обработки.
Микробиологические исследования проводили в день отбора проб, параллельно осуществляя определение влажности почвы [5].
Отбор почвенных образцов осуществляли с глубины 0–20 см после уборки ячменя. Отбор образцов производили методом «конверта» с помощью ножа, который перед взятием пробы многократно втыкали в почвенный горизонт. Образцы отбирали в стерильные полиэтиленовые мешки. После отбора индивидуальных образцов готовили среднюю пробу.
Для выделения и учета основных физиологических групп микроорганизмов использовали метод посева на агаризованные питательные среды: бактерии – на мясопептонный агар (посев глубинный), актиномицеты ‒ на крахмалоаммиачный агар (посев поверхностный). Численность исследуемых групп выражали в КОЕ/г почвы. Относительное содержание свободноживущих аэробных азотфиксаторов определяли методом обрастания почвенных комочков на среде Эшби и выражали в процентах [6].
Из санитарно-гигиенических показателей оценивался коли-титр и количество термофильных бактерий. Коли-титр определялся прямым поверхностным посевом почвенной суспензии на среду Эндо с последующим учетом последнего разведения, дающего рост колиформных бактерий. Учёт термофильных сапрофитных микроорганизмов производили на мясопептонном агаре после инкубации в течение 24 ч при температуре 50 °С и выражали в КОЕ/г почвы [7].
Результаты исследования и их обсуждение
Традиционно распространена технология обработки семян зерновых культур фунгицидами перед посевом. Однако в современных методиках возделывания все активнее используют биопрепараты. На мировом рынке наибольшее распространение получила жидкая форма препарата, но биопрепараты на носителях удобнее для транспортировки и хранения. Поэтому в данной работе кроме жидкой формы биопрепарата использовали три носителя (перлит, вермикулит и торф).
В ходе анализа полученных данных нами выявлено, что численность бактерий во всех опытных образцах достоверно превышала контрольное значение (рис. 1). То есть самый низкий показатель зафиксирован в почве контрольного варианта – 0,14 ± 0,015·105 КОЕ/г почвы. В варианте «Химический препарат» численность гетеротрофов превышала контроль незначительно, всего в три раза.
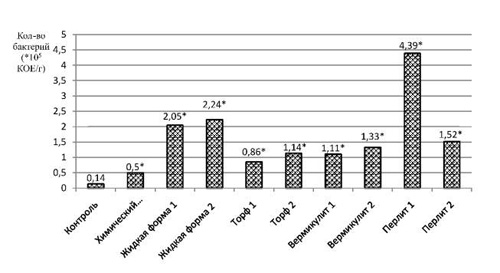
Рис. 1. Численность бактерий в почве после уборки ярового ячменя. * – достоверные значения при p ≤ 0,05
Максимальный показатель численности бактерий зафиксирован в почве, отобранной после применения биопрепарата «Перлит 1». Численность бактерий в этом варианте составила 4,39 ± 0,13·105 КОЕ/г почвы, т.е. в 31,4 раза больше, чем в почве контрольного варианта, и в 8,8 раза превышала численность бактерий после применения химического препарата. На участках с препаратами на основе жидких форм этот показатель ниже и составил 2,05 ± 0,35·105 КОЕ/г почвы у «Жидкой формы 1» и 2,24 ± 0,18·105 КОЕ/г почвы у «Жидкой формы 2», однако в четыре раза выше, чем в почве, обработанной химическим препаратом.
Таким образом, для популяции гетеротрофных бактерий применение всех форм экспериментальных биопрепаратов оказывает позитивное влияние. Лучшей формой биопрепарата оказался «Перлит 1».
Численность актиномицетов в отличие от предыдущей группы в трех вариантах опыта, таких как «Химический препарат», «Торф 2» и «Вермикулит 2», ниже, чем у контрольного варианта. Минимальное количество актиномицетов зафиксировано на участке с химическим препаратом – 4,98 ± 0,25·105 КОЕ/г. Видимо, данный препарат обладает не только явным выраженным фунгицидным действием, но и подавляет мицелиальные прокариотические организмы.
Биопрепарат на носителе перлит 1 оказывает самое позитивное влияние на состояние популяции актиномицетов. В его присутствии их численность равна 16,90 ± 4,5·105 КОЕ/г почвы, т.е. выше в 2,55 раза, чем в почве контрольного варианта (рис. 2).
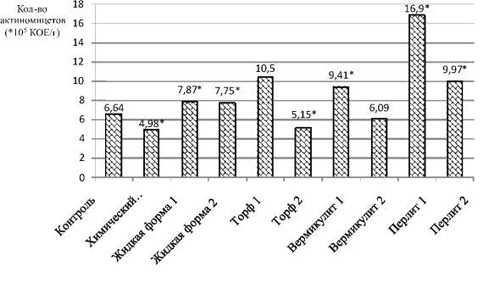
Рис. 2. Содержание актиномицетов в почве после уборки ярового ячменя. * – достоверные значения при p ≤ 0,05
Стоит отметить, что на участках с применением биопрепаратов на основе среды № 1, количество актиномицетов больше, чем на соответствующих участках с биопрепаратами с использованием среды № 2. В то время как для бактерий, наоборот, с одним исключением в варианте с применением перлита.
Суммируя полученные данные, можно отметить, что для актиномицетного сообщества также лучшей препаративной формой является «Перлит 1».
Кроме вышеперечисленных групп микроорганизмов, также в исследуемых почвах определяли содержание бактерий р. Azotobacter (рис. 3). Реакция этих азотфиксаторов на внесение препаратов аналогична группе гетеротрофных бактерий. Во всех опытных образцах содержание Azotobacter sp. выше значения контрольного варианта на 14–29%, при этом во всех почвах после применения биопрепаратов, вне зависимости от формы и носителя, содержание азотфиксаторов свыше 90 %.
В почве с биопрепаратом «Торф 1» зафиксирован наименьший показатель количества азотфиксаторов среди почв, обработанных биопрепаратами, и он составляет 92,67 ± 4,06 %. Одинаково максимальные показатели (99,33 %) в почве с биопрепаратами «Вермикулит 2» и «Жидкая форма 1».
Полученные результаты дают основание считать, что экспериментальные биопрепараты положительно влияют на состояние микробоценоза, увеличивая микробиологическую активность почвы. Также можно отметить, что при использовании биопрепарата на основе «Перлит 1» установлен более высокий уровень микробиологических процессов среди всех опытных препаратов.
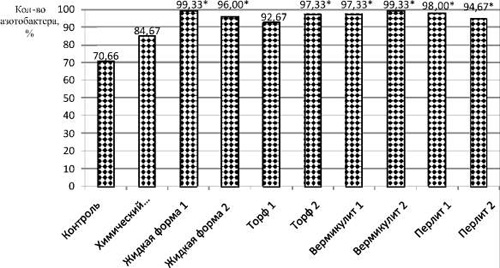
Рис. 3. Содержание бактерий р. Azotobacter в почве после уборки ярового ячменя. * – достоверные значения при p ≤ 0,05
Кроме изучения влияния биопрепаратов и химического препарата на микробиологическую активность почвы, проведено исследование санитарного состояния почвы по двум микробиологическим показателям после уборки ярового ячменя. Результаты исследования представлены в таблице.
Санитарное состояние почвы по микробиологическим показателям после уборки ярового ячменя
|
Образец почвы |
Количество термофильных микроорганизмов, КОЕ/г почвы |
Титр БГКП на г почвы |
|
Контроль |
55 ±2,0 |
0,53 |
|
Химический препарат |
89 ± 4,0* |
6,21 |
|
Жидкая форма 1 |
73 ± 7,0 |
5,26 |
|
Жидкая форма 2 |
22 ± 0,0* |
0,86 |
|
Торф 1 |
83 ± 10 |
0,11 |
|
Торф 2 |
39 ± 1,0* |
0,95 |
|
Вермикулит 1 |
39 ± 1,0* |
0,09 |
|
Вермикулит 2 |
19 ± 1,5* |
0,12 |
|
Перлит 1 |
41 ± 5,0 |
0,09 |
|
Перлит 2 |
47 ± 2,5 |
0,75 |
Примечание. * – достоверные значения при p ≤ 0,05.
В ходе исследования установлено, что наибольшее количество термофильных микроорганизмов в почве с химическим препаратом. Этот показатель составил 89 ± 4 КОЕ/г почвы. Вероятнее всего это связано с тем, что термофилы представлены споровыми, более устойчивыми формами к действию внешних факторов. Стоит отметить, что в почве с биопрепаратом на носителе «Торф 1» и «Жидкая форма 1» количество термофильных микроорганизмов больше, чем в почве контрольного варианта в 1,5 и 1,3 раза соответственно. В остальных вариантах количество термофильных микроорганизмов оказалось меньше, чем в контрольном варианте. По санитарно-гигиеническим нормам данный показатель для чистой почвы равен 102–103 [7], т.е. все почвенные образцы можно охарактеризовать как чистые почвы. Наименьшее количество термофильных микроорганизмов зафиксировано в почве с биопрепаратом на носителе «Вермикулит 2», где этот показатель равен 19 ± 1,5 КОЕ/г почвы.
Анализируя полученные данные по определению титра БГКП, установлено, что этот показатель колебался от 0,09 до 6,21 на 1 г почвы. Наиболее низкий показатель титра БГКП зафиксирован нами в почвах с биопрепаратами «Вермикулит 1» и «Перлит 1». В обоих случаях он составил 0,09, что в 5,9 раз меньше, чем у контрольного варианта. Максимальное значение титра БГКП установлено в почве с химическим препаратом, которое составило 6,21 на 1 г почвы. Данный показатель для чистой почвы ≥ 1,0 [7]. Т.е. чистыми можно считать почвы двух вариантов: «Химический препарат» и «Жидкая форма 1». Все остальные варианты по титру БГКП следует охарактеризовать как загрязненные почвы. Возможно, такие низкие значения титра связаны с тем, что при непосредственном высеве почвы на среду Эндо вырастают так называемые «эндобактерии», к которым относится и большое количество непатогенных бактерий данной группы, типичных обитателей ризосферы, например, таких как Klebsiella, Erwinia и т.д. [1].
Заключение
Таким образом, суммируя все полученные данные, можно сделать вывод, что экспериментальные биопрепараты на основе Pseudomonas chlororaphis subsp. aureofaciens (Pseudomonas aureofaciens) благотворно влияют на микробиологическую активность почвы, т.е. не нарушают экологической целостности микробоценоза в сравнении с контролем и традиционно используемым химическом препаратом, при этом наилучшей формой следует считать «Перлит 1».
Рецензенты:
Бондаренко Т.И., д.б.н., профессор кафедры биохимии и микробиологии ФГАОУ ВПО «Южный федеральный университет», г. Ростов-на-Дону;
Артохин К.С., д.с-х.н., заведующий кафедрой зоологии ФГАОУ ВПО «Южный федеральный университет» г. Ростов-на-Дону.
Работа поступила в редакцию 17.09.2012.
Библиографическая ссылка
Хархун Е.В., Полякова А.В., Внуков В.В., Ким Д.А. СОСТОЯНИЕ МИКРОБОЦЕНОЗА ПОЧВЫ ПОСЛЕ ПРИМЕНЕНИЯ БИОПРЕПАРАТОВ НА ОСНОВЕ PSEUDOMONAS CHLORORAPHIS SUBSP. AUREOFACIENS (PSEUDOMONAS AUREOFACIENS) // Фундаментальные исследования. – 2012. – № 11-1. – С. 56-60;URL: https://fundamental-research.ru/ru/article/view?id=30445 (дата обращения: 20.04.2024).



