Онкологическая патология занимает второе место в России в структуре смертности населения [5, 6]. Заболеваемость новообразованиями ежегодно растет и в 2011 году, по данным Федеральной службы государственной статистики, с впервые в жизни установленным диагнозом злокачественного новообразования на 100 тысяч населения Российской Федерации составила 365,7 и 390,1 в Южном Федеральном округе [4, 5]. В структуре онкологической патологии рак почки занимает 10 место по уровню заболеваемости среди злокачественных новообразований [1, 3, 4]. За последнее десятилетие заболеваемость в России возросла на треть. Мужчины страдают данной патологией в два раза чаще, чем женщины. Несмотря на то, что заболевание преимущественно встречается у пожилых людей, участились случаи выявления заболевания у лиц молодого возраста. В США в 2003 году распространенность рака почки составляла 3 % от всех злокачественных новообразований у взрослых. По данным Frederick A. Klein et al., частота рака почки увеличилась на 3,7 % в период с 1992 по 1998 г. [8]. Гистологическая принадлежность опухоли не всегда является определяющим моментом в развитии клинической картины. Основную роль в этом аспекте играют ее локализация и степень дифференцировки. Многообразие терапевтических масок неоплазий, низкая диагностическая специфичность, поздняя манифестация снижают онкологическую настороженность терапевтов и создают прецеденты для поздней диагностики [1, 2, 4].
На ранних стадиях заболевание протекает бессимптомно. Первым и наиболее частым симптомом рака почки является гематурия (кровь в моче). В этом аспекте научная мысль направлена не только на молекулярное обоснование патогенеза рака почки, разработку новых лекарственных препаратов, внедрение современных схем лечения, усовершенствование хирургической помощи данной категории пациентов, но и на поиск новых неинвазивных высокотехнологичных методов, позволяющих осуществить экспресс-диагностику на ранних этапах развития патологического процесса [1, 4, 7].
Целью исследования являются оценка протеомного зеркала мочи пациентов с раком почки и определение роли полученных белков в формировании патологического процесса.
Материалы и методы исследования
В исследуемую группу вошли пациенты с раком почки (n = 30). Средний возраст составил 52,8 ± 2,6 лет. Критерием включения в группу был верифицированный диагноз рака почки, установленный по результатам пункционной нефробиопсии. Степень дифференцировки рака была различной. Морфологические варианты рака почки в основной группе были представлены тремя формами: светлоклеточный рак (n = 15), папиллярный рак (n = 9) и хромофобный рак почки (n = 6). Группу контроля составили относительно здоровые люди, средний возраст которых был 62,1 ± 1,8 лет. Всем пациентам было выполнено морфологическое исследование препарата почки и масс-спектрометрия мочи.
В исследовании оценивались следующие стандартные показатели:
а) клинические параметры - наличие симптомов отечного синдрома и артериальной гипертонии (АГ);
б) показатели инструментальных методов исследования - УЗИ почек (SonoAceR3, Samsung Medison, Южная Корея), ЭКГ (Schiller AG, Германия);
в) показатели лабораторных методов исследования - общий анализ крови (анализатор Sysmex XT 2000i, Япония; ALIFAX TEST-1, Италия); биохимический анализ крови (мочевина, креатинин, общий белок, альбумин-глобулиновый коэффициент, общий холестерин, калий и натрий на анализаторе Olympus AU640, Beckman Coulter Inc., CША); общий анализ мочи, анализ мочи по Нечипоренко, суточная протеинурия (анализаторы ARCREY Aution MAX, Япония; IRIS IQ-200, США; Sysmex UF-500i, Япония); определение скорости клубочковой фильтрации (СКФ) по формуле MDRD; коагулограмма (анализаторы ACL 9000 и ACL Elite Pro компании Instrumentation Laboratory, США);
г) показатели иммуно-морфологического исследования на материале пункционных биоптатов почек; исследование гистологических препаратов, окрашенных гематоксилином и эозином по Ван-Гизону и Шифф-реактивом, в цифровом микроскопе (Nikon, Япония); ультраструктурное исследование почек выполняли с помощью трансмиссионного электронного микроскопа JEM-1000 (TOKYO BOEKI Ltd., Япония); иммуноморфологическое исследование почечных биоптатов выполняли с применением меченных FITC - антител кролика к Ig G, М, А, С3 и фибрину на люминесцентном микроскопе Laborlux S (Leiсa, Германия); оценка степени фиксации иммуноглобулинов и комплемента в срезах осуществлялась полуколичественным методом по градации интенсивности свечения и распространения в тканях.
Помимо рутинных методов обследования, всем пациентам было выполнено молекулярное фенотипирование мочи, которое выполнялось на основе протеомных методов исследования - префракционирование/двумерный электрофорез в полиакриламидном геле/MALDI (ионизация лазерной десорбции при содействии матрицы)-TOF (время-пролетная) - масс-спектрометрия (прибор Ultraflex II, «Bruker», США). Биоинформационный анализ межмолекулярных взаимодействий проводился на основе интегрированных баз данных InterPro, Entrez, SWISS-PROT, OWL, NRDB, PROSITE, PRINTS, PDB. Обязательным условием включения белка-маркера в диагностический профиль являлся показатель «покрытия сиквенса» при анализе масс-спектрограмм, который составил более 15 %. Также учитывался показатель «ожидаемой интенсивности пептидного фингерпринта» («Expect») для каждого обнаруженного белка, представленный в поисковой системе Mascot Search (UK). Статистическая обработка материала исследования реализована с использованием пакета статистических программ для биомедицинских исследований «Statistica 7.0». Различия считались статистически значимыми при р < 0,05.
Результаты исследования и их обсуждение
В ходе обследования пациентов основной группы были выявлены наиболее частые симптомы: гематурия - 56 %, боль в поясничной области - 44 %, снижение массы тела отмечали 32 %. У 94 % респондентов встречались симптомы, появившиеся заблаговременно до манифестации неоплазии и расцененные нами как паранеопластические (табл. 1).
Таблица 1
Паранеопластические симптомы в группе пациентов с раком почки
|
№ п/п |
Симптом |
Встречаемость в основной группе, % |
|
1 |
Субфибрильная лихорадка |
35,3 |
|
2 |
Артериальная гипертензия |
24,2 |
|
2 |
Хроническая лихорадка |
17,6 |
|
3 |
Постоянная лихорадка |
17,6 |
|
4 |
Гипергидроз |
17,6 |
|
5 |
Миокардиодистрофия |
14,2 |
|
6 |
Анемия |
11,8 |
|
7 |
Кахексия |
11,8 |
|
8 |
Фибрильная лихорадка |
5,9 |
|
9 |
Эритроцитоз |
5,9 |
|
10 |
Эозинофилия |
5,9 |
|
11 |
Ретинальная дегенерация |
5,9 |
|
12 |
Нейропатия |
3 |
|
13 |
Энтеропатия |
3 |
|
14 |
Гиперкальциемия |
3 |
|
14 |
Отсутствие симптомов |
10 |
В ходе протеомного анализа нами были выделены около 300 различных белков. Представленные ниже функциональные группы новых белков, составивших молекулярные профили мочи у пациентов с раком почки, отражают универсальные пути возникновения и прогрессирования онкопроцесса в почечной ткани, а также процессы метастазирования опухоли:
1. Белки, регулирующие тонус сосудов и активность свертывающей и противосвертывающей систем крови, процессы кроветворения (эритропоэтин, аннексин 5, фибронектин).
2. Белки, регулирующие свободнорадикальное окисление (СРО), а также участвующие в деятельности антиоксидантных систем (АОС) на уровне почечной ткани, участники систем детоксикации и элиминации (глицин - амидинотрансфераза, глутатион-S-трансфераза, пероксиредоксин 1).
3. Сократительные белки нефротелия, эндотелия почечных сосудов (кальбиндин 1).
4. Белки-участники метаболизма в нефроцитах (бетаин-гомоцистеин S - метилтрансфераза, глицин - амидинотрансфераза, аргининосукцинат-синтетаза, агматиназа, ЛДГ А, энолаза 2, альдолаза С, пируват-киназа, мышечная форма).
5. Белки, регулирующие клеточный рост, опухолевый рост клетки, реакции протеолиза в клетке, процессинг нейрогормональных факторов, процессы ангиогенеза и адгезии клеток (матриксная металлопротеиназа 2, матриксная металлопротеиназа 9, эритропоэтин, кадгерин 1, глутатион-S-трансфераза, опухоль-ассоциированный ингибитор трипсина, пероксиредоксин 1, аннексин 4, аннексин 5, цистатин В, кальпаин 11).
6. Белки, регулирующие активность рецепторных структур нефроцитов, сосудов почек (рецептор к эпидермальному фактору роста).
7. Структурные белки почечной ткани (уромодуллин, фибронектин).
8. Белки - транскрипционные факторы, регулирующие активность ядра клетки (метил - CpG - связывающий белок 2, изоформа В).
9. Иммунные белки почечной ткани и белки-участники иммунновоспалительных процессов (бета2-микроглобулин, комплемент C4B, пероксиредоксин 1, β-дефензин-1).
10. Транспортные белки (трансферрин, РСБ).
С целью определения повышения или снижения экспрессии белков в зависимости от наличия онкопроцесса забор мочи для масс-спектрометрии в основной группе осуществлялся до операции и через 10 дней после оперативного вмешательства (табл. 2).
Таблица 2
Профиль белков-маркеров рака почки в моче у пациентов исследуемых групп
|
№ п/п |
Название белка-маркера |
Mr, Да |
Контроль (n = 30) |
Основная группа до операции (n = 30) |
Δ, %* |
Основная группа после операции (n = 30) |
Δ, %** |
Δ, %*** |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
1 |
Толлоидоподобный белок 2 |
12014 |
17 |
- |
- |
- |
- |
- |
|
2 |
Бетаин-гомоцистеин метилтрансфераза 2 |
21738 |
0 |
15 |
100 |
25 |
100 |
66,7 |
|
3 |
МетилCpG-связывающий белок 2, изоформа В |
43255 |
25 |
6 |
-76 |
16 |
-36 |
166,7 |
|
4 |
Матриксная металлопротеиназа 9 |
78458 |
0 |
30 |
100 |
15 |
100 |
-50 |
|
5 |
Матриксная металлопротеиназа 2 |
72000 |
0 |
30 |
100 |
18 |
100 |
-40 |
|
6 |
?2-β2-микроглобулин |
13715 |
0 |
30 |
100 |
29 |
100 |
-3,3 |
|
7 |
Эритропоэтин |
21307 |
5 |
15 |
66,7 |
12 |
59 |
-20 |
|
8 |
Рецептор к эпидермальному фактору роста |
7519 |
1 |
24 |
95,8 |
15 |
94 |
-37,5 |
|
9 |
Кадгерин 1 |
99694 |
0 |
30 |
100 |
24 |
100 |
-20 |
|
10 |
Глицин-амидинотрансфераза |
48455 |
28 |
10 |
-180 |
17 |
-65 |
70 |
|
11 |
Аргининосукцинат-синтетаза |
24180 |
0 |
3 |
100 |
6 |
100 |
100 |
|
12 |
Кальбиндин 1 |
28000 |
0 |
9 |
100 |
6 |
100 |
-33,3 |
|
13 |
Агматиназа |
37660 |
12 |
5 |
-140 |
10 |
-17 |
-80 |
|
14 |
Глутатион-S-трансфераза |
23356 |
0 |
15 |
100 |
9 |
100 |
-40 |
|
15 |
Лактатдегидрогеназа A |
36689 |
0 |
9 |
100 |
6 |
100 |
-33,3 |
|
16 |
Комплемент C4B |
192793 |
0 |
6 |
100 |
6 |
100 |
- |
|
17 |
Опухоль-ассоциированный ингибитор трипсина |
8507 |
0 |
30 |
100 |
15 |
100 |
-50 |
|
18 |
Пероксиредоксин 1 |
22110 |
0 |
18 |
100 |
9 |
100 |
-50 |
|
19 |
Аннексин А5 |
35937 |
0 |
15 |
100 |
9 |
100 |
-40 |
|
20 |
β-дефензин-1 |
7400 |
0 |
18 |
100 |
9 |
100 |
-50 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
21 |
Кальпаин 11 |
84423 |
0 |
6 |
100 |
3 |
100 |
-50 |
|
22 |
Уромодуллин |
69761 |
0 |
12 |
100 |
0 |
0 |
-100 |
|
23 |
Энолаза 2 |
47269 |
0 |
9 |
100 |
6 |
100 |
-33,3 |
|
24 |
Аннексин A4 |
36000 |
0 |
12 |
100 |
6 |
100 |
-50 |
|
25 |
Цистатин B |
11140 |
0 |
9 |
100 |
9 |
100 |
- |
|
26 |
Альдолаза С |
22329 |
0 |
9 |
100 |
9 |
100 |
- |
|
27 |
Фибронектин |
13341 |
0 |
12 |
100 |
6 |
100 |
-50 |
|
28 |
Ретинол-связывающий белок |
15800 |
1 |
9 |
89 |
6 |
84 |
-33,3 |
|
29 |
Трансферрин |
77064 |
4 |
12 |
67 |
6 |
34 |
-50 |
|
30 |
Пируват-киназа, мышечная форма |
40190 |
2 |
6 |
67 |
6 |
67 |
- |
Примечание. Δ % - прирост количества пациентов с наличием высокой экспрессии белка-маркера поражения почек в моче у пациентов в исследуемых группах с раком почки и в контрольной: Δ %* - прирост количества пациентов с наличием высокой экспрессии белка-маркера поражения почек в моче во II группе до операции/ контрольная группа здоровых лиц; Δ %** - прирост количества пациентов с наличием высокой экспрессии белка-маркера поражения почек в моче во II группе после операции/контрольная группа здоровых лиц; Δ %*** - прирост количества пациентов с наличием высокой экспрессии белка-маркера поражения почек в моче во II группе после операции/II группе до операции.
Обнаружена высокая экспрессия белков в моче пациентов с раком почки до операции, которые не идентифицировались в моче здоровых лиц контрольной группы: бетаин-гомоцистеин метилтрансфераза 2, матриксная металлопротеиназа 2, матриксная металлопротеиназа 9, β2-микроглобулин, кадгерин 1, аргининосукцинат-синтетаза, кальбиндин 1, глутатион-S-трансфераза, опухоль-ассоциированный ингибитор трипсина, пероксиредоксин 1, аннексин А5, кальпаин 11, энола- за 2, аннексин A4, цистатин B, альдолаза С, фибронектин.
Изменения в молекулярном спектре белков мочи пациентов с раком почки после проведения оперативного вмешательства показали его эффективность в отношении снижения экспрессии белков, регулирующих тонус сосудов и активность свертывающей и противосвертывающей систем крови, процессы кроветворения, в отношении системы СРО-АОС на уровне почечной ткани, участников систем детоксикации и элиминации, сократительных белков нефротелия, эндотелия почечных сосудов, участников метаболизма в нефроцитах, белков, регулирующих клеточный и опухолевый рост клетки, реакции протеолиза в клетке, процессинг нейрогормональных факторов, процессы ангиогенеза и адгезии клеток, белков, регулирующих активность рецепторных структур нефроцитов, сосудов почек, структурных белков почечной ткани, транскрипционных факторов, иммунных белков почечной ткани и транспортных белков по сравнению с контрольной группой здоровых лиц.
Интерес представляет молекула комплемента C4B, уровень экспрессии которой не претерпевал изменений в группе пациентов с раком почки после операции и оставался таким же высоким, как и в группе пациентов с раком почки до операции. Этот факт свидетельствует о необходимости проведения дальнейших исследований молекулярных путей, отражающих активность компонентов системы комплемента в условиях возникновения и прогрессирования онкопроцесса в почечной ткани на ранних стадиях.
Смоделированные нами схемы межмолекулярных взаимодействий обнаруженных белков позволяют определить их роль в формировании патологического процесса. Пример такого взаимодействия представлен на рисунке. Аннексин А5 - это белок, который относится к семейству аннексинов - кальций-зависимых фосфолипид-связывающих белков. Принимает участие в мембранно-связанных экзоцитотоксических и эндоцитотоксических патологических путях при раке почки [10,11]. Аннексин А5 -это фосфолипаза A2 и ингибитор белка протеиназы C с активностью в отношении кальциевых каналов и потенциальной ролью в активации сигнальной трансдукции в молекулярных путях при иммунном воспалении, росте и дифференцировке опухолевых клеток при раке почки. Аннексин А5 также является непрямым ингибитором тромбопластин-специфического комплекса, который вовлечен в коагуляционный каскад (фактор III свертывания крови) [13].
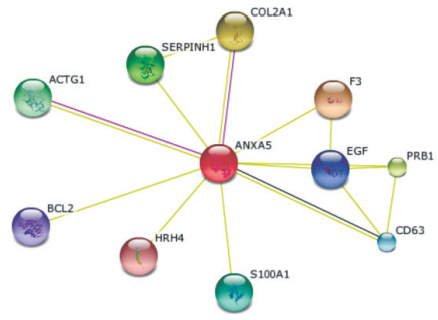
Схема межмолекулярных взаимодействий аннексина А5. Примечания. ANXA5 - аннексин A5; F3 - фактор свертывания крови III (тромбопластин, тканевой фактор); COL2A1 - коллаген, тип II, альфа 1; PRB1 - пролин-содержащий белок, подсемейство 1; SERPINH1 - ингибитор серпиновой пептидазы, класс H (белок теплового шока 47), член 1; ACTG1 - актин, гамма 1; S100A1 - S100 кальций-связывающий белок A1; CD63 - кластер дифференцировки 63; EGF - эпидермальный фактор роста (бета-урогастрон); BCL2 - белок B - клеточной лимфомы; HRH4 - гистаминовый рецептор H4
Экспрессия аннексина А5 увеличивается в группе пациентов с раком почки, вероятно, в связи с активацией тромбопластин-специфического коагуляционного комплекса. Увеличение экспрессии аннексина А5 может приводить к повышению синтеза альфа 1 - цепи коллагена II типа, которая усиливает процессы клеточной адгезии при метастазировании опухолевых клеток. Сопряженное увеличение экспрессии белков PRB1 и аннексина А5 может быть связано с контролем со стороны PRB1 синтеза антител в отношении опухолевых клеток [9, 12].
Заключение
Обнаруженная динамика экспрессии белков мочи в условиях возникновения и прогрессирования рака почки позволяет сформировать современную молекулярную схему патогенеза поражения почечной ткани у данного контингента пациентов. Зарегистрированные молекулярные профили мочи при раке почки разных стадий могут быть рекомендованы для молекулярной диагностики интенсивности поражения почечной ткани на качественном уровне. Необходимым является развитие количественного протеомного анализа мочи при раке почки. Гены-кандидаты, которые обеспечивают экспрессию обнаруженных нами белков, могут быть рекомендованы для выявления генетической предрасположенности к возникновению и прогрессированию поражения почечной ткани у пациентов с раком почки. Полученные нами данные о протеомных профилях мочи у пациентов с раком почки разных стадий являются источником знаний для разработки новых лекарственных препаратов, относящихся к биотаргетным нефропротекторам и противоопухолевым препаратам.
Рецензенты:
Овсянников В.Г., д.м.н., профессор, заведующий кафедрой патологической физиологии Рост ГМУ;
Ткачев А.В., д.м.н., профессор, заведующий кафедрой пропедевтики внутренних болезней Рост ГМУ.
Работа поступила в редакцию 12.12.2012.
Библиографическая ссылка
Гасанов М.З., Батюшин М.М., Терентьев В.П., Цветков Д.С., Пасечник Д.Г. МОЛЕКУЛЯРНЫЕ АСПЕКТЫ ПАТОГЕНЕЗА РАКА ПОЧКИ // Фундаментальные исследования. – 2012. – № 12-2. – С. 244-249;URL: https://fundamental-research.ru/ru/article/view?id=30846 (дата обращения: 18.04.2024).



