Многие белки млекопитающих гликозилированы и являются гликопротеинами (ГП). Развитие ряда патологических состояний сопровождается нарушением процессов гликозилирования, изменением конфигурации углеводной части гликоконъюгатов [9]. Характер таких изменений зависит от типа и стадии конкретного заболевания. В связи с этим возникли принципиально новые подходы к дифференциальной диагностике заболеваний, которые основаны на выявлении гликоформ ГП. В настоящее время наметилось два пути для выявления углеводного профиля ГП – это использование моноклональных антител к углеводным детерминантам и углевод-связывающих белков – лектинов, способных обратимо и избирательно связываться с определенными углеводными структурами.
Воспалительный ответ представляет собой последовательность клеточных и молекулярных событий, которые происходят как реакция на различные стимулы, такие как инфекция и повреждение ткани. Воспаление сопровождается продукцией белков острой фазы, определение которых может говорить о наличии воспаления и степени его тяжести. Изменение гликозилирования ГП во время воспаления продемонстрировано на животных моделях и в некоторых белках острой фазы человека [10].
С-реактивный белок (СРБ) – наиболее характерный представитель семейства острофазных белков. Известно, что концентрация СРБ в сыворотке крови резко возрастает при воспалительном ответе в 10–100 раз [1]. Долгое время считалось, что СРБ не гликозилирован, хотя показано, что у животных в отличие от человека этот острофазный белок содержит углеводные цепи [8]. В 2003 г. впервые появилась работа, в которой представлены данные о гликозилировании СРБ у людей с различным типом патологий, таких как туберкулез, лейкемия, саркома [11]. Позднее этими же авторами показано наличие углеводов в образцах СРБ пациентов с воспалительными заболеваниями, такими как менингит, острый аппендицит, ревматоидный артрит и некоторых других [6]. Нами было показано гликозилирование образцов СРБ в сыворотках крови пациентов с неспецифическим язвенным колитом [2] и ишемической болезнью сердца [4].
Вот уже несколько десятилетий сепсис и тяжелые инфекции остаются одной из актуальных проблем современной медицины в силу неуклонной тенденции к росту числа больных и стабильно высокой летальности, несмотря на использование новых принципов и методов лечения. Целью данной работы является исследование степени гликозилирования суммарных ГП сыворотки крови, а также СРБ у пациентов с сепсисом.
Материал и методы исследования
Сыворотки крови были получены в Медицинском объединении ДВО РАН и Краевой клинической больнице № 1 г. Владивостока. В работе использовали лектины, выделенные нами из морских беспозвоночных: Gal/GalNАc-специфичный лектин из мидии Crenomytilus grayanus (CGL), GlcNАc – специфичный (DTL) и GlcNАc/GalNАc-специфичный (DTL-A) лектины из асцидии Didemnum ternatanum и муцин – специфичный лектин из красной водоросли Tichocarpus crinitus (TCL) [3, 14], а также коммерчески доступные лектины Glc/Man-специфичный из канавалии мечевидной Canavalia ensiformis (Con A) и GlcNАc-специфичный из бобовника альпийского Laburnum alpinum (LAA) (Sigma, USA). Концентрацию СРБ в сыворотках крови определяли методом иммуноферментного анализа (ИФА) с помощью наборов СРБ-ИФА-БЕСТ (высокочувствительный) (Вектор-Бест, Россия). Конъюгаты лектинов с ферментом получали перйодатным методом Накане [13].
Гликозилирование ГП исследовали методом твердофазного лектин-ферментного анализа (ТЛФА). Вкратце, на планшет адсорбировали в трипликатах сыворотки больных и здоровых доноров, свободные места связывания блокировали альбумином, а затем в лунки планшета добавляли лектины, меченные пероксидазой хрена. После добавления субстрата определяли оптическую плотность каждого образца сыворотки на планшетном спектрофотометре μQuant (Bio-Tek Instruments, USA). Результаты обсчитывали в программе Excel. Данные представлены в виде средних значений ± стандартное отклонение (SD).
SDS-электрофорез образцов сыворотки крови проводили по методу Лэммли на установке Jim-X (Китай). В качестве стандартов использовали набор окрашенных рекомбинантных высокоочищенных белков фирмы Thermo Sscientific (США). По окончании электрофореза белки переносили на поливинилиденфторидную (PVDF) мембрану, используя установку для полусухого переноса Jim-X (Китай). Для идентификации полос, соответствующих СРБ, мембрану обрабатывали иммуноглобулинами против СРБ, меченными пероксидазой хрена. Полосы, соответствующие СРБ (без добавления антител), вырезали. Для накопления достаточного для анализа количества СРБ эксперимент повторяли несколько раз. Образцы СРБ гидролизовали 2,5 М ТФУ. Определение нейтральных и аминосахаров проводили методом ГЖХ в виде ацетатов полиолов, как описано ранее [15].
Результаты исследования и их обсуждение
Для определения степени гликозилирования суммарных ГП сыворотки крови были исследованы образцы сывороток пациентов с острым сепсисом различной этиологии (n = 14). Уровень СРБ во всех образцах находился в пределах 133,20–235,02 мкг/мл, что в несколько раз превышало уровень нормальных значений – 0,5 мкг/мл. Методом ТЛФА было изучено взаимодействие ГП с различными лектинами. В качестве контроля использовали сыворотки здоровых доноров (n = 18).
Как видно из рис. 1, связывание лектина Con A с сыворотками пациентов с сепсисом на 26,6 % выше по сравнению с сыворотками доноров. Известно, что при воспалительных процессах в ГП возрастает количество 2-антенных структур по отношению к 3- и 4-антенным [10]. Очевидно, при сепсисе происходит уменьшение разветвленности углеводных структур гликоконъюгатов, что выражается в усилении связывания их с лектином Con A, который избирательно взаимодействует с биантенными структурами.
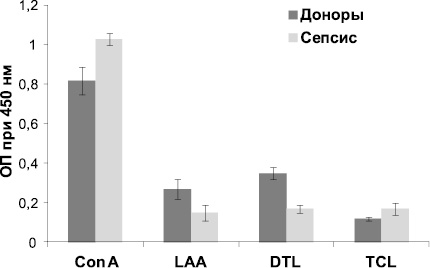
Рис. 1. Взаимодействие лектинов, меченных ферментной меткой, с сыворотками, адсорбированными на полистирольном планшете. Результаты представлены в виде среднего значения оптической плотности ± SD
Известно, что при онкопатологии наблюдается увеличение доли О-гликозилированной структуры типа муцина [7]. Подобное перегликозилирование углеводных цепей, вероятно, происходит и при воспалительном процессе, чем и объясняется способность муцин-специфичного лектина TCL на 41,6 % сильнее связываться с сыворотками больных по сравнению с сыворотками доноров. Заметное уменьшение связывания обнаружено при взаимодействии с GlcNAc-специфичными лектинами DTL и LAA. Показано, что углеводные структуры, в которых присутствует бисектный GlcNAc, составляют примерно 6 % от общего числа гликанов при сепсисе, в то время как в пуле сывороток доноров их содержание достигает 10 % [5]. Ранее было показано, что DTL проявляет сродство именно к биссектному GlcNАc [12], что, вероятно, и приводит к уменьшению связывания на 48,6 % по сравнению с донорскими сыворотками. LAA проявляет сродство к хитобиозным структурам. При сепсисе увеличивается фукозилирование внешних цепей олигосахаридов на 50 % [5], при этом, вероятно, происходит экранирование хитобиозных цепей, что выражается в уменьшении связывания с LAA на 55,6 %. При исследовании взаимодействия лектинов CGL и DTL-A с сыворотками доноров и больных существенного различия не было выявлено. Вероятно, при воспалительных процессах содержание концевых остатков Gal и GalNAс, к которым данные лектины проявляют сродство, в гликоконъюгатах изменяется незначительно.
Для определения степени гликозилирования СРБ у пациентов с сепсисом был использован оригинальный подход, который позволил, не выделяя СРБ в индивидуальном состоянии, определить содержание углеводов и провести их сравнительный анализ. Образцы сывороток больных разделяли электрофоретически, затем методом электроблоттинга белки переносили на PVDF мембрану. Для идентификации полос, соответствующих СРБ, мембрану обрабатывали иммуноглобулинами против СРБ (рис. 2). Определив местоположение полос, соответствующих СРБ, эти полосы вырезали и гидролизовали. Полученные гидролизаты анализировали методами ГЖХ на присутствие нейтральных сахаров и гексозаминов. Сыворотки здоровых доноров не могли быть исследованы в такой постановке, поскольку низкое содержание СРБ в них не позволило провести его идентификацию после электроблоттинга.
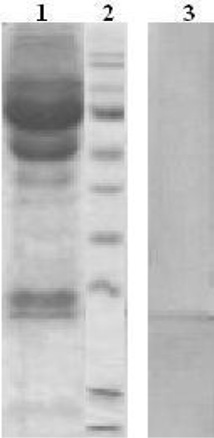
Рис. 2. Электрофоретическое разделение и электроблоттинг образцов сывороток крови:1 – электрофорез сыворотки пациента с сепсисом; 2 – стандартные белки; 3 – электрофоретически разделенная сыворотка пациента с сепсисом после переноса на PVDF мембрану и идентификации полосы, соответствующей СРБ, с помощью иммуноглобулинов против СРБ, меченных ферментной меткой
Как видно из рис. 3, образцы СРБ, выделенные из сыворотки больных сепсисом, содержат моносахариды Man, Glc, Gal, GlcNAc, GalNAc в соотношении 1:5:4:1:2.
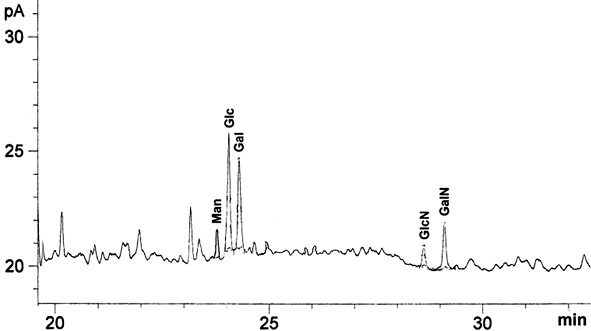
Рис. 3. Анализ углеводного состава СРБ методом ГЖХ
Ранее авторами было показано наличие трех нейтральных моносахаридов: Man, Glc, Gal в образце СРБ, полученном из сыворотки больного туберкулезом [11].
Заключение
Таким образом, в настоящей работе на примере СРБ, выделенного из сывороток больных сепсисом, убедительно показано не только наличие гликозилирования этого острофазного белка, но и определены моносахаридные остатки, входящие в состав его углеводных цепей. Данные результаты могут существенно повысить значимость СРБ как потенциального клинического маркера. Не исключено, что разные модифицированные формы СРБ удастся соотнести с конкретными формами патологий. А определение уровня перегликозилирования ГП цельной сыворотки позволит не только получить сведения об общем состоянии организма, но, возможно, и осуществить первичную дифференциальную диагностику.
Работа выполнена при поддержке гранта ДВО РАН по программе фундаментальных исследований Президиума РАН «Фундаментальные науки – медицине» и программы фундаментальных исследований Президиума РАН «Молекулярная и клеточная биология».
Рецензенты:
Маркелова Е.В., д.м.н., профессор, заведующая кафедрой патологической физиологии, ГОУ ВПО «ТГМУ» Минздрава России, г. Владивосток;
Богданович Л.Н., д.б.н., зам. главного врача по научной работе, заведующая лабораторией инновационных медико-биологических исследований и технологий, МО ДВО РАН, г. Владивосток.
Работа поступила в редакцию 11.04.2013.
Библиографическая ссылка
Чикаловец И.В., Черников О.В., Кондрашина А.С., Горбач В.И., Вахрушева Н.М., Молчанова В.И., Лукьянов П.А. ГЛИКОЗИЛИРОВАНИЕ С-РЕАКТИВНОГО БЕЛКА ПРИ СЕПСИСЕ // Фундаментальные исследования. – 2013. – № 6-2. – С. 328-331;URL: https://fundamental-research.ru/ru/article/view?id=31507 (дата обращения: 20.04.2024).



