Редкоземельные элементы, а также скандий и иттрий (РЗЭ) используют в самых разных областях современной техники: в радиоэлектронике, приборостроении, атомной технике, машиностроении, химической промышленности, в металлургии и т.д. Поэтому в мире имеется устойчивый рост потребления и производства РЗЭ. С целью их удешевления осуществляется развитие традиционных и поиск новых технологических схем переработки сырья, содержащего минералы – бастнезит, монацит, лопарит, а также способов получения высокочистых индивидуальных элементов [6].
Для разделения смеси РЗЭ на индивидуальные компоненты в современной химической технологии используют процессы ионного обмена и экстракции. Однако у современных методов существуют свои недостатки. Так, в случае жидкостной экстракции необходимо учитывать взаимную растворимость водной и органической фаз, приводящую к безвозвратной потере экстрагента, стоимость которого сопоставима с разделяемыми РЗЭ. Процессу ионного обмена присущи низкие коэффициенты разделения РЗЭ, вследствие чего его можно рассматривать лишь как дополнительный к экстракции способ разделения РЗЭ. Поэтому поиск методов разделения РЗЭ до сих пор является актуальной задачей [1].
Зонная перекристаллизация, часто называемая зонной плавкой, применяется для глубокой очистки веществ, получения их в монокристаллическом виде, а также для разделения близких по свойствам элементов [7].
В литературе имеются сведения по распределению РЗЭ в расплавах NH4NO3,NH4SCN, MgCl2, и BaCl2 в которых показано, что соотношение концентраций РЗЭ иттриевой и цериевой группы в процессе зонной перекристаллизации изменяются незначительно [2–4].
В нашей работе мы исследовали разделение хлоридов РЗЭ в процессе зонной перекристаллизации их кристаллогидратов. Такой выбор обусловлен двумя факторами. Во-первых, кристаллогидраты РЗЭ расплавляются полностью без остатка при низкой температуре; во-вторых, соединения содержат молекулы воды, которые могут оказывать влияние на распределение РЗЭ в процессе перекристаллизации.
Таким образом, целью настоящей работы являлось исследование возможности разделения РЗЭ в процессе зонной перекристаллизации их кристаллогидратов.
Материалы и методы исследований
В работе использовали CeCl3·6H2O («ч.д.а.») и HoCl3·6H2O («ч.д.а.»). Их смесь готовили сплавлением в процентном соотношении CeCl3·6H2O:HoCl3·6H2O = 59,5:40,5.
Исследования проводили на образцах длиной 90 мм и диаметром 10 мм. Образцы готовились следующим образом. Кристаллогидраты нагревали до полного расплавления и наполняли ими стеклянную трубку, запаянную с одной стороны.
Опыты проводились на установке, имеющей пять зон нагрева и охлаждения (рис. 1). В качестве нагревательных элементов использовалась нихромовая проволока. Температура зоны расплава поддерживалась в диапазоне 160 ± 1 °С, что обеспечивало расплавление участка соли по высоте слитка от 1 до 1,5 см.
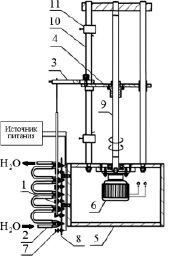
Рис. 1. Установка для ведения процесса зонной перекристаллизации:1 – смесь РЗЭ; 2 –элемент охлаждения; 3 – штанга; 4 – каретка; 5 – корпус; 6 – шаговый электродвигатель; 7 – элемент нагрева; 8 – платформа; 9 – вал; 10 – направляющие; 11 – датчик
Основной частью установки являлась платформа, на которой выставлены на одинаковом расстоянии нагревательные элементы (нихромовая проволока, накрученная в четыре витка) в виде кольца, внутренний диаметр которых соответствует наружному диаметру стеклянной трубки. Температура устанавливалась с использованием импульсного источника питания GWINSTEKPSH-10100. Температура на нагревателях регистрировалась хромель-алюмелевой термопарой. Между нагревателями установлены рукава холодильника, охлаждаемые водопроводной водой, температура которого была +23 °C.
Помещенная на платформу стеклянная трубка со смесью РЗЭ посредствам штанги закреплялась на каретке, скорость движения которой составляла 3 см/ч. После достижения 40 проходов зоны процесс останавливался. После опыта стеклянная трубка обрезалась с концов по 10 мм, образцы сплавленной смеси вынимали, взвешивали и растворяли в дистиллированной воде. В полученных растворах определяли содержания церия и гольмия, а также исследовали растворы с помощью спектрофотометрии. Количественный анализ проводили на атомно-эмиссионном спектрометре марки iCAP 6300 с индуктивно связанной плазмой. Электронные спектры поглощения растворов получали на спектрофотометре Evolution 600 в кварцевых кюветах с толщиной слоя 10 мм.
Результаты исследований и их обсуждение
На рис. 2 представлены электронные спектры поглощения растворенных образцов смеси РЗЭ, полученных после процесса зонной перекристаллизации и исходного образца.
Максимум в электронных спектрах поглощения при 296 нм принадлежит поглощению аква-комплексов хлорида церия, все остальные максимумы принадлежат поглощению аква-комплексов хлорида гольмия [8]. Как видно из рисунка, максимумы, относящиеся к ионам церия, уменьшаются в образцах, удаленных от зоны начальной кристаллизации, а максимумы, относящиеся к ионам гольмия, увеличиваются. Это указывает, что концентрация церия увеличивается в образцах первых частей слитка, а гольмий перемещается вместе с зоной расплава и концентрируется в конечной зоне кристаллизации.
По полученным данным атомно-эмиссионного анализа построена зависимость распределения гольмия и церия по длине слитка после процесса зонной перекристаллизации их хлоридов кристаллогидратов, представленная на рис. 3.
Полученные результаты подтверждают, что первоначальная зона перекристаллизации содержит большие количества легкого церия, а конечная зона более насыщена тяжелым гольмием. Из представленной зависимости также можно сделать вывод о том, что предельного распределения РЗЭ за 40 зон перекристаллизации не происходит.
Для определения коэффициентов численные значения распределений РЗЭ после зонной перекристаллизации сравнивались с исходными концентрациями. Для оценки возможности проведения процессов разделения РЗЭ в процессе зонной перекристаллизации вычислены коэффициенты разделения и обогащения хлоридов гольмия и церия, значения которых представлены в таблице.
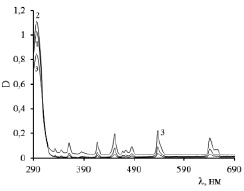
Рис. 2. Электронные спектры поглощения водных растворов образцов смеси хлоридов церия и гольмия:1 – исходный; 2 –образец, полученный на длине слитка 2 см; 3 – образец, полученный на длине слитка 8 см
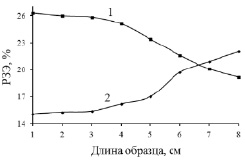
Рис. 3. Распределение в процессе зонной перекристаллизации по длине слитка:1 – церия; 2 – гольмия
Коэффициенты разделения и обогащения гольмия и церия в процессе зонной перекристаллизации
|
Характеристики процесса зонной перекристаллизации |
РЗЭ |
|
|
Ho |
Ce |
|
|
Коэффициент обогащения (β) |
1,311 |
1,155 |
|
Коэффициент разделения (α) |
1,007 |
1,004 |
Значение коэффициента обогащения рассчитывали для крайних зон слитка после зонной перекристаллизации по следующей формуле:
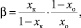 (1)
(1)
где хк – содержание элемента после процесса зонной перекристаллизации в максимально обогащенной зоне, %; хо – исходное содержание элемента, %.
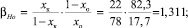
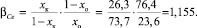
Коэффициент разделения (a) находили из соотношения:
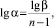 (2)
(2)
где n – число проходов зоны.
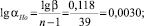
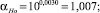
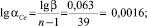
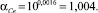
Известно, что если примесь повышает температуру плавления, то при кристаллизации жидкая фаза обедняется этой примесью, если же она понижает температуру плавления, то при кристаллизации жидкая фаза обогащается примесью [7]. Согласно данным работ [10, 11], температура плавления CeCl3·6H2O составляет 403 K, а HoCl3·6H2O – 437 K. Таким образом, изменение концентраций церия и гольмия в процессе зонной перекристаллизации их хлоридов гексагидратов нельзя объяснить различием в их температурах плавления. Известно [10–12], что растворимость легких хлоридов РЗЭ выше, чем тяжелых, поэтому и в этом случае церий должен оставаться в зоне расплава и концентрироваться в конечной зоне кристаллизации. Однако экспериментальные результаты указывают об обратном движении РЗЭ.
Согласно [7], для определения эффективного коэффициента распределения можно использовать выражение Бартона, Прима и Слихтера:
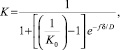
где K0 – равновесный коэффициент распределения; f – скорость роста кристаллов; d – толщина диффузного слоя перед фронтом кристаллизации; D – коэффициент диффузии.
Из уравнения следует, что отличие эффективного коэффициента распределения Kот равновесного коэффициента распределения K0 будет тем сильнее, чем больше коэффициент диффузии D и меньше толщина диффузного слоя d перед фронтом кристаллизации. Большим коэффициентом диффузии и соответственно большей подвижностью обладают хлориды легких РЗЭ и поэтому они должны двигаться с зоной расплава, что также противоречит наблюдаемым экспериментальным данным.
По всей видимости, полученные результаты возможно объяснить, только предположив, что на распределение РЗЭ при перекристаллизации накладывается процесс ионной сольватации (гидратации), которая может сдерживать диффузию гидратированных ионов церия и таким образом способствовать разделению пары церий-гольмий.
Как известно [5], сольватация ионов в растворе определяется характером и соотношением всех видов взаимодействий в растворе ион-ионных, ион-молекулярных и межмолекулярных взаимодействий. Для ионных систем сольватационные вклады оцениваются в результате рассмотрения следующих процессов:
1) образования полости в растворителе (вклад взаимодействий, зависящих от размера иона);
2) перехода в полость незаряженной частицы, изоэлектронной по отношению к иону;
3) перераспределения электронной плотности между ионом и молекулами растворителя (вклад от других взаимодействий, зависящих от заряда иона).
По-видимому, наибольшим вкладом в сдерживание диффузии ионов церия оказывает их взаимодействие с молекулами воды, т.е. химическая составляющая гидратации, а также тот факт, что ион церия имеет меньший собственный размер, чем ион гольмия. Величина гидратной оболочки зависит от плотности заряда иона на его поверхности. Поэтому ионы, имеющие больший собственный размер, имеют меньшую гидратную оболочку[9].
Молекула H2O – является электродонором и осуществляет донорно-акцепторное взаимодействие с ионами церии и гольмия преимущественно по механизму катион – растворитель. При незначительном содержании молекул H2O (как видно из химической формулы в кристаллогидратах хлорида церия и гольмия присутствует шесть молекул H2O) большая их часть будет координироваться к иону церия как иону, способному иметь большую гидратную оболочку. Это в свою очередь должно приводить к уменьшению диффузии гидратированных ионов церия и увеличению диффузии гидратированных ионов гольмия, что подтверждается экспериментально.
Если сделанное предположение верно, то в процессе зонной перекристаллизации должно происходить накопление воды в начальной зоне кристаллизации. В последующих работах планируется определить поведение воды в процессе зонной перекристаллизации кристаллогидратов РЗЭ, осуществить поиск условий, интенсифицирующих процесс разделения РЗЭ методом зонной перекристаллизации, а также провести экспериментальные исследования по разделению многокомпонентных смесей РЗЭ.
Таким образом, полученные данные исследования свидетельствуют о возможности разделения РЗЭ в процессе зонной перекристаллизации их хлоридов кристаллогидратов. Использование солей РЗЭ, имеющих низкую температуру плавления (90–165 °С) в качестве рабочего вещества, позволит получать высокочистых индивидуальных РЗЭ без использования дорогих органических соединений (экстрагентов и ионитов), уменьшить количество водных и водно-органических отходов, что в свою очередь приведет к снижению их стоимости.
Выводы
1. Изучено распределение пары церий-гольмий в процессе зонной перекристаллизации их хлоридов гексагидратов.
2. Исследованный метод может использоваться для глубокой очистки РЗЭ.
Рецензенты:
Дьяченко А.Н., д.т.н., зав. кафедрой «Химическая технология редких, рассеянных и радиоактивных элементов» Физико-технического института Томского политехнического университета, г. Томск;
Жерин И.И., д.х.н., профессор кафедры «Химическая технология редких, рассеянных и радиоактивных элементов» Физико-технического института Томского политехнического университета, г. Томск.
Работа поступила в редакцию 01.07.2013.
Библиографическая ссылка
Акимов Д.В., Егоров Н.Б., Обмуч К.В. РАЗДЕЛЕНИЕ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ МЕТОДОМ ЗОННОЙ ПЕРЕКРИСТАЛЛИЗАЦИИ // Фундаментальные исследования. – 2013. – № 8-3. – С. 529-533;URL: https://fundamental-research.ru/ru/article/view?id=31951 (дата обращения: 19.04.2024).



