Большинство эксплуатационных (каталитических, сорбционных, пигментных) свойств оксидов и гидроксидов металлов связаны с дисперсностью и характеристиками пористой структуры материалов. Влияние таких параметров, как удельная площадь поверхности (Sуд), суммарный объем пор (VS) и условный диаметр пор (dпор) на протекание гетерогенных процессов носит определяющий характер.
Как отмечается многими авторами [3–7], способ получения прекурсоров во многом определяет характер пористой структуры и размер частиц получаемых продуктов. С этих позиций представляет научный и практический интерес исследование характеристик пористой структуры и дисперсности оксидов олова в зависимости от параметров процесса электрохимического синтеза с использованием переменного тока.
Целью настоящей работы является изучение влияния параметров электрохимического синтеза на дисперсность и характеристики пористой структуры оксидов олова.
Материалы и методы исследования
Адсорбционные измерения проводились на комбинированном приборе ASAP 2400 Micromeritics. В качестве газа для определения характеристик пористой структуры использовался азот как общепринятый стандартный адсорбат.
Измерения и расчет удельной площади поверхности образцов проводились в интервале равновесных относительных давлений паров азота р/ро = 0,05–0,33 с помощью метода БЭT (по изотерме адсорбции) [12].
Кривые распределения условного диаметра пор (dпор) по размерам и средние значения основных характеристик пористой структуры высушенных образцов рассчитывались по адсорбционным ветвям изотерм с применением метода, изложенного в работе [11], посредством программного обеспечения к указанному прибору. Перед адсорбционными измерениями образцы прогревались 14–16 часов при остаточном давлении ~ 0,1 Па и температуре, исключающей протекание дегидратационных процессов.
Электронно-микроскопические исследования проводились на микроскопе JEM-100 CX II фирмы JEOL (Япония).
Результаты исследования и их обсуждение
Исследованиями установлено, что характеристики пористой структуры оксидов олова зависят от условий электролиза. В первую очередь это касается изменения плотности переменного тока и концентрации электролита – параметров, оказывающих наибольшее влияние на скорость процессов.
Из табл. 1 следует, что полученные продукты электролиза олова обладают развитой поверхностью. При этом наибольшие значения удельной площади поверхности приходятся на образцы, полученные при электролизе в растворах NaCl с концентрацией от 5 до 15 % мас. Зависимость Sуд от плотности тока (i) при различных концентрациях NaCl приведены на рис. 1.
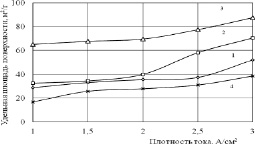
Рис. 1. Зависимость удельной площади поверхности продуктов от плотности тока (концентрация NaCl: 1–3; 2–5; 3–15; 4–25 % мас.)
В табл. 1 приведены значения удельной площади поверхности сухих продуктов электролиза олова, полученных при различных значениях параметров синтеза
Таблица 1
|
Номер образца |
Концентрация хлорида натрия, % |
Плотность тока, А/см² |
Sуд |
Средний размер частиц, нм |
|
|
измеренный по данным ЭМ |
рассчитанный по формуле [5] |
||||
|
1 |
3 |
2,0 |
35,5 |
20 |
24 |
|
2 |
3 |
3,0 |
52,1 |
18 |
16 |
|
3 |
5 |
3,0 |
70,5 |
5 |
12 |
|
4 |
15 |
1,0 |
65,2 |
15 |
13 |
|
5 |
15 |
2,0 |
69,6 |
– |
12 |
|
6 |
20 |
3,0 |
42,0 |
– |
20 |
|
7 |
25 |
2,0 |
27,8 |
– |
31 |
|
8 |
25 |
2,5 |
30,9 |
– |
28 |
|
9 |
3 |
1,0 |
28,7 |
– |
31 |
|
10 |
3 |
1,5 |
33,0 |
– |
27 |
|
11 |
3 |
2,5 |
37,3 |
29 |
25 |
|
12 |
5 |
1,0 |
32,5 |
– |
27 |
|
13 |
5 |
1,5 |
34,4 |
– |
25 |
|
14 |
5 |
2,0 |
39,9 |
– |
21 |
|
15 |
5 |
2,5 |
58,1 |
– |
15 |
|
16 |
10 |
3,0 |
51,1 |
– |
16 |
|
17 |
15 |
1,5 |
67,7 |
– |
12 |
|
18 |
15 |
2,5 |
77,4 |
15 |
11 |
|
19 |
15 |
3,0 |
87,4 |
12 |
10 |
|
20 |
25 |
1,0 |
16,8 |
38 |
52 |
|
21 |
25 |
1,5 |
25,7 |
– |
32 |
|
22 |
25 |
3,0 |
38,3 |
24 |
21 |
Видно, что в ряду продуктов, полученных в растворе NaCl определённой концентрации, с ростом плотности тока в исследуемом интервале значение удельной площади поверхности возрастает. Максимальные значения Sуд характерны для образцов, синтезированных в растворе NaCl с концентрацией 15 % мас. По нашему мнению, это обусловлено большей дефектностью структуры оксидных и гидроксидных слоев, которые образуются в результате конкуренции двух механизмов синтеза [8, 9].
Проведенные электронно-микроскопические исследования показали, что свежие, отмытые от электролита продукты характеризуются ажурными разупорядоченными структурами, напоминающими свитые в косы волокна (рис. 2, а). Высушенные продукты синтеза (рис. 2, б) представляют собой агрегаты различной формы, образовавшиеся в результате разрушения структуры геля, и напоминают фрагменты, содержащие цепи и кольца, которые состоят из частиц с условным диаметром 10–52 нм. Подобные структуры описаны Неймарком [6] для геля гидратированного диоксида титана, полученного методом осаждения. Из микроснимков видно, что принципиального различия в форме частиц нет, однако средний размер частиц продуктов (dчас), полученных в растворах NaCl с концентрацией 3 и 25 % мас., больше, чем для синтезированных в растворе с концентрацией 15 % мас.
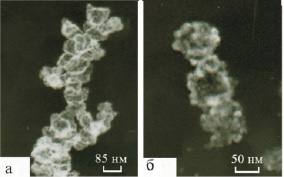
Рис. 2. Электронно-микроскопические снимки продукта электросинтеза, отмытого от электролита (а) и высушенного при 110 °С (б)
Размеры частиц, измеренные методом статистической выборки по данным ЭМА, приведены в табл. 1. Учитывая, что форма частиц гидрогеля оксидов олова, синтезированных методом электролиза с использованием переменного тока, приближается к сферической, можно оценить размер первичных частиц по выражению из [2]. Расчет размера частиц проводился с учетом фазового состава синтезированных продуктов, результаты представлены в табл. 1. Видно, что в основном наблюдается удовлетворительная сходимость измеренных и рассчитанных значений, но имеются отклонения от общих закономерностей.
Известно, что величина удельной площади поверхности и условные диаметры пор получаемых продуктов определяются размерами и формой первичных частиц и условиями образования из них агрегатов. Для пяти образцов были проведены более детальные исследования пористой структуры, результаты которых представлены в табл. 2.
Таблица 2
Параметры пористой структуры синтезированных оксидов олова
|
Номер образца |
Концентрация хлорида натрия, % мас. |
Плотность тока, А/см² |
Sуд, м²/г |
VΣ, см³/г |
Vµ, см³/г |
dпор, нм |
|
2 |
3 |
3,0 |
52,1 |
0,2508 |
0,0069 |
19,2 |
|
3 |
5 |
3,0 |
70,5 |
0,1877 |
0,0006 |
10,6 |
|
4 |
15 |
1,0 |
65,2 |
0,2089 |
0,0012 |
12,8 |
|
8 |
25 |
3,0 |
30,9 |
0,1035 |
0,0044 |
13,3 |
|
20 |
25 |
1,0 |
16,8 |
0,0738 |
0,0033 |
17,5 |
Данные показывают, что полученные продукты обладают значительным суммарным объемом пор от 0,07 до 0,25 см3/г. При этом среднее значение диаметра пор варьируется в небольшом интервале 10–19 нм. Вместе с тем для продуктов, синтезированных в растворах NaCl с концентрациями 5 и 15 % мас., объем микропор (Vm), которые, как правило, вносят наибольший вклад в значения Sуд, в 4–10 раз меньше по сравнению с объёмом микропор образцов, полученных в растворах NaCl с концентрациями 3 и 25 % мас. В то же время площадь удельной поверхности образцов, для получения которых использовались растворы соли средних концентраций, выше, чем образцов, синтезированных в растворах, концентрации которых соответствуют границам выбранного интервала значений.
Примечательно, что за счет более крупнопористой структуры сорбционный объем порошков SnO2, полученных электросинтезом, в 2–3 раза выше, чем для образцов, приготовленных методом осаждения в щелочной среде [1, 2]. Исключение составляют специально синтезированные образцы ксерогелей оксидов олова [1, 10], у которых этот показатель выше за счет преобладания микропористой структуры.
Картину проясняют данные по распределению пор по размерам, приведенные на рис. 3–5. Из гистограмм видно, что для пористой структуры синтезированных образцов характерно преобладание мезопор. Максимальный суммарный объем пор имеет образец 2 (рис. 3), минимальные значения принадлежат продуктам 8 и 20 (рис. 4), полученным в растворах NaCl с концентрацией 25 % мас. Вместе с тем продукты 3 и 4, синтезированные в растворах NaCl с концентрацией 5 и 15 % мас. обладают значительным объемом пор, имеющих условный диаметр менее 5 нм (рис. 5). По-видимому, это обстоятельство обусловливает более высокие значения Sуд для этих продуктов. Рис. 4 также показывает, что продукт 8 имеет больший объем пор, чем продукт 20 вследствие более высокой плотности тока в процессе его синтеза и формирования дефектной структуры в условиях, далеких от равновесия.
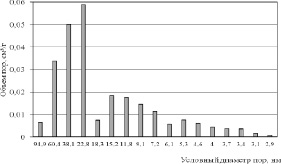
Рис. 3. Распределение пор по размерам образца 2
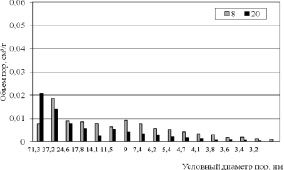
Рис. 4. Распределение пор по размерам образцов 8 и 20
На рис. 6 представлен электронно-микоскопический снимок образца 5, который наглядно иллюстрирует поровое пространство с набором диаметров пор в широком диапазоне. Из снимка видно, что поры формируются при агрегировании наночастиц материала в соответствии с принятым корпускулярным механизмом сложения [7].
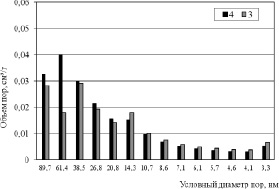
Рис. 5. Распределение пор по размерам образцов 3 и 4
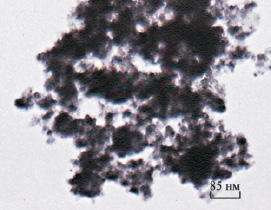
Рис. 6. Электронно-микроскопический снимок образца 5, отмытого от электролита и высушенного при 110 °С
Следует отметить, что продукты, синтезированные при максимальной плотности тока, независимо от концентрации NaCl имеют наибольшую дисперсность. Вместе с тем условия электролиза, при которых достигается максимальная скорость процесса, не гарантируют высокие значения параметров пористой структуры (Sуд и VS).
Заключение
Продукты электрохимического окисления металлического олова с использованием переменного тока характеризуются значениями удельной площади поверхности в интервале 16–87 м2/г, адсорбционным объемом от 0,07 до 0,256 см3/г и незначительным объемом микропор.
Измеренный с помощью электронного микроскопа и рассчитанный по формуле размер частиц полученных оксидов олова варьируется в интервале 10–52 нм.
Наибольшей дисперсностью и удельной площадью поверхности обладают образцы, синтезированные в растворе NaCl с концентрацией 15 % мас. при плотности тока 3 А/см2.
Работа выполнена в рамках государственного задания «Наука» по теме 3.2702.2011.
Рецензенты:
Козик В.В., д.т.н., профессор, заведующий кафедрой неорганической химии Национального исследовательского Томского государственного университета, г. Томск;
Буйновский А.С., д.т.н., профессор Северского технологического института, филиала фгаоу впо «Национальный исследовательский ядерный университет «МИФИ», г. Северск.
Работа поступила в редакцию 01.07.2013.
Библиографическая ссылка
Коробочкин В.В., Балмашнов М.А., Горлушко Д.А., Усольцева Н.В., Долинина А.С. ДИСПЕРСНОСТЬ И ПОРИСТАЯ СТРУКТУРА ОКСИДОВ ОЛОВА, ПОЛУЧЕННЫХ ЭЛЕКТРОХИМИЧЕСКИМ СИНТЕЗОМ С ПОМОЩЬЮ ПЕРЕМЕННОГО ТОКА // Фундаментальные исследования. – 2013. – № 8-3. – С. 634-639;URL: https://fundamental-research.ru/ru/article/view?id=31972 (дата обращения: 20.04.2024).



