В настоящее время одной из основных проблем практической медицины и ветеринарии является преодоление приобретенной лекарственной устойчивости, которая возникает в процессе использования химиотерапевтических препаратов. Одним из перспективных направлений решения данной проблемы является внедрение новых антимикробных средств, полученных путем направленного синтеза химических соединений с заданными биологическими свойствами, поскольку установлена зависимость противомикробной активности препаратов от их химической структуры. Необходимость в новых препаратах также связана с расширением их антимикробного спектра, повышением активности в отношении полирезистентных возбудителей, снижением токсических свойств.
Поскольку поиск химических соединений, обладающих выраженной антимикробной активностью и низкой токсичностью для макроорганизма, является актуальным, представляло интерес изучить антимикробные свойства гетероциклических соединений ряда енаминов, а также их модифицированных аналогов в отношении референс-штаммов и клинических изолятов грамположительных и грамотрицательных бактерий. Выбор соединений ряда енаминов связан с тем, что они являются структурными аналогами противовирусных препаратов. Перечень исследуемых соединений представлен в табл. 1.
На первом этапе работы была изучена антимикробная активность исследуемых соединений. Рабочее разведение препаратов готовили в 0,1 % ДМСО. Соединения А-1, А-3, Т-1 и Т-2 плохо растворялись даже при высокой концентрации ДМСО, и их рабочие разведения представляли собой суспензии, в которых через некоторое время выпадал осадок.
Из всех исследованных соединений наилучшей растворимостью характеризовалось соединений А-2. Антимикробная активность соединения А-2 представлена в табл. 2.
Таблица 1
Перечень гетероциклических соединений ряда енаминов
|
№ п/п |
Лабораторный шифр соединения |
Сокращенное название |
|
1. |
А1 |
Адамантилметилен-аминоциклогексен-дикарбоксилат |
|
2. |
А2 |
Адамантилметилен-циклогексен-дикарбоксилат |
|
3. |
А3 |
Адамантилметилен-енамин |
|
4. |
Т1 |
Тетрагидро[1,2,4]-триазоло[3.4-b]хиназолин |
|
5. |
Т2 |
Триазолохиназолин |
Таблица 2
Антимикробная активность адамантилметилен-циклогексен-дикарбоксилата
|
Концентрация соединения, мкг/мл |
К |
||||||||||
|
100 |
50 |
25 |
12,5 |
6,4 |
3,2 |
1,6 |
0,8 |
0,4 |
0,2 |
||
|
S. aureus 209 P |
– |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
S. aureus № 2 |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
S. aureus № 6 |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
S. aureus № 21 |
– |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
S. aureus № 23 |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
S. aureus № 92 |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
S. aureus № 430 |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
B. cereus 8035 |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
E. coli 113-13 |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
P. aeruginosa АТСС 27853 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
В ходе проведенных исследований было установлено, что МПК соединения А-2 для стандартного штамма S. aureus 209 P и клинического штамма S. aureus № 21 составила 25 мкг/мл, для клинических штаммов S. aureus № 2, S. aureus № 23 – 50 мкг/мл, S. aureus № 92, S. aureus № 430 – 100 мкг/мл. МПК А-2 для B. cereus 8035 – 50 мкг/мл, а для E. coli 113-13 – 100 мкг/мл. Для P. aeruginosa АТСС 27853 не удалось определить МПК А-2, т.к. во всех пробирках наблюдался рост в виде равномерного помутнения со слизистой пленкой на поверхности. При концентрации соединения А-2 100 мкг/мл наблюдалось нарушение пигментации у P. aeruginosa АТСС 27853.
Поскольку ранее нами было установлено, что ПААГ обладает выраженной антимикробной активностью в отношении референс-штаммов и клинических изолятов грамположительных и грамотрицательных бактерий (Вакараева, Нечаева, 2013), представляло интерес изучить биологическую активность структуры «ядро-оболочка», в которой в качестве ядра выступало соединение А-2, вокруг которого путем последовательной адсорбции создавалась полиэлектролитная оболочка 1 % ПААГ. Биологическую активность структур «ядро-оболочка» оценивали с использованием метода серийных разведений. Полученные результаты представлены в табл. 3.
В ходе проведенных исследований установлено повышение биологической активности соединения А-2 после его модификации полимером ПААГ. На рис. 1 представлены диаграммы МПК соединения А-2, а также его модификации ПААГ в виде структуры «ядро-оболочка» в отношении стандартных штаммов грамположительных и грамотрицательных бактерий. Наблюдалось повышение антимикробной активности структуры «ядро-оболочка» в отношении стандартных штаммов S. aureus 209 P в 62 раза, B. cereus 8035 – в 16 раз, E. coli 113-13 – в 2 раза. МПК модифицированного соединения А-2 для P. aeruginosa АТСС 27853 составила 25 мкг/мл, хотя при использовании соединения А-2 в исследуемых концентрациях МПК для синегнойной палочки установить не удалось.
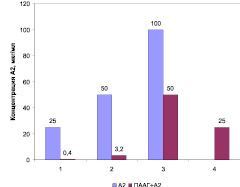
Рис. 1. МПК А-2 и структуры «ядро-оболочка» ПААГ+А-2 в отношении референс-штаммов грамположительных и грамотрицательных бактерий: 1 – S. aureus 209 P; 2 – B. cereus 8035; 3 – E. coli 113-13; 4 – P. aeruginosa АТСС 27853
Таблица 3
Биологическая активность структуры «ядро-оболочка» адамантилметилен-циклогексен-дикарбоксилата, модифицированного ПААГ
|
Концентрация соединения А-2, мкг/мл |
|||||||||||
|
100 |
50 |
25 |
12,5 |
6,4 |
3,2 |
1,6 |
0,8 |
0,4 |
0,2 |
К |
|
|
S. aureus 209 P |
– |
– |
– |
– |
– |
– |
– |
– |
– |
+ |
+ |
|
S. aureus № 2 |
– |
– |
– |
– |
– |
– |
– |
+ |
+ |
+ |
+ |
|
S. aureus № 6 |
– |
– |
– |
– |
– |
– |
– |
+ |
+ |
+ |
+ |
|
S. aureus № 21 |
– |
– |
– |
– |
– |
– |
– |
– |
+ |
+ |
+ |
|
S. aureus № 23 |
– |
– |
– |
– |
– |
– |
– |
– |
+ |
+ |
+ |
|
S. aureus № 92 |
– |
– |
– |
– |
– |
– |
+ |
+ |
+ |
+ |
+ |
|
S. aureus № 430 |
– |
– |
– |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
|
B. cereus 8035 |
– |
– |
– |
– |
– |
– |
+ |
+ |
+ |
+ |
+ |
|
E. coli 113-13 |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
P. aeruginosa АТСС 27853 |
– |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
На рис. 2 представлены диаграммы МПК соединения А-2, а также его модификации ПААГ в виде структуры «ядро-оболочка» в отношении референс-штамма и клинических изолятов золотистого стафилококка. Отмечено повышение антимикробной активности структуры «ядро-оболочка» по сравнению с исходным соединением А-2 в отношении референс-штамма S. aureus 209 P и клинических изолятов S. aureus № 6 и № 23 в 62 раза, S. aureus № 2, № 21 и № 92 – в 32 раза, S. aureus № 430 – в 16 раз.
Помимо этого во всех случаях наблюдался синергидный эффект взаимодействия гетероциклического соединения с полимером, который в итоге приводил к повышению антимикробных свойств ПААГ. Особенно ярко это проявлялось в отношении P. aeruginosa АТСС 27853: происходило увеличение антимикробной активности структуры «ядро-оболочка» по сравнению с ПААГ в 2,5 раза.
В ходе проведенных исследований нами было установлено, что повышение биологической активности структуры «ядро-оболочка» соединения А-2 и ПААГ в большей степени выражено в отношении референс-штаммов и клинических изолятов грамположительных бактерий. Более высокие значения МПК в отношении стандартных штаммов грамотрицательных бактерий, вероятно, связаны с особенностями строения их клеточной стенки.
Таким образом, полученные результаты позволяют нам рассматривать соединение ряда енаминов адамантилметилен-циклогексен-дикарбоксилат в комплексе с ПААГ как перспективный антимикробный препарат, а создание комплексов «ядро-оболочка» на основе гетероциклических соединений и биосовместимых полимеров – эффективными для повышения биологической активности синтетических препаратов.
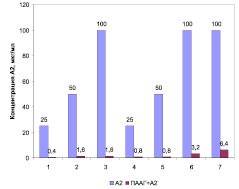
Рис. 2. МПК А-2 и структуры «ядро-оболочка» ПААГ+А-2 в отношении референс-штаммов и клинических изолятов коагулазоположительных стафилококков: 1 – S. aureus 209 P; 2 – S. aureus № 2; 3 – S. aureus № 6; 4 – S. aureus № 21; 5 – S. aureus № 23; 6 – S. aureus № 92; 7 – S. aureus № 430
Рецензенты:
Карпунина Л.В., д.б.н., профессор, зав. кафедрой «Микробиология, вирусология и биотехнология» Саратовского государственного аграрного университета имени Н.И. Вавилова, г. Саратов;
Луцевич И.Н., д.м.н., профессор, заведующий кафедрой гигиены медико-профилактического факультета СГМУ им. В.И. Разумовского, г. Саратов.
Работа поступила в редакцию 30.11.2013.
Библиографическая ссылка
Нечаева О.В., Шуршалова Н.Ф., Заярский Д.А., Тихомирова Е.И., Сорокин В.В., Вакараева М.М., Веденеева Н.В. БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ СОЕДИНЕНИЙ РЯДА ЕНАМИНОВ И ИХ МОДИФИЦИРОВАННЫХ АНАЛОГОВ В ОТНОШЕНИИ РЕФЕРЕНС-ШТАММОВ И КЛИНИЧЕСКИХ ИЗОЛЯТОВ БАКТЕРИЙ // Фундаментальные исследования. – 2013. – № 12-1. – С. 127-130;URL: https://fundamental-research.ru/ru/article/view?id=33050 (дата обращения: 25.04.2024).



