Революционный взгляд на молекулярные механизмы развития живых систем предлагает молодая динамичная наука эпигенетика [12]. По мнению проф. А.М. Вайсермана, эпигенетика – направление генетики, сравнительно недавно осформировалась в самостоятельную область исследований. Одна из наиболее вдохновляющих эпигенетических гипотез о том, что активность многих генов подвержена влиянию извне, сейчас находит подтверждение в экспериментах на модельных животных. Известно, что продолжительность жизни – это мультифакторной признак, а следовательно, на его проявление влияют не только наследственные, но и внешние факторы. Довольно часто они имеют отрицательный эффект.
В условиях современной антропогенной нагрузки становится актуальным изучение особенностей функционирования детоксикационных систем. Процесс биотрансформации, который включает ферментативное превращение инородных включений или ксенобиотиков, делится на три фазы [10, 14, 17, 19]. Первая фаза активации ксенобиотиков или метаболической трансформации заключается в присоединении к ним модифицирующих функциональных групп (–ОН, –SH, –NH2). При этом происходят реакции окисления, восстановления и гидролиза, в результате которых образуются промежуточные метаболиты. Этот процесс катализируется микросомальной ферментативной системой цитохрома Р450 (семья ферментов цитохромов) и некоторыми другими ферментами классов оксидаз, редуктаз, гидролаз и дегидрогеназ. В процессе второй фазы биотрансформации – нейтрализации, промежуточные метаболиты соединяются с эндогенными лигандами, которые усиливают гидрофильную природу этих соединений, тем самым способствуют их выведению из организма. Вторая фаза заключается в конъюгации высокомолекулярных гидрофильных веществ с различными субстратами, в результате чего они превращаются в гидрофильные конъюгаты, способные к экспрессии с желчью. Третья фаза заключается в эвакуации или выведении водорастворимых нетоксичных веществ из организма. Для этого есть специальные переносчики экзогенных соединений – Р-гликопротеины, которые способствуют экскреции ксенобиотиков в желчь или кровь.
Известно, что любой адаптивный или патологический процесс протекает на фоне образования активных форм кислорода [5, 9]. В условиях окислительного стресса активно протекают процессы пероксидации белков, что в конечном итоге приводит к потере их биологической активности, при этом окислительно модифицированные белки генерируют новые антигены и негативно влияют на иммунный ответ [16, 20]. Активные формы кислорода вызывают окислительную модификацию белков (ОМБ) в условиях нормы и патологии. При нормальном функционировании организма поддерживается динамическое равновесие между антиоксидантными и прооксидантными системами. Оксидация белков является нормальным функциональным процессом в организме, с которым связаны жизненно важные функции. Причем последние в значительной степени взаимосвязаны с защитными и адаптационными реакциями организма, а именно в процессе биотрансформации ксенобиотиков. Повышение уровня продуктов ОМБ является результатом нарушения равновесия между процессами, регулирующими синтез и оксидации протеинов, и уменьшение активности протеаз, которые селективно расщепляют оксидированные формы белков. ОМБ может включать прямую фрагментацию белков или вызывать их денатурацию с частичной или полной потерей функций [7]. Такие изменения приводят к снижению адаптационных процессов организма в целом, что способствует развитию патологических состояний. На экспериментальных животных доказано, что старение сопровождается накоплением продуктов окислительной модификации белков в определенных тканях организма [15].
В результате наших предыдущих исследований установлены ассоциации делецийних аллелей генов GSTT 1 и GSTM 1 с продолжительностью жизни. С позиции функциональной геномики крайне важным является определение активности ферментных систем биотрансформации ксенобиотиков, ведь существование функциональных различий между аллелями в пределах одного локуса обусловливают аллельные дифференциации в экспрессии уровня белка, эффективности транспортной функции, активности, термостабильности фермента, иммунного ответа и т.п. Особый интерес принадлежит исследованию этих процессов у долгожителей.
Цель работы – изучение взаимосвязи между ферментативной активностью глутатионовой системы, показателей окислительных модификаций белков в плазме крови и продолжительностью жизни в популяции долгожителей Прикарпатья.
Материалы и методы исследования
Функциональное состояние ферментативной системы детоксикации ксенобиотиков и антиоксидантной защиты изучали по показателям сыворотки крови 60 долгожителей (основная группа) и 30 человек зрелого возраста, в родословных которых не было долгожителей (группа сравнения). Активность глутатион-S-трансферазы (GST) оценивали по скорости образования глутатион-S-конъюгатов между восстановленным глутатиономи 1 – хлор-2, 4 – динитробензола [8]. Активность глутатионредуктазы (GRD) определяли по скорости изменения оптической плотности при 340 нм, обусловленного окисленим НАДФ•Н [2], глутатионпероксидазы (GPO) – по реакции взаимодействия восстановленного глутатиона с гидроперекиситрет-бутила [11]. Продукты окислительной модификации белков (ОМБ) в сыворотке крови исследовали методом А.Ю. Дубининой [6], основанным на взаимодействии окисленных аминокислотных остатков белков с 2,4-динитрофенилгидразином (2,4-ДНФГ). Степень ОМБ оценивали по содержанию альдегидо- и кетонопроизводные белков нейтрального и основного характера. Пробы спектрофотометрирували при длине волн 356, 370, 430 и 530 нм.
Для статистического анализа полученных данных использовали метод программного обеспечения Microsoft Excel.
Результаты исследования и их обсуждение
В результате метаболических превращений веществ в организме человека образуются свободные радикалы, обладающие высокой химической активностью, вызывают процессы пероксидации липидов, белков, нуклеиновых кислот [4]. Возникнув в организме, они вступают во взаимодействие со структурами клетки, приводя в итоге к повреждению клетки, вызывая, таким образом, развитие патологического процесса. Уменьшают повреждающее воздействие свободных радикалов ферменты, обеспечивающие антиоксидантную защиту. К мощным антиоксидантам относится система глутатиона.
При исследовании ферментов глутатионовой системы установлено, что активность GPO в группе долгожителей составила 0,329 ± 0,18 мкмоль/(мин·мг), а в группе сравнения 0,353 ± 0,17 мкмоль/(мин·мг) (таблица). Глутатионпероксидаза – фермент, который принимает участие в инактивации перекиси водорода и органических пероксидов в клетках высших животных и людей. GPO – гликопротеин, имеющий в активном центре четыре атома селена. Он является гидрофильным соединением, что затрудняет его проникновения в липидный слой мембран, основная часть фермента локализована в цитозоле, а другая – в митохондриях. GPO имеет селеновые изоферменты: внеклеточный GPO, обнаруженный в плазме и молоке, GPO-G1, выделенный из цитозоля клеток печении кишечника, а также неселеновый изофермент, идентичен GSТ.
Активность ферментов глутатионовой системы у долгожителей Прикарпатья, М ± m
|
Исследуемые группы |
Активность фермента,мкмоль/(мин · мг) |
||
|
GPO |
GRD |
GST |
|
|
Основная, n = 60 |
0,329 ± 0,18 |
0,219 ± 0,12 * |
0,305 ± 0,31 |
|
Сравнительная, n = 30 |
0,353 ± 0,17 |
0,069 ± 0,05 |
0,345 ± 0,18 |
Примечание.* – Достоверность различий с показателями группы сравнения (р < 0,05).
Результаты исследования функциональной активности генов GPO у мышей показали, что при нокаутном варианте в одном аллельном гене глутатитонпероксидазы имеют нормальний фенотип, нормальную продолжительность жизни [18]. Эти данные указывают на то, что данный фермент не является критическим для жизнедеятельности. Однако у мышей нокаутных по двум копиям и гена, рано развивается катаракта и наблюдаются дефекты в пролиферации вспомогательных мышечных клеток. Однако мыши, нокаутные по гену GPO-G4 (глутатионпероксидазы – 4), погибают в течение раннего эмбрионального развития. Существуют данные о том, что пониженный уровень глутатионпероксидазы – 4 может повышать продолжительность жизни у мышей [3]. Активность GPO в живих клетках увеличивается при действии ионизирующей радиации, акрилонитрила, интоксикации этанолом, при Е-авитаминозе. Особенно важна роль GPO в условиях окислительного стресса, поскольку предупреждает возникновение и развитие процессов пероксидации. GPO является одним из важнейших компонентов ферментативной антиоксидантной системы.
В реакциях, катализируемых GPO, образуется окисленный глутатион (GSSG), для его восстановления в клетках существует специальный фермент – глутатион редуктаза [17]. Не менее важной в системе детоксикации ксенобиотиков является глутатион-S-трансфераза. Основная функция GST – защита клеток от ксенобиотиков и продуктов перекисного окисления посредством их восстановления, присоединения к субстрату молекулы глутатиона или нуклеофильного замещения гидрофобных групп. Проведенные нами исследования показали, что активность GRD и GST у долгожителей составила (0,219 ± 0,12) и (0,305 ± 0,31) мкмоль/(мин·мг) (см. таблицу), в группе сравнения соответственно – (0,069 ± 0,05) и (0,345 ± 0,18) мкмоль/(мин·мг). Таким образом, полученные результаты показывают, что при почти одинаковой активности GST как в исследуемой, так и в группе сравнения активность фермента GRD у долгожителей в 3,17 раза больше чем у лиц зрелого возраста.
Изучив уровень продуктов ОМБ в плазме долгожителей, нами установлено снижение (р < 0,05) альдегидо- и кетонопроизводные нейтрального характера с максимальным поглощением при длине волны 356 и 370 нм до (1,142 ± 0,050), (1,048 ± 0,035) и (1,414 ± 0,176), (1,246 ± 0,098) в группе сравнения (рисунок).
Такая тенденция может свидетельствовать о лучшей регуляции синтеза и меньшей оксидации протеинов у долгожителей, увеличение активности протеаз, селективно расщепляющих оксидированные формы белков. Учитывая, что лица исследуемой и сравнительной групп находились в одинаковых экологических условиях, меньшая интенсификация ОМБ альдегидо- и кетонопроизводных нейтрального характера в долгожителей может указывать на лучшее функционирование защитных протирадикальних систем.
Исследование альдегидо- и кетонопроизводных основного характера показало, что у долгожителей по сравнению с лицами зрелого возраста более высокий уровень этих продуктов в плазме крови, однако эти различия не были статистически значимы (р > 0,05).
Изучение влияния различных токсических соединений на экспериментальных животных, по данным литературы [7], свидетельствует об изменениях уровня альдегидо- и кетонопроизводных основного характера, при этом отмечают, что отклонение 2,4 ДНФГидразонив основного характера менее выраженными.
В ряде исследований проанализирована роль молекулярных маркеров, ассоциированных со скоростью развития процессов старения [16–20]. В частности, вместо теории оксидативного стресса предлагается более универсальная «Зеленая теория старения».
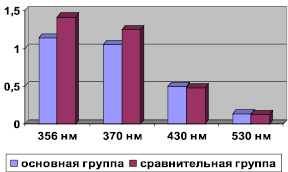
Показатели окислительной модификации белков основной и группы сравнения
Согласно последней, старение рассматривается как результат макромолекулярних нарушений, вызванных действием различных эндогенных и экзогенных веществ и токсичных продуктов метаболизма, включая влияние и оксидативного стресса, и свободных радикалов, а продолжительность жизни определяется скоростью, с которой токсичные вещества удаляются из организма, и эффективностью исправления повреждений.
Выводы
- Выявлено, что активность GPO у всех долгожителей составила (0,329 ± 0,18) мкмоль/(мин·мг), а в группе сравнения (0,353 ± 0,17) мкмоль/(мин·мг).
- Доказано, что активность фермента GRD у долгожителей Прикарпатья в 3,17 раза больше по сравнению с лицами зрелого возраста.
- Установлена тенденция к снижению активности GST у долгожителей (0,305 ± 0,31) мкмоль/(мин·мг) относительно показателей группы сравнения (0,345 ± 0,18) мкмоль/(мин·мг).
- Диагностировано статистически достоверное снижение уровня продуктов ОМБ альдегидо- и кетонопроизводных нейтрального характера в основной группе относительно сравнительной.
- Интенсификация процессов ОМБ у долгожителей сопровождалась увеличением альдегидо- и кетонопроизводных основного характера по сравнению с лицами зрелого возраста.
- Полученные результаты могут свидетельствовать о лучшем функционировании у долгожителей защитных противорадикальных систем по сравнению с лицами зрелого возраста.
Рецензенты:
Ковальчук Л.Е., д.м.н., профессор кафедры медицинской биологии и медицинской генетики, ГВУЗ «Ивано-Франковский национальный медицинский университет», г. Ивано-Франковск;
Булык Р.Е., д.м.н., профессор кафедры медицинской биологии, генетики и фармацевтической ботаники Буковинского государственного медицинского университета, г. Черновцы.
Работа поступила в редакцию 04.02.2014.
Библиографическая ссылка
Козовый Р.В., Эрстенюк Г.М. ПОКАЗАТЕЛИ ОКИСЛИТЕЛЬНОЙ МОДИФИКАЦИИ БЕЛКОВ СЫВОРОТКИ КРОВИ И АКТИВНОСТИ ФЕРМЕНТОВ ГЛУТАТИОНОВОЙ СИСТЕМЫ У ДОЛГОЖИТЕЛЕЙ ПРИКАРПАТЬЯ // Фундаментальные исследования. – 2014. – № 2. – С. 77-81;URL: https://fundamental-research.ru/ru/article/view?id=33549 (дата обращения: 23.04.2024).



