Несмотря на развитие травматологии и ортопедии, полное восстановление костных тканей является проблемным, поскольку большие дефекты не могут спонтанно заживать. Использование стволовых клеток – это регенеративная биология и восстановительная медицина, являющиеся все более расширяющимися областями исследования с надеждой на успех терапевтических методов лечения ран и травм, на которые невозможно эффективно воздействовать современными хирургическими методами [5, 6].
В научной литературе имеется множество данных об эффективности использования прогениторных клеток (мультипотентные мезенхимальные стромальные клетки костномозгового происхождения (АММСККП)), в стоматологии, травматологии и хирургии [1, 5]. Однако полностью отсутствуют результаты исследования лимфатических узлов после указанных способов воздействия на репаративную регенерацию костной ткани, тогда как именно эти органы являются маркером выраженности воспалительного процесса в регионе, по их изменениям можно точно оценивать результативность проведения тех или иных лечебных мероприятий, предсказывать развитие многих осложнений, а значит, и успешно принимать меры по их профилактике.
В связи с вышеизложенным была определена цель исследования: Установить реакции регионарных лимфатических узлов крыс, обусловленные имплантацией АММСККП в регионе лимфосбора.
Материалы и методы исследования
Эксперименты проводили на самцах крыс инбредной линии Wag весом 180–200 г возрастом 6 месяцев. Все манипуляции с животными осуществляли под общим ингаляционным эфирным наркозом в условиях чистой операционной с соблюдением «Правил проведения работ с использованием экспериментальных животных» (Приказ МЗ СССР № 755 от 12 августа 1977 г.; Приказ Министерства высшего и среднего специального образования СССР № 742 от 13 ноября 1984 г.). На каждую точку исследования было использовано не менее 6 крыс (от 6 до 12 особей, всего 62 животных).
Получение и культивирование АММСККП, а также их физические, морфологические, фенотипические признаки и дифференцировочный потенциал соответствовал описанным нами ранее [3, 4]. АММСККП 2 пассажа трансфицировали ДНК плазмиды pЕGFP-N1. Подробный протокол трансфекции и способы оценки экспрессии введенного гена GFP в АММСККП изложены в наших более ранних работах [4].
ПГА (сополимер из 85 % полигидроксибутирата и 15 % гидроксивалериата) в виде матриксов холодного прессования (авторское название) диаметром и высотой 2 мм был предоставлен для исследования Институтом биофизики СО РАН (г. Красноярск). Полимер до адсорбции АММСККП стерилизовали замоченными в забуференном физиологическом растворе для культур клеток в автоклаве при 120 °С, давлении в 1 атмосферу в течение 20 минут. Непосредственно перед внедрением приготовленный для имплантации фрагмент ПГА для пассивной адсорбции клеток погружали в суспензию АММСККП в культуральной среде (1∙106 клеток в 1 мл суспензии) на 2 часа.
Модель дефекта костной ткани в эксперименте [2, 3]. Под общим ингаляционным эфирным наркозом, в условиях чистой операционной, при соблюдении правил асептики и антисептики, после обработки кожи спиртом скальпелем производили разрез кожи длиной 1,5–2 см по нижнему краю нижней челюсти. Тупым способом при помощи распатора отслаивали жевательную мышцу и обнажали поверхность кости нижней челюсти в области ее угла. Стоматологическим бором делали круглое отверстие диаметром 2 мм в кости угла нижней челюсти, с полостью рта дефект кости не сообщался. После внедрения ПГА с адсорбированными АММСККП или без клеток (контроль) послойно ушивали рану викрилом.
Спустя 1, 2, 3, 4 и 5 недель после операции субмандибулярные (регионарные к месту применения АММСККП) лимфатические узлы фиксировали в 4 % растворе параформальдегида на фосфатном буфере (рН 7,4) не менее 24 часов, обезвоживали в серии этанола возрастающей концентрации, просветляли в ксилоле и заключали в парафин. Неокрашенные срезы толщиной 5–7 мкм изучали на световом микроскопе Axioimager M1 (Carl Zeiss, Германия) при увеличении до 1200 раз в режиме люминесценции с фильтром Alexa 488.
Результаты исследования и их обсуждение
Через 1 неделю после имплантации ПГА с адсорбированными АММСККП в дефект нижнечелюстной кости в регионарных (субмандибулярных) лимфатических узлах при исследовании в отраженном ультрафиолетовом свете были найдены овальные скопления ярко светящихся клеток. Эти клетки были очень крупными, до 20 мкм в диаметре, и такие клетки располагались в лимфоидных узелках. Во флюоресцирующих клетках светилась не вся цитоплазма, а разные по размерам овальные гранулы, то есть клетка представляла собой скопление ярко светящихся частиц с четкими ровными краями. Размер этих гранул достигал 10 мкм. Иногда было видно темное овальное ядро (рис. 1, а).
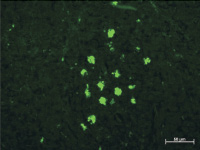 а
а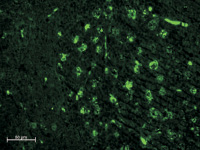 б
б
Рис. 1. Субмандибулярные лимфатические узлы крыс через 1 и 2 недели после имплантации ПГА с адсорбированными АММСККП с трансфицированным геном GFP в дефект кости нижней челюсти. Неокрашенные срезы в отраженном ультрафиолетовом свете с фильтром Alexa 488: а – через 1 неделю после операции в корковом веществе присутствуют овальные скопления ярко светящихся крупных клеток, которые достигают в размере 20 мкм. В их цитоплазме содержатся разные по размерам флюоресцирующие гранулы размером до 10 мкм, иногда видно темное овальное ядро; б – обширные скопления из крупных специфически светящихся клеток расположены в паренхиме коркового вещества спустя 2 недели после имплантации. Ткань овального скопления отличается по плотности и фоновой окраске от окружающих тканей и имеет четкую границу. Кроме того ярко светятся эритроциты во внутриузловых капиллярах
Спустя 2 недели после применения ПГА с АММСККП для воздействия на репарацию поврежденной нижней челюсти в лимфатических узлах количество крупных специфически светящихся клеток увеличилось. Причем увеличилось как число овальных скоплений таких объектов, так и число клеток в них. По-прежнему в таких клетках светилась не вся цитоплазма, а множество различных по размерам гранул (рис. 1, б).
К следующему сроку наблюдения, к 3-й неделе, площадь скоплений крупных светящихся клеток значительно уменьшилась, также сократилось и количество клеточных элементов в них. Но вместе с этим резко возросло число флюоресцирующих клеток, расположенных поодиночке в структурах лимфатических узлов (рис. 2, а).
Этот процесс сокращения размеров скоплений светящихся клеток и числа самих объектов со свечением в них прогрессировал и на 4 и 5 неделях. К этому времени можно отметить неравномерное расположение крупных светящихся клеток в лимфоидных узелках, а выстраивание таких объектов по периферии узелков. Также следует обратить внимание на постепенное уменьшение количества светящихся гранул в указанных крупных клетках (рис. 2, б).
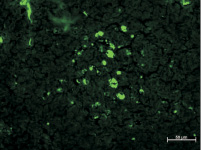 а
а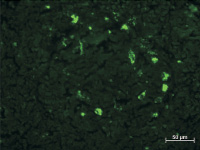 б
б
Рис. 2. Субмандибулярные лимфатические узлы крыс спустя 3 и 4 недели после внедрения ПГА с адсорбированными АММСККП с трансфицированным геном GFP в мандибулярный дефект. Неокрашенные срезы в отраженном ультрафиолетовом свете с фильтром Alexa 488: а – к 3 неделе после имплантации площадь скоплений и число самих светящихся клеток в них значительно уменьшились; б – на 4 неделе в единичных скоплениях только по периферии содержится небольшое число крупных клеток с различными по размерам флюоресцирующими гранулами
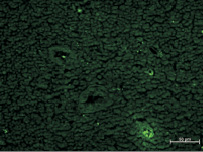
Рис. 3. Поднижнечелюстной лимфатический узел на 3 неделе после внедрения ПГА без АММСККП в участок повреждения нижнечелюстной кости в эксперименте. Неокрашенный срез в отраженном ультрафиолетовом свете с фильтром Alexa 488. Все флюоресцирующие клетки являются эритроцитами, расположенными во внутриузловых сосудах
На рис. 1, 2 четко видно, что ткань овальных скоплений светящихся клеток отличается по плотности и фоновой окраске от окружающих тканей и имеет четкую границу.
Кроме этого, на этих же рис. 1, 2 хорошо видна флюоресценция эритроцитов в сосудах, проходящих рядом со скоплением крупных светящихся клеток и внутри его. Эритроциты, согласно литературным данным, обладают аутофлюоресценцией [8].
В лимфатических узлах животных после применения ПГА без АММСККП светящиеся объекты отсутствовали как поодиночке, так и скоплениями. Иногда были видны единичные небольшие светящиеся объекты (клетки), но это были обладающие аутофлюоресценцией эритроциты во внутриузловых сосудах [8] (рис. 3).
В течение 5 недель после имплантации ПГА с адсорбированными АММСККП с трансфицированным геном GFP в дефект кости нижней челюсти в субмандибулярных лимфатических узлах присутствовали овальные скопления ярко светящихся клеток. Эти клетки были очень крупными, до 20 мкм в диаметре.
Такие клетки с флюоресценцией располагались в лимфоидных узелках, в пользу чего свидетельствует то, что на некоторых препаратах четко видны различия в плотности тканей между скоплениями светящихся клеток и вокруг них, и то, что такие скопления имеют шаровидную форму и расположены только в корковом веществе недалеко от капсулы, то есть в корковом плато, а не в паракортексе и не среди мозговых синусов в мякотных тяжах.
Скорее всего, светящиеся клетки в лимфатических узлах являются макрофагами. Такое заключение сделано на основании нескольких причин:
- Размер клеток. Только очень немногие клетки могут превышать по размеру 20 мкм, и среди таких клеточных элементов – макрофаги.
- Наличие множества разнокалиберных включений, которые, скорее всего, являются лизосомами.
- Неправильная форма клеток.
- Расположение в лимфатических узлах. В лимфатических узлах макрофагов очень много в герминативных центрах лимфоидных узелков, куда они представляют антигены для осуществления иммунных функций и где они фагоцитируют и лизируют клетки с признаками деструктивных изменений, множество которых образуется при делении и дифференцировке В-лимфоцитов.
В таком случае светящиеся разнокалиберные гранулы в макрофагах являются лизосомами с поглощенным флюоресцентным материалом.
Можно сделать предположение, что такие крупные светящиеся клетки в лимфатических узлах являются не просто макрофагами, а макрофагами, которые фагоцитировали введенные АММСККП или структуры, сформированные из таких клеток. В научной литературе имеются данные, указывающие на возможность флюоресценции макрофагов за счет свечения фагоцитированного и метаболизированного материала в их гранулах [7].
Вместе с лимфой в лимфатические узлы поступает и часть введенных АММСККП, тем более, что не все они жизнеспособны. В узлах макрофаги поглощают антигенный материал и, видимо, попавшие туда АММСККП вместе со светящимся белком GFP и их фрагменты. В таких случаях лизосомы макрофагов, в которых находится флюоресцентный белок, могут светиться в отраженном свете так же, как и сами АММСККП с трансфицированным геном GFP.
Таким образом, не исключено создание иммунной защиты против введенных АММСККП с трансфицированным геном GFP или самого светящегося белка. Не исключено, что после повторного введения клеток с трансфицированным геном GFP такие клеточные элементы будут очень быстро уничтожаться системой иммунитета и из них не будет формироваться никаких структур.
Постепенно введенные АММСККП замещаются собственными клетками и структурами. Вследствие того, что структур, построенных из имплантированных АММСККП, становится все меньше, в лимфатических узлах сокращается количество светящихся макрофагов, содержание светящихся гранул в них и интенсивность свечения.
Заключение
После внедрения в участок повреждения кости нижней челюсти ПГА с адсорбированными АММСККП с трансфицированным геном GFP в лимфоидных узелках регионарных лимфатических узлов появляются многочисленные крупные макрофаги с множеством овальных светящихся включений в цитоплазме. Численность таких макрофагов нарастает в течение 2 недель после операции, а далее начинает уменьшаться. Видимо, введенные таким способом АММСККП частично поглощаются макрофагами. При разрушении структур, сформированных из АММСККП, детрит также фагоцитируется макрофагами. В том и другом случае эти макрофаги оказываются в герминативных центрах лимфоидных узелков лимфатических узлов, где не исключена инициация иммунитета против ДНК и белка GFP.
Рецензенты:
Склянов Ю.И., д.м.н., профессор, заведующий кафедрой гистологии, эмбриологии и цитологии педиатрического факультета, ГБОУ ВПО «Новосибирский государственный медицинский университет» Росздрава, г. Новосибирск;
Талалаев С.В., д.м.н., заведующий кафедрой гистологии, ГБОУ ВПО «Алтайский государственный медицинский университет» Минздрава России, г. Барнаул.
Работа поступила в редакцию 10.06.2014.
Библиографическая ссылка
Майбородин И.В., Матвеева В.А., Маслов Р.В., Оноприенко Н.В., Кузнецова И.В., Частикин Г.А. МАКРОФАГИ СО СВЕЧЕНИЕМ В ЛИМФАТИЧЕСКИХ УЗЛАХ ПОСЛЕ ВВЕДЕНИЯ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК С ТРАНСФИЦИРОВАННЫМ ГЕНОМ ФЛУОРЕСЦИРУЮЩЕГО БЕЛКА В ЭКСПЕРИМЕНТЕ // Фундаментальные исследования. – 2014. – № 7-3. – С. 529-533;URL: https://fundamental-research.ru/ru/article/view?id=34478 (дата обращения: 19.04.2024).



