Рак молочной железы (РМЖ) является распространенной патологией среди женщин во всем мире, поэтому предпринимаются попытки поиска новых методов адъювантной терапии, направленных на элиминацию метастазов из региональных лимфатических узлов, в том числе и с использованием веществ, активирующих клетки иммунной системы [4–6]. Известно, что препараты нуклеиновых кислот, применяемые в терапии пациентов с онкологической патологией, способствуют активации противоопухолевой защиты организма опухоленосителя. В то же время нет сведений об их влиянии на клетки опухоли при сочетанной терапии цитостатическими препаратами и экзогенной ДНК.
Поэтому целью исследования стало изучение эффекта фрагментированной ДНК на эффективность цитостатических препаратов in vitro на клетки экспериментального рака молочной железы у крыс линии Wistar.
Материалы и методы исследование
Эксперименты на лабораторных животных проведены в соответствии с «Правилами работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. № 755) и с соблюдением принципов Хельсинкской декларации BMA (2000). Эксперимент выполнен на 25 крысах-самках линии Wistar с массой 300–350 г. Животные содержались на стандартной лабораторной диете и имели свободный доступ к воде. РМЖ у 4 крыс-самок линии Wistar индуцировали введением N-метил-N-нитрозомочевины (Sigma-Aldrich, США) 5 раз с интервалом в 7 дней подкожно в область одной и той же молочной железы (2-я молочная железа справа) [7]. Животных из эксперимента выводили через 6 месяцев под наркозом (40 мг/кг нембутана внутрибрюшинно; Sigma-Aldrich, США). Измельченные ножницами кусочки молочной железы инкубировали при 37 °С с 0,05 % раствором коллагеназы I типа в течение 4 часов. Далее вносили 50 мкл FCS (фетальная телячья сыворотка; HyClone, США), клетки осаждали при 1500 об/мин в течение 5 минут, надосадочную жидкость удаляли и дважды отмывали полученную суспензию клеток молочной железы в 5 мл забуференного физиологического раствора при 1500 об/мин в течение 5 минут. Осадок клеток молочной железы ресуспендировали в питательной среде RPMI 1640 (Биолот, СПб) и пропускали через фильтр (размер пор 80 мкм) для удаления клеточного дебриса, подсчитывали количество жизнеспособных клеток. Клеточный цикл в клетках РМЖ исследовали по стандартной методике с использованием пропидия йодида (Becton Dickinson, США) на проточном цитометре FACSCantoII (Becton Dickinson, США). Морфологическую картину клеток РМЖ, как нативных, так и подвергшихся воздействию лекарственных веществ, оценивали под инвертированным микроскопом Olympus (Япония). Пролиферативный потенциал клеток РМЖ оценивали спектрофотометрически (длина волны 492 нм) по включению 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромида – МТТ (Sigma-Aldrich, США). Интенсивность пролиферативного потенциала изучали через 72 часа в присутствии 5-фторурацила (240 мкг/мл; Ebewe, Австрия), метотрексата (40 мкг/мл; Ebewe, Австрия), циклофосфана (48 мкг/мл; ОАО «Биохимия», Саранск) в отсутствии и присутствии 80 мкг/мл фрагментированной ДНК плаценты человека, а также натрия дезоксирибонуклеата – Деринат (ЗАО «Техномедсервис», Москва) в дозировке 120 мкг/мл. Статистическую обработку данных проводили с использованием программы Statistica 6.0, меры центральной тенденции и рассеяния описаны медианой (Ме), нижним (Lq) и верхним (Hq) квартилями; достоверность различия рассчитывалась по U-критерию Манна – Уитни и принималась при значениях p < 0,05 [3].
Результаты исследования и их обсуждение
Как видно из табл. 1, анализ пролиферативного потенциала клеток РМЖ выявил статистически значимое возрастание спонтанной пролиферации клеток в присутствии фрагментированной ДНК и Дерината. Установлено, что наличие в питательной среде фрагментированной ДНК также способствует статистически значимой активации пролиферации клеток РМЖ в присутствие 5-фторурацила. Более того, инкубация клеток РМЖ с препаратом сравнения для эффекта фрагментированной ДНК – Деринатом, также выявила статистически значимое увеличение пролиферативного потенциала клеток РМЖ в присутствии фрагментированной ДНК. В отношении антипролиферативного действия метотрексата показано статистически значимое возрастание пролиферации клеток рака молочной железы в присутствие как фрагментированной ДНК, так и Дерината. Эффект циклофосфана на пролиферацию клеток РМЖ выражался в статистически значимом снижении ее, как для клеток РМЖ, инкубировавшихся в питательной среде без источников экзогенной ДНК, так и для клеток, инкубировавшихся в питательной среде с экзогенной ДНК. Воздействие комбинации всех цитостатиков на пролиферацию клеток РМЖ привело к статистически значимому возрастанию пролиферативного потенциала при инкубации их с фрагментированной ДНК. При исследовании ингибирования пролиферации клеток РМЖ под воздействием ПХТ были получены следующие результаты (табл. 1). Так, выраженность ингибирующего влияния 5 фторурацила статистически значимо ниже при инкубации клеток РМЖ с фрагментированной ДНК.
Ингибирующий эффект метотрексата был статистически значимо выше только в отсутствие фрагментированной ДНК. Эффект циклофосфана также статистически значимо ниже при инкубации клеток РМЖ с фрагментированной ДНК. Отмечено более выраженное подавление пролиферативного потенциала клеток рака молочной железы in vitro при наличии в среде всех цитостатиков и Дерината по сравнению с аналогичным эффектом фрагментированной ДНК.
Таким образом, наличие экзогенной ДНК в культуре клеток рака молочной железы активирует пролиферативный потенциал и тем самым снижает антипролиферативное действие цитостатических препаратов in vitro.
В основе данного эффекта экзогенной ДНК лежит способность вступать в конкурентную борьбу экзогенного урацила за связывание с 5-фторурацилом, а также отвлекать на себя эффект других цитостатических препаратов и тем самым отменять антипролиферативный эффект лекарственных препаратов.
Более того, полученные данные подтверждаются и результатами исследования клеточного цикла под воздействием цитостатических препаратов (табл. 2).
Так, свежевыделенные клетки РМЖ распределялись по клеточному циклу следующим образом: суб-G0G1 (< 2N) = 35,8 %; G0G1 (2N) = 62,6 %; S (2N) = 0,4 %; G2 + M (4N) = 0,1 %. Клетки РМЖ, инкубировавшиеся с экзогенной ДНК, в большем проценте случаев находились в апоптозе, в них также интенсивнее наблюдались синтетические процессы и выше митотическая активность. В то же время под воздействием цитостатических препаратов процессы апоптоза в клетках РМЖ, инкубировавшихся с экзогенной ДНК, были менее выраженными, чем в контроле.
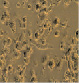
Полученные выше результаты исследования эффекта полихимиотерапии клеток РМЖ в тест-системе in vitro также подтверждаются данными микроскопического исследования. Как видно из рисунка, в присутствии экзогенной ДНК отмечается более выраженное увеличение количества клеток в спонтанном тесте. Кроме этого, наличие экзогенной ДНК в питательной среде способствовало выживанию клеток РМЖ при инкубации их с цитостатическими препаратами.
Таблица 1
Эффект цитостатических препаратов in vitro на пролиферативный потенциал клеток рака молочной железы от крыс линии Wistar, индуцированного введением N-метил-N-нитрозомочевины (Me; Lq-Hq)
|
Параметры |
Уровень пролиферации (в у. ед. опт. пл.) |
|||||
|
исходный |
5-ФУ |
Метотрексат |
Циклофосфан |
ПХТ |
||
|
1 |
Без экзогенной ДНК |
0,12; 0,12–0,13 p1-2 = 0,00031 p1-3 = 0,035 |
0,11; 0,10–0,11 p1-2 = 0,00003 |
0,10; 0,10–0,11 p1-2 = 0,00004 p1-3 = 0,049 |
0,10; 0,10–0,11 p1-2 = 0,00003 p1-3 = 0,039 |
0,10; 0,09–0,10 p1-2 = 0,00003 |
|
Процент ингибиции |
0,0 |
12,17; 9,62–16,48 p1-2 = 0,00003 |
14,26; 9,29–20,35 p1-2 = 0,024 |
14,93; 12,0–17,08 p1-2 = 0,00003 |
19,94; 12,79–34,33 |
|
|
2 |
С добавлением фрДНК |
0,14; 0,14–0,16 |
0,14; 0,14–0,16 p2-3 = 0,0023 |
0,14; 0,13–0,15 |
0,15; 0,14–0,16 p2-3 = 0,0011 |
0,15; 0,14–0,16 p2-3 = 0,00075 |
|
Процент ингибиции |
0,0 |
3,64; –8,73–5,37 p2-3 = 0,00075 |
7,23; 5,96–11,26 |
3,27; –10,21–6,89 p2-3 = 0,00075 |
14,78; 11,19–24,68 |
|
|
3 |
С добавлением Дерината |
0,14; 0,13–0,15 |
0,11; 0,11–0,13 |
0,12; 0,11–0,14 |
0,12; 0,11–0,12 |
0,09; 0,09-0,09 |
|
% ингибиции |
0,0 |
13,03; 10,26–24,24 |
6,87; 5,44–8,59 |
15,24; 13,64-20,0 |
32,98; 25,64–43,87 p2-3 = 0,024 |
|
Примечание. 5ФУ – 5-фторурацил; ПХТ – полихимиотерапия; фрДНК – пролиферация при наличии фрагментированной ДНК.
Таблица 2
Показатели нахождения клеток РМЖ в фазах клеточного цикла (в %)
|
Параметры |
Клетки РМЖ (1) |
Клетки РМЖ + фрагментированная ДНК (2) |
Клетки РМЖ + Деринат (3) |
|||||||||
|
суб-G0 G1 |
G0G1 |
S |
G2 + M |
суб-G0G1 |
G0G1 |
S |
G2 + M |
суб-G0G1 |
G0G1 |
S |
G2 + M |
|
|
инт |
31,2 |
67,6 |
0,3 |
0,0 |
38,3 |
60,8 |
0,6 |
0,1 |
36,0 |
63,2 |
1,0 |
0,1 |
|
5ФУ |
32,5 |
65,8 |
0,6 |
0,0 |
31,5 |
67,3 |
0,7 |
0,0 |
29,7 |
69,5 |
0,9 |
0,0 |
|
Мет |
37,5 |
62,2 |
0,5 |
0,0 |
31,3 |
67,5 |
0,7 |
0,1 |
27,5 |
71,8 |
0,7 |
0,1 |
|
ЦФ |
32,6 |
67,0 |
0,5 |
0,0 |
29,5 |
69,8 |
0,7 |
0,0 |
27,8 |
71,5 |
0,9 |
0,0 |
|
ПХТ |
31,6 |
68,0 |
0,4 |
0,1 |
31,0 |
68,4 |
0,9 |
0,1 |
25,0 |
73,5 |
0,7 |
0,1 |
Примечание. инт – интактные; РМЖ – рак молочной железы; 5ФУ – 5-фторурацил; Мет – метотрексат; ЦФ – циклофосфан; ПХТ – полихимиотерапия.
Контроль
 Спонтанная
Спонтанная 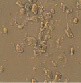 5ФУ
5ФУ  Мет
Мет ЦФ
ЦФ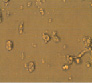 ПХТ
ПХТ
Фрагментированная ДНК
 Спонтанная
Спонтанная 5ФУ
5ФУ  Мет
Мет  ЦФ
ЦФ  ПХТ
ПХТ
Деринат
 Спонтанная
Спонтанная 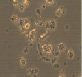 5ФУ
5ФУ  Мет
Мет  ЦФ
ЦФ  ПХТ
ПХТ
Микрофотографии клеток рака молочной железы в присутствии экзогенной ДНЕ и цитостатиков (х400). 5ФУ – 5-фторурацил; Мет – метотрексат; ЦФ – циклофосфан; ПХТ – полихимиотерапия
Нами показано, что наличие в питательной среде фрагментированной ДНК для свежевыделенных клеток РМЖ in vitro приводило к повышению пролиферативной активности клеток опухоли, снижению чувствительности к действию цитостатиков, как при их отдельной инкубации, так и при комбинации всех 3 лекарственных препаратов с клетками опухоли по сравнению с контролем и в большинстве случаев с препаратом сравнения по экзогенной ДНК (Панаген). Что не противоречит имеющимся литературным данным о включении во внутренние компартменты опухолевых клеток фрагментов ДНК [1–2]. Известно, что максимальным цитостатическим эффектом циклофосфана являются его метаболиты, получаемые в организме после обработки микросомальными ферментами гепатоцитов. Однако известно, что и сам циклофосфан без in vitro способен оказывать антипролиферативное действие на пролиферацию, как спонтанную, так и митоген-индуцированную лимфоцитов человека [8]. Поэтому выявленные нами антипролиферативные эффекты циклофосфана имеют под собой литературное обоснование, хотя и противоречат сложившемуся в среде ученых и врачей мнению об отсутствии у нативного циклофосфана антипролиферативного эффекта. Более того, мы полагаем, что наличие экзогенной ДНК в данной модели указывает на возможность отмены ингибирующего эффекта цитостатиков на клетки опухоли за счет конкурентного взаимодействия во внешней среде препаратов с фрагментами ДНК и тем самым резкого снижения цитостатического действия препаратов. Иными словами, наличие фрагментированной ДНК является источником урацила для опухолевых клеток, с одной стороны, а с другой стороны, процессы метилирования, вероятнее всего, быстрее происходят во фрагментированной ДНК, нежели в клетках опухоли.
Заключение
Таким образом, исходя из вышеизложенного, становится очевидным тот факт, что наличие в питательной среде экзогенной ДНК приводит к уменьшению выраженности цитостатического влияния препаратов, применяющихся для полихимиотерапии при РМЖ, с одной стороны. С другой стороны, экзогенная ДНК способствует активации пролиферации клеток РМЖ.
Выражаем благодарность за техническую и организационную помощь в проведении экспериментов Алямкиной Е.А., Долговой Е.В., Рогачеву В.А. и Богачеву С.С., сотрудникам ИЦИГа.
Рецензенты:
Бгатова Н.П., д.б.н., зав. лабораторией ультраструктурных исследований, ФГБУ «НИИКЭЛ» СО РАМН, г. Новосибирск;
Горчаков В.Н., д.м.н., зав. лабораторией функциональной морфологии лимфатической системы, ФГБУ «НИИКЭЛ» СО РАМН, г. Новосибирск.
Работа поступила в редакцию 04.06.2014.
Библиографическая ссылка
Лыков А.П., Бондаренко Н.А., Повещенко О.В., Кабаков А.В., Райтер Т.В., Казаков О.В., Стрункин Д.Н., Повещенко А.Ф., Коненков В.И. ОТМЕНА АНТИПРОЛИФЕРАТИВНОГО ДЕЙСТВИЯ ЦИТОСТАТИЧЕСКИХ ПРЕПАРАТОВ ЭКЗОГЕННОЙ ДНК НА КЛЕТКИ ЭКСПЕРИМЕНТАЛЬНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ У КРЫС ЛИНИИ WISTAR // Фундаментальные исследования. – 2014. – № 8-4. – С. 881-885;URL: https://fundamental-research.ru/ru/article/view?id=34688 (дата обращения: 16.04.2024).



