Рак молочной железы (РМЖ) занимает первое место в структуре заболеваемости и смертности от злокачественных новообразований у женщин во всём мире. В России отмечается неуклонный прирост заболеваемости. За последние 10 лет он составил около 27 %. В структуре смертности женщин от злокачественных новообразований в России в 2011 году РМЖ занимал лидирующее место (17,3 %) [9]. В связи с этим не теряет своей актуальности поиск новых методов лечения данной онкологической патологии. Обязательным компонентом комплексного лечения местно-распространенного РМЖ, органосохраняющего лечения, является предоперационная системная полихимиотерапия (ПХТ) [8]. Наиболее эффективными остаются антрациклин-содержащие режимы, преимущественно режим FAC (5-фторурацил + доксорубицин + циклофосфамид), и режим РА (паклитаксел + доксорубицин) [7]. Но достижение максимального противоопухолевого эффекта ограничено дозолимитирующей системной токсичностью цитостатиков. Для повышения эффективности химиотерапии больных РМЖ использовались методы введения химиопрепаратов на естественных средах организма (крови, лимфе, костном мозге) [1, 2]. В настоящее время достигнуты успехи в исследовании иммунопатологии и иммунотерапии онкологических заболеваний, в том числе РМЖ. Получены данные о том, что опухоли молочной железы развиваются на основе выраженных нарушений иммунной системы, возникающих уже при предопухолевых заболеваниях, определяются распространенностью опухолевого процесса и усугубляются применяемым лечебным воздействием (операцией, облучением, химиотерапией, гормонотерапией). Эти данные и сведения о более благоприятном течении заболевания при сохраненном иммунитете побуждают многих исследователей к дальнейшему изучению состояния иммунной системы и разработке на этой основе более эффективных схем лечения больных РМЖ с включением иммунотерапии. Распространению и внедрению методов иммунотерапии способствует их физиологичность. Если в основу химиотерапии изначально заложено токсическое воздействие на здоровые и больные клетки, то при иммунотерапии эффект осуществляется посредством активации собственных механизмов защиты организма [3]. Сочетание химиотерапии с иммунотропными веществами может значительно снижать токсический и иммуносупрессивный эффект противоопухолевых препаратов [11]. К настоящему времени накоплен достаточно большой опыт клинического применения таких классических иммунокорригирующих лекарств, как полиоксидоний, имунофан, а также цитокиновых препаратов, среди которых альфа-2-интерферон [6]. Значительно менее известен клиницистам новый отечественный препарат Рефнот, который представляет собой уникальное соединение – гибридную молекулу двух биологически активных агентов – цитокина фактора некроза опухолей (ФНО) и гормона тимозина. Препарат обладает прямым противоопухолевым действием in vitro на различных линиях опухолевых клеток и in vivo. По спектру цитотоксического и цитостатического действия на опухолевые клетки препарат соответствует ФНО человека, однако Рефнот имеет в 100 раз меньшую общую токсичность, чем ФНО, обладает способностью угнетать ангиогенез в противоположность ФНО, сохраняя при этом способность повышать проницаемость эндотелия сосудов, запускать процесс апоптоза опухолевых клеток, активировать каскад химических реакций коагуляционной системы крови (рис. 1) [10, 5].
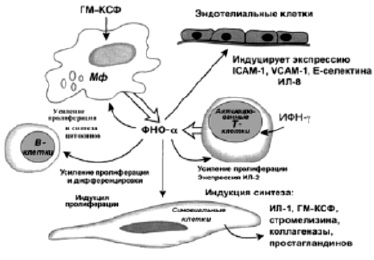
Рис. 1. Схема биологических эффектов ФНО-α на различные клетки [5]
Благодаря входящему в состав ФНО-Т тимозину-α1 Рефнот способен оказывать воздействие на Т–клеточное звено иммунной системы, которое играет ключевую роль в противоопухолевом иммунитете, а также участвует в реакциях гуморального иммунитета, т.к. для продукции антител к большинству антигенов В-клеткам необходимо взаимодействие с Т-клетками-хелперами (CD4+) [4].
В отличие от стандартного подкожного метода введения Рефнота нами было предложено вводить рекомбинантный ФНО-Т перитуморально, в связи с тем что, проанализировав механизмы действия препарата, мы предполагали получить более выраженный эффект, максимально воздействуя непосредственно на зону опухоли и перитуморальной ткани, местный иммунитет. По данным литературы [10] после инъекции Рефнота в течение суток вокруг опухоли развивается местная воспалительная реакция, которая внешне проявляется в виде очага гиперемии, слегка болезненного, без инфильтрации в месте введения препарата, благодаря чему непосредственно рядом с опухолью увеличивается интенсивность кровотока и облегчается доставка вводимых системно химиопрепаратов к опухолевому очагу. Помимо этого, под воздействием рекомбинантного ФНО-Т происходит активация как общего, так и местного иммунитета (прежде всего активируются макрофаги, цитотоксичность которых тесно связана с наличием молекул ФНО на их поверхности, а процесс созревания/активации этих клеток связан с ответом на Рефнот). Доказано также непосредственное воздействие рекомбинантного ФНО-Т на опухолевую клетку-мишень через соответствующие рецепторы на её поверхности со всеми процессами, запускаемыми внутри клетки, конечным результатом которых является апоптоз клетки (цитотоксическое действие) или арест клеточного цикла (цитостатическое действие). Кроме того, инициируется каскад химических реакций, включающий активацию коагуляционной системы крови и местных воспалительных реакций, обусловленных ФНО-Т-активированными клетками эндотелия и лимфоцитами, и ведущий к так называемому «геморрагическому» некрозу опухоли [10].
Целью настоящего исследования являлось изучение влияния Рефнота на эффективность химиотерапии у больных местно-распространенным РМЖ, частоту и выраженность побочных явлений, а также оценка динамики некоторых показателей иммунного статуса.
Материалы и методы исследования
Исследование проводилось на базе отделения химиотерапии № 1 ФГБУ «РНИОИ» МЗ РФ. Основными критериями включения больных РМЖ IIB-IIIB стадии были: ECOG ≤ 1, нормальные показатели общеклинических исследований, отсутствие отдаленных метастазов. За период с апреля 2012 года по октябрь 2013 года в исследование было включено 56 больных местно-распространенным РМЖ IIB-IIIB стадии, в возрасте от 29 до 70 лет; средний возраст 53,3 ± 1,1 лет. В основную группу вошли 25 пациенток, которым проводилась системная неоадъювантная ПХТ в режиме FAC (5-фторурацил 500 мг/м2 + доксорубицин 50 мг/м2 + циклофосфан 500 мг/м2; интервал между курсами 21 день) или в режиме РА (паклитаксел 175 мг/м2 + доксорубицин 50 мг/м2; интервал между курсами 21 день) в комбинации с перитуморальным введением рекомбинантного ФНО-Т по 200000 МЕ в 1-е сутки (за 30 минут до введения цитостатиков) и далее 1 раз в день во 2–5-е сутки каждого курса ПХТ. В контрольной группе наблюдалась 31 пациентка, которым проводилась стандартная неоадъювантная ПХТ в тех же режимах, но без Рефнота. Перед началом лечения и после его завершения пациенткам выполнялся комплекс обследований, включающий: объективный осмотр, клинические анализы крови и мочи, маммографию молочных желез, компьютерную томографию органов грудной клетки и брюшной полости, трепан-биопсию опухоли с последующим морфологическим и иммуногистохимическим исследованием биоптата, оценку некоторых показателей иммунного статуса. Распределение больных основной и контрольной групп по стадиям РМЖ и менструальной функции представлено в табл. 1. Основная и контрольная группы больных по стадиям заболевания и по характеристикам менструальной функции были сопоставимы.
Таблица 1
Клиническая характеристика больных основной и контрольной групп
|
Группы больных |
Стадия |
Менструальная функция |
||||||
|
IIB |
IIIA |
IIIВ |
IIIС |
Сохранена |
Менопауза (годы) |
|||
|
1–5 |
5–10 |
> 10 |
||||||
|
Основная (кол-во, %) |
4 16 % |
9 36 % |
7 28 % |
5 20 % |
11 44 % |
6 24 % |
4 16 % |
4 16 % |
|
Контрольная (кол-во, %) |
6 19,3 % |
9 29,0 % |
10 32,2 % |
6 19,3 % |
12 38,7 % |
4 12,9 % |
11 35 % |
4 16,9 % |
Иммуногистохимические особенности РМЖ больных основной и контрольной групп свидетельствуют о незначительном превалировании менее благоприятных форм среди больных основной группы (табл. 2).
В основной группе 17 пациенткам было проведено 49 курсов ПХТ по схеме PA, 8 больным – 14 курсов по семе FAC, от 2 до 4 курсов ПХТ каждой пациентке. В группе контроля 21 больной было проведено 72 курса неоадъювантной ПХТ по PA схеме, а 10 пациенткам – 42 курса по FAC схеме, от 2 до 6 курсов каждой больной.
Результаты исследования и их обсуждение
В основной группе объективный эффект наблюдался чаще, чем в контрольной группе (80 % (20 больных) и 70,9 % (21 больная) соответственно; p = 0,06), в том числе и за счет увеличения частоты полных регрессов: 20 % (5 больных) против 6,4 % (2 больных) (рис. 2). Стабилизация была отмечена у 20 % (5 больных) в группе с применением Рефнота и у 22,6 % (7 больных) в группе с использованием стандартной ПХТ без Рефнота. Прогрессирование заболевания на этапе неоадъювантной терапии было выявлено у 9,7 % (3) больных группы контроля, двум из них в связи с этим хирургический этап лечения выполнить не удалось; в основной группе случаев прогрессирования не наблюдалось.
Таблица 2
Иммуногистохимическая характеристика опухолей больных основной и контрольной групп
|
Группы больных |
Люминальный А |
Люминальный В (HER-2–) |
Люминальный В (HER-2+) |
Erb-B2-сверхэкспрессирующий |
Базально-подобный |
|
Основная (кол-во, %) |
2 8 % |
10 40 % |
3 12 % |
6 24 % |
2 8 % |
|
Контрольная (кол-во, %) |
5 16,1 % |
14 45,2 % |
3 9,7 % |
6 19,3 % |
2 6,4 % |
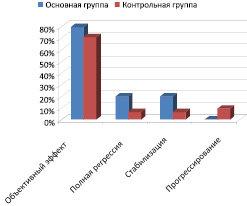
Рис. 2. Характеристика клинического эффекта неоадъювантного лечения у больных основной и контрольной групп
В основной группе больных наблюдались побочные эффекты низкой и средней степени выраженности (рис. 3): 15,9 % (10) курсов сопровождались нейтропенией 1–2 степени, фебрильных нейтропений не было; 10 % (6) – анемий 1–2 степени; 27,2 % (17) курсов (р = 0,08) – тошнотой и рвотой 1–2 степени; 9,5 % (6) курсов (р = 0,07) – полинейропатией 1–2 степени. Выявлены специфические для Рефнота побочные явления: у всех больных основной группы отмечалась реакция на его введение в виде очага гиперемии 0–1 степени, слегка болезненного, без инфильтрации в месте введения препарата; а также у 4 (16 %) пациенток отмечалось повышение температуры тела от 37,2 до 37,8 °С через 6–12 часов после введения Рефнота со снижением до нормальной температуры в течение 24 часов без применения жаропонижающих средств. Местная реакция возникала, как правило, через 6–12 часов после введения препарата, а продолжительность ее варьировала от 24 часов (на 1–2 курсе ПХТ) до 48 часов (при последующих курсах ПХТ). По интенсивности данные нежелательные явления расценивались как слабые, т.е. не нарушали повседневной активности больных, легко переносились. В группе контроля нейтропения 1–2 степени отмечалась в 21 % (24) курсов, анемия 1–2 степени – в 12,3 % (14) курсов; тошнота и рвота 1–2 степени – 32,4 % (37), полинейропатия 1–2 степени – 11,4 % (13), диарея 1 степени – 4,4 % (5), стоматит 1–2 степени – 1,8 % (2).
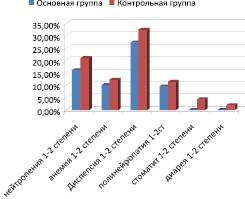
Рис. 3. Характеристика побочных реакций неоадюъвантного лечения у больных основной и контрольной групп
Все пациентки основной группы были прооперированы, никаких послеоперационных осложнений, связанных с использованием Рефнота, не наблюдалось. В настоящее время выживаемость больных в основной группе составила 100 %, в группе контроля – 93,5 %; выживаемость без прогрессирования в группе с применением Рефнота – 80 %, в группе сравнения – 74,2 %.
Результаты оценки иммунного статуса продемонстрировали, что при проведении неоадъювантных курсов лечения уровни Т-лимфоцитов и СD3+ СD4+ клеток не имеют статистически значимых различий ни при сравнении основной и контрольной групп, ни в динамике лечения. Обнаружены некоторые различия в зависимости от использования Рефнота с различными схемами ПХТ. Так, количество СD3+ СD8+ клеток после применения лечения по схеме РА + Рефнот оказалось статистически значимо выше, чем в контрольной группе, получавшей только РА без Рефнота (31,5 ± 2,8 и 21,7 ± 2,25 % соответственно, р < 0,05); при применении в лечении FAC + Рефнот подобных различий не выявлено. Содержание В-клеток с маркером СD20 + при использовании обеих схем ПХТ снижалось в динамике лечения у больных контрольной группы при использовании схемы FAC (с 15,5 ± 0,53 до 13,7 ± 0,55 % и при использовании PA с 16,7 ± 0,97 до 12,7 ± 1,0 % (р < 0,05). Применение Рефнота в комплексе с обоими вариантами ПХТ защитило от этого отрицательного действия В-клеточное звено иммунной системы больных. Так, у больных основной группы, получавших РА + Рефнот, уровень В-лимфоцитов после лечения составил 15,0 ± 1,0 %, а у получавших FAC + Рефнот 15,4 ± 1,4 %; в обоих случаях отличия от показателей больных контрольной группы статистически достоверны (р < 0,05).
Выводы
Перитуморальное применение рекомбинантного ФНО-Т (Рефнота) обладает хорошей переносимостью, позволяет увеличить эффективность терапии больных местно-распространенным РМЖ, снизить частоту и степень выраженности системных побочных реакций, сократить сроки предоперационной терапии, а также демонстрирует иммунокорригирующее действие. Представляется целесообразным его применение в качестве терапии сопровождения при проведении неоадъювантной ПХТ у таких больных.
Рецензенты:
Шихлярова А.И., д.б.н., профессор, главный научный сотрудник Южного научного центра РАН, г. Ростов-на-Дону;
Ващенко Л.Н., д.м.н., профессор, заведующая отделением опухолей мягких тканей, костей и молочной железы, ФГБУ «РНИОИ» МЗ РФ, г. Ростов-на-Дону.
Работа поступила в редакцию 29.07.2014.
Библиографическая ссылка
Владимирова Л.Ю., Подзорова Н.А., Златник Е.Ю., Закора Г.И., Бахтин А.В., Мягкова В.С. ОПЫТ ПЕРИТУМОРАЛЬНОГО ПРИМЕНЕНИЯ РЕКОМБИНАНТНОГО ФАКТОРА НЕКРОЗА ОПУХОЛИ – ТИМОЗИНА-α1 ПРИ МЕСТНО-РАСПРОСТРАНЕННОМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ IIB-IIIB СТАДИИ // Фундаментальные исследования. – 2014. – № 7-5. – С. 921-926;URL: https://fundamental-research.ru/ru/article/view?id=34801 (дата обращения: 16.04.2024).



