Значимость эндотоксикоза в патогенезе широкого профиля заболеваний не вызывает сомнений у клиницистов [3, 4]. Выраженность эндогенной интоксикации влияет на тяжесть заболевания и играет важную прогностическую роль [5]. Неизбежно сопровождающая эндотоксемию гипоксия системного и локального характера приводит к нарушению функции органоидов клеток, органов и целостного организма [1, 2].
Отличительной особенностью головного мозга является низкая устойчивость нейронов к гипоксии, высокая интенсивность метаболических процессов, высокая концентрация липидов, подвергающихся окислению, недостаточная компетентность системы собственной антиоксидантной защиты органа [6].
Рациональным представляется применение в составе комплексной терапии препаратов с антиоксидантным типом действия для эффективной защиты головного мозга от повреждения эндотоксинами.
Цель работы – изучить фармакологические эффекты производного 3-оксипиридина – этоксидола – на липидный метаболизм в церебральной ткани при синдроме эндогенной интоксикации, вызванном острым перитонитом.
Материалы и методы исследования
Проведены экспериментальные исследования на взрослых беспородных собаках (n = 46). С целью воспроизведения выраженной эндогенной интоксикации была использована модель экспериментального перитонита по способу А.П. Власова (1991). Под тиопентал-натриевым наркозом в брюшную полость животных вводили шприцем 20 % каловую взвесь (0,5 мл на 1 кг массы тела). Через сутки после санации брюшной полости применялась стандартная инфузионная и антибактериальная терапия (внутримышечные инъекции 2 раза в сутки раствора гентамицина из расчета 0,8 мг/кг массы тела; внутривенно 1 раз в сутки 5 % раствор глюкозы и 0,89 % раствор хлорида натрия из расчета 50 мл/кг). Эксперименты проводились согласно требованиям к работе с экспериментальными животными («Правила проведения работ с использованием экспериментальных животных» (приказ МЗ СССР № 755 от 12.08.1987 г.), Федеральный закон «О защите животных от жестокого обращения» от 01.01.1997 г., приказ МЗ РФ от 19.06.2003 г. № 267 «Об утверждении правил лабораторной практики»), одобрены локальным этическим комитетом.
Животных рандомизировали на две равные группы. На 1-е, 3-и, 5-е сутки фиксировали выраженность эндогенной интоксикации, показатели липопероксидации и липидного метаболизма в церебральной ткани. В состав комплексной терапии в опытной группе животных также были включены внутривенные инъекции 5 % раствора этоксидола из расчета 10 мг на 1 кг массы тела.
Результаты исследования и их обсуждение
Моделирование острого экспериментального перитонита приводило к значительному увеличению титра эндогенных токсических субстанций в плазме крови. Содержание гидрофильного компонента эндотоксикоза – молекул средней массы (l = 254 и l = 280 нм) было выше физиологических значений на 77,04–136,54 и 54,66–137,05 % соответственно (р < 0,05). Зафиксировано статистически значимое снижение как общей (на 18,96–30,73 %), так и эффективной концентрации альбумина (на 34,11–52,60 %) (р < 0,05). Закономерно снижался резерв связывания альбумина – на 21,21–50,00 % (р < 0,05) относительно исходных данных. Индекс токсичности плазмы крови в контрольной группе достоверно увеличивался в 1,58–3,36 раза по сравнению с нормой (р < 0,05) (рис. 1).
В ходе исследования отмечалось значительное повышение концентрации продуктов липопероксидации. Так, зафиксирован статистически значимый рост на 28,14–188,33 % титра спонтанного, на 21,35–72,99 % – титра малонового диальдегида (р < 0,05). Ферментативная активность фосфолипазы А2 была достоверно выше исходных значений на 92,31–117,95 % (р < 0,05). Энзимный потенциал супероксиддисмутазы уменьшался на 31,90–59,05 % (р < 0,05) относительно физиологических значений исследуемого показателя, что свидетельствовало о снижении потенциала собственной антиоксидантной системы защиты.
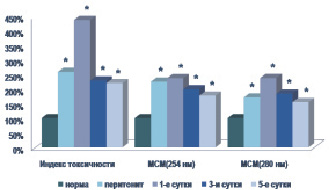
Рис. 1. Содержание токсических продуктов в плазме крови при остром экспериментальном перитоните. Примечание. * – достоверность отличия по отношению к исходу при p < 0,05
Синдром эндогенной интоксикации существенно изменял состав липидов биомембран в ткани головного мозга. Оценка полученных в ходе исследования результатов позволяет сделать следующие выводы: на фоне эндотоксемии достоверно повышался удельный вес лизоформ фосфолипидов и свободных жирных кислот, уменьшалась концентрация суммарных фосфолипидов, фосфатидилхолина и холестерола.
Возрастающая при мембранодеструкции концентрация обладающих высокой биологической активностью лизофосфолипидов и неэтерифицированных жирных кислот потенцирует дальнейшее разрушение биомембран и замыкает «порочный круг» [2]. Данный механизм является значимым в патогенезе повреждения головного мозга при эндогенной интоксикации перитонеального генеза.
В ходе наблюдения за животными в послеоперационном периоде отмечено существенное уменьшение выраженности перитонеального эндотоксикоза под влиянием этоксидола. В группе животных, получавших апробируемый препарат, отмечено снижение концентрации как гидрофильного, так и гидрофобного компонентов эндотоксикоза по сравнению с контрольной группой – на 14,54–31,49 % (р < 0,05) и 11,26–36,99 % (р < 0,05) соответственно. Отмечено снижение индекса токсичности плазмы крови на 25,40–47,93 % (р < 0,05) в опытной группе животных. Следует отметить, что данная тенденция регистрировалась уже с первых суток послеоперационного периода.
Проводимое исследование выявило уменьшение концентрации ТБК-активных продуктов липопероксидации в церебральной ткани собак опытной группы. Уровень спонтанного малонового диальдегида относительно контрольных цифр достоверно снижался на 15,77 % (р < 0,05) уже на третьи сутки после санации брюшной полости, на пятые сутки – на 45,81 % (р < 0,05). Титр индуцированного малонового диальдегида также уменьшался с третьих суток послеоперационного периода, будучи на заключительном этапе эксперимента на 17,94 % (р < 0,05) ниже показателей контрольной группы животных.
Этоксидол положительно зарекомендовал себя при проведении комплексной терапии в раннем послеоперационном периоде. В группе животных, получавших изучаемый препарат, уже на третьи сутки после санации брюшной полости отмечено статистически значимое уменьшение фосфолипазной активности в ткани головного мозга – на 14,12 % (р < 0,05) по сравнению с контрольными данными, в финале эксперимента – на 19,74 % (р < 0,05). Вместе с тем отмечено повышение реакционной способности фермента супероксиддисмутазы в аналогичные сроки – на 24,57 и 23,50 % (р < 0,05) по сравнению с показателями в группе животных, получавших стандартную терапию.
Этоксидол в составе комплексной терапии уже с третьих суток проводимого лечения статистически значимо снижал концентрацию моно- и диацилглицеролов на 36,93 и 32,03–42,30 % соответственно (р < 0,05). Уровень холестерола был также ниже контрольных цифр на 25,99 %, свободных жирных кислот – на 16,20–21,11 % (р < 0,05) (рис. 2).
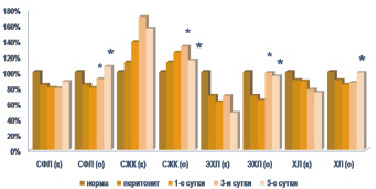
Рис. 2. Содержание токсических продуктов в плазме крови при остром экспериментальном перитоните. Примечание. * – достоверность отличия по отношению к контролю при p < 0,05; к – данные контрольной группы исследований, о – данные опытной группы исследований
Зарегистрировано достоверное увеличение доли суммарных фосфолипидов и триацилглицеролов в нейроцитах соответственно на 14,10–16,27, 44,52–82,10 и 39,18–74,67 % (р < 0,05) относительно с группы контроля. Содержание лизофосфолипидов и фосфатидилинозита было ниже идентичных показателей в группе животных, получавших стандартную терапию, на 20,80–28,85 и 19,73–26,29 % соответственно (р < 0,05). Титр фосфатидилхолина и фосфатидилэтаноламина был выше контрольных цифр на 22,94–24,32 % и 115,87 % (р < 0,05) соответственно.
Выводы
Антиоксидантный эффект этоксидола позволяет эффективно снижать в церебральной ткани избыточную концентрацию продуктов липопероксидации, вызванную перитонеальным эндотоксикозом. В указанных условиях препарат обладает способностью уменьшать фосфолипазную активность в головном мозге.
В ходе эксперимента отмечен значительный потенциал препарата для стабилизации биомембран нейроцитов, нормализации липидного метаболизма в ткани головного мозга.
Вышеизложенное позволяет заключить, что этоксидол может быть рекомендован для защиты головного мозга от эндотоксического повреждения при остром перитоните.
Рецензенты:
Пятаев Н.А., д.м.н., заведующий кафедрой, профессор кафедры анестезиологии и реаниматологии с курсом медицины катастроф Медицинского института, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск;
Рубцов О.Ю., д.м.н., профессор кафедры факультетской хирургии Медицинского института, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.
Работа поступила в редакцию 29.08.2014.
Библиографическая ссылка
Бойнова И.В., Спирина М.А., Власова Т.И., Турыгина С.А., Шокин М.Н. НЕКОТОРЫЕ АСПЕКТЫ ФАРМАКОКОРРЕКЦИИ ОКСИДАТИВНОГО СТРЕССА ПРИ ТОКСИЧЕСКОМ ПОРАЖЕНИИ ГОЛОВНОГО МОЗГА // Фундаментальные исследования. – 2014. – № 10-2. – С. 251-254;URL: https://fundamental-research.ru/ru/article/view?id=35326 (дата обращения: 16.04.2024).



