В настоящее время бурно развиваются методы неинвазивной пренатальной диагностики (НИПД) [2, 4], основанные на анализе плодного материала, попадающего в материнский кровоток. Несомненно, доступ к генетической информации плода на раннем сроке беременности без риска и без неприятных процедур для матери и ребенка открывает огромные возможности для диагностики состояний и патологий плода.
«Тест-RHD» (производство ООО «ТестГен», Россия) разработан для определения резус-фактора плода у резус-отрицательных женщин с целью выявления риска развития резус-конфликта и его обоснованной профилактики [8]. Сегодня во многих странах мира, и в России в том числе, предполагается введение анти-D-иммуноглобулина всем резус-отрицательным беременным женщинам в профилактических целях снижения риска гемолитической болезни новорожденных в текущей и последующих беременностях. Стоимость иммуноглобулина достаточно высока, некоторые производители получают его из препаратов донорской крови, что является небезопасным для женщин. Кроме того, сама процедура введения иммуноглобулина может сопровождаться нежелательными побочными эффектами: развитие реакции гиперчувствительности, анафилактический шок, артралгии и др. Однако, так как около 40 % резус-отрицательных беременных женщин на самом деле носят резус-отрицательный плод, рутинное тестирование вкфДНК (внеклеточной фетальной ДНК) предотвращает излишнее использование анти-D-иммуноглобулина в этих случаях [5, 14, 17].
Основная цель определения пола плода на сроке от 7 недель беременности – удовлетворение интереса родителей. Кроме того, «Тест-SRY» (производства компании ООО «ТестГен», Россия) актуален при необходимости выявления угрозы развития заболеваний, сцепленных с полом, что открывает не только большие диагностические, но и терапевтические возможности [11]. Определение пола плода может быть полезным при назначении специальной терапии плода на этапе внутриутробного развития, например, для лечения некоторых эндокринных расстройств, таких как врожденная дисфункция коры надпочечников [9]. Традиционные инвазивные методы, применяемые для выявления заболеваний, сцепленных с полом, имеют высокие риски и не могут быть выполнены до 11 недель беременности, а по результатам УЗИ пол может быть определён лишь с 11 недели, что связано с развитием наружных половых органов [15].
Материалы и методы исследования
В данное исследование включены результаты двухлетней работы 11 государственных и частных лабораторий (табл. 1). Всего в исследовании приняло участие 1817 беременных женщин, для 1006 из которых было проведено тестирование вкфДНК с целью выявления гена SRY и 811 женщин были резус-отрицательными и исследовались на установление резус-фактора плода, отрицательный резус-фактор у беременных был определен серологически. Всеми женщинами было подписано информированное согласие на выполнение данных исследований. Все женщины имели одноплодную беременность и беременность подтверждалась на УЗИ, генетическое исследование проводили в период первого и второго триместров беременности. Протоколы выделения вкфДНК и последующей ПЦР-амплификации были стандартизированы во всех медицинских учреждениях, участвующих в данном исследовании.
Подготовка образцов. Свежие образцы венозной крови собирались в пробирки объемом 8 мл с ЕDТA-антикоагулянтом, плазму отделяли от клеток путем центрифугирования при низкой скорости: 2500–3000 g в течение 10 минут, с последующим разделением плазмы и фрагментов клеток путем центрифугирования при 16000 g в течение 15 минут. Эти процедуры производились не позднее чем через 24 часа от момента отбора крови у беременной женщины с целью сокращения доли материнской ДНК в плазме, высвобождающейся из лейкоцитов. Супернатант отбирали в стерильные, свободные от ДНК пробирки и далее проводили непосредственно процедуру выделения вкфДНК.
Выделение внеклеточной циркулирующей фетальной ДНК из плазмы крови беременной матери. Из всех образцов плазмы беременных женщин, участвующих в данном исследовании, была выделена вкфДНК с использованием набора для выделения ДНК из плазмы «ДНК-Плазма-2» (производство ООО «ТестГен», Россия). Исключение составили исследования, проводимые в одной из лабораторий (см. данные ниже).
Выявление резус-фактора плода, обнаружение гена RHD методом ПЦР в режиме реального времени (ПЦР-РВ). С целью повышения специфичности анализа ПЦР-амплификацию проводили по трем разным регионам гена RНD (экзоны 6, 7, 10). Для определения RНD состояния плода ПЦР проводили с использованием набора «Тест-RHD» (производство ООО «ТестГен», Россия), данный набор содержит все необходимые для реакции буферы, ферменты, dNTP, специфические праймеры для амплификации каждого из выбранных экзонов и специфичные для них флуоресцентно меченные зонды. ПЦР-РВ проводили на различных ПЦР амплификаторах (ДТ96 и ДТ-Lite производство «ДНК-Технология», Россия, IQ5 и CFX от Bio-Rad, США, Rotor-Gene 6000 от Corbett Life Science, США). Конечный объем реакционной смеси составлял 20 мкл. Протокол амплификации (в соответствии с инструкцией) – 95 °С в течение 5 минут, затем 50 циклов 94 °С в течение 10 секунд и 62 °С в течение 50 секунд. Параллельно проводили реакцию амплификации гена GAРDH с целью контроля выделения ДНК и прохождения ПЦР. Отрицательный контроль и положительный контроль – RHD-положительная геномная ДНК (присутствует в наборе «Тест-RHD» (ООО «ТестГен», Россия), были включены в каждую реакцию.
Обнаружение гена SRY – маркера Y-хромосомы методом ПЦР-РВ. По аналогии с выявлением гена RНD исследование полученных образцов вкфДНК проводили по гену SRY – маркеру Y-хромосомы, с применением набора «Тест-SRY» (ООО «ТестГен», Россия). Набор также содержал все необходимые для реакции буферы, ферменты, dNTP, специфические праймеры и флуоресцентно меченные зонды для локусов гена SRY. ПЦР-РВ проводили на тех же ПЦР-амплификаторах. Конечный объем реакционной смеси составлял 20 мкл. Протокол амплификации (в соответствии с инструкцией) – 95 °С в течение 5 минут, затем 50 циклов 94 °С в течение 10 секунд и 62 °С в течение 50 секунд. Параллельно проводили амплификацию участка гена GAРDH с целью контроля выделения ДНК. Отрицательный контроль и положительный контроль реакции также ставились (присутствуют в наборе «Тест-SRY» (ООО «ТестГен», Россия)).
Статистический анализ. По результатам исследования были определены чувствительность, специфичность, положительная прогностическая ценность (PPV), отрицательная прогностическая ценность (NPV), диагностическая точность. Эти параметры были вычислены с использованием сведений, полученных после родов.
Результаты исследования и их обсуждение
Для всех беременных, принявших участие в данном исследовании, были получены качественные результаты, отвечающие всем необходимым параметрам верного прохождения реакций (рисунок).
Из 1006 образцов, проанализированных по полу, в 59,24 % (596 обр.) ген SRY выявлен не был и в 40,76 % (410 обр.) был выявлен; по резус-фактору – из 811 проанализированных образцов 80,39 % (652 обр.) оказались резус-положительными и 19,61 % (159 обр.) резус-отрицательными (табл. 1).
Таблица 1
Распределение образцов вкфДНК, принявших участие в исследовании по полу и резус-фактору плода
|
Всего |
Мал. |
% |
Дев. |
% |
|
|
Исследования по полу плода |
1006 |
410 |
40,76 |
596 |
59,24 |
|
Всего |
+ |
% |
– |
% |
|
|
Исследования по резус-фактору плода |
811 |
652 |
80,39 |
159 |
19,61 |
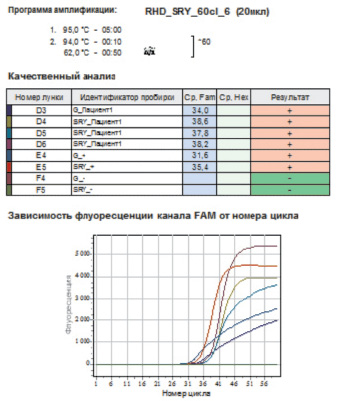
а
Примеры положительных результатов ПЦР-амплификации в режиме реального времени: а – «Тест-SRY» (ООО «ТестГен», Россия)

б
Примеры положительных результатов ПЦР-амплификации в режиме реального времени: б – «Тест-RHD» (ООО «ТестГен», Россия)
По результатам проведенного исследования «Тест-SRY» (производство ООО «ТестГен», Россия) имеет диагностическую точность 99,50 %. «Тест-RHD» (производство ООО «ТестГен», Россия) – 97,90 %. Чувствительность «Тест-SRY» составила 99,03 %, а чувствительность «Тест-RHD» – 98,47 %. Количество ложноположительных результатов «Тест-SRY» составило 1 (PPV: 99,76 %) и ложноотрицательных 4 (NPV: 99,33 %) (табл. 2, 3). Количество ложноположительных результатов «Тест-RHD» – 7 (PPV: 98,93 %)* и ложноотрицательных – 10 (NPV: 93,71 %)** (табл. 2, 3).
Таблица 2
Сводная таблица по результатам проведенного исследования
|
Анализ SRY |
Анализ RHD |
|
|
Всего |
1006 |
811 |
|
Выявлено |
410 (40,76 %) |
652 (80,39 %) |
|
Не выявлено |
596 (59,24 %) |
159 (19,61 %) |
|
Несовпадений среди выявленных |
1 (0,24 %) |
7 (1,07 %)* |
|
Несовпадений среди невыявленных |
4 (0,67 %) |
10 (6,29 %)** |
|
Всего несовпадений анализов |
5 (0,50 %) |
17 (2,10 %) |
Таблица 3
Основные общие аналитические характеристики использованных диагностических методик
|
Анализ SRY |
Анализ RHD |
|
|
Диагностическая точность |
99,50 % |
97,90 % |
|
Чувствительность |
99,03 % |
98,47 % |
|
Специфичность |
99,83 % |
95,51 % |
|
Доля ложноположительных результатов |
0,10 % |
0,86 % |
|
Доля ложноотрицательных результатов |
0,40 % |
1,23 % |
|
Положительная прогностическая ценность |
99,76 % |
98,93 %* |
|
Отрицательная прогностическая ценность |
99,33 % |
93,71 %** |
Примечания:
*Во всех случаях ложноположительных результатов несоответствия были сняты путём проведения генетических анализов детей после рождения, результаты показали наличие у них гена RHD.
** Все ложноотрицательные результаты были получены в одной и той же лаборатории, где использовался метод выделения ДНК, не ориентированный на вкфДНК. Поэтому получение ложноотрицательных результатов мы связываем с отработкой этапа выделения ДНК.
Нами было проведено распределённое исследование по определению диагностической точности, чувствительности и специфичности набора «Тест-RHD» (ООО «ТестГен», Россия) для неинвазивного определения резус-фактора плода на основе анализа вкфДНК, выделенной из плазмы крови резус-отрицательных беременных матерей. В данном исследовании приняло участие 11 независимых лабораторий России и стран ближнего зарубежья (Казахстан и Украина), в нем участвовало 811 резус-отрицательных женщин. В проведенном нами исследовании диагностическая точность методики неинвазивного определения резус-фактора плода по крови беременной матери на сроках беременности от 9 недель составила 97,90 %, чувствительность использованной методики составила 98,47 %, специфичность – 95,51 %. Безусловно, диагностическая точность, чувствительность и специфичность методики увеличиваются при увеличении срока беременности. Это обуславливается увеличением количества генетического материала плода в кровотоке матери. Так, по данным литературы, на сроке в 9 недель беременности лишь 1 % от всей свободно циркулирующей внеклеточной ДНК является фетальной, а на сроке в 20 недель – около 7 % [12].
При сравнении полученных результатов с аналогичными зарубежными исследованиями, очевидно, что полученные данные весьма схожи. Так, в одном из самых ранних сообщений по данному направлению, в статье Finning и соавт., диагностическая точность выбранной ими методики составила 97 %, в исследование были включены 137 беременных первым ребенком женщин, фетальную ДНК авторам исследования удалось достоверно проанализировать только на 11 неделе беременности [5]. Аналогичные данные были получены и в исследовании Hyland и др. в 2009 году [6].
В настоящем исследовании было получено 7 (0,86 %) ложноположительных результатов и 10 (1,23 %) ложноотрицательных результатов. Это сопоставимо с количеством ложноположительных и ложноотрицательных результатов в аналогичных исследованиях. Так, например, у Sedrak и соавт. сообщается о двух ложноположительных результатах для методики выявления генотипа резус-фактора плода у 90 D-отрицательных беременных женщин [18]. Javadi и соавт. сообщили об одном ложноположительном результате среди 72 резус-отрицательных женщин на сроке от 11 до 19 недель беременности [3].
Ложноположительные результаты могут быть объяснены тем, что генетически резус-фактор у плода положительный, но каким-то образом функция гена подавлена или ограничена, и серологически этот резус-фактор не определяется; также ложноположительные результаты могут свидетельствовать о наличии в геноме у плода так называемого псевдогена RhD [10]. Небольшое количество ложноположительных результатов не приведёт к серьезным клиническим проблемам, так только еще несколько матерей будет получать анти-RhD иммуноглобулин, а это на порядки меньше того количества беременных, которых сейчас необоснованно получают данную терапию.
В настоящем исследовании ложноотрицательные результаты были получены в 1,23 %. В аналогичных исследованиях при достаточно большой выборке участников исследования авторы также выявляли от 1 до 2 % ложноотрицательных результатов. Это может быть связанно с нарушениями гена GAPDH у матери, наличием точечных мутаций в гене RHD плода, индивидуально низким уровнем апоптоза клеток плода или присутствием в кровотоке матери ДНК плода прошлой беременности (например, если предыдущая беременность была менее чем за 3 месяца до настоящей), деградация ДНК на этапе выделения или хранения, неустойчивость продуктов ПЦР и др. [6,7]. Ложноотрицательные результаты клинически более значимы, так, необнаружение резус-положительного плода повлечет отсутствие иммунопрофилактики матери и может увеличить риск развития ГБПиН (геморрагической болезни плода и новорожденного) [16]. Не следует также исключать и развитие аутоиммунной реакции у D-отрицательной матери с D-отрицательным плодом, это возможно менее чем у 0,5 % таких беременных [10]. По результатам проведённых исследований стало очевидно, что применение неадаптированных методов выделения внеклеточной ДНК является первостепенной причиной получения ложноотрицательных результатов.
Настоящее исследование определения пола плода при помощи набора «Тест-SRY» показало точность и высокую надежность разработанного анализа уже с 7 недели беременности. Диагностическая точность составила 99,50 %, чувствительность – 99,03 %, специфичность – 99,83 %. Это также весьма соотносится с данными, полученными в аналогичных работах. Так, в исследовании Zhao и Zou,Wataganara и соавт. и у Wright с соав. чувствительность составила от 89 до 97 % [1, 19, 20, 21], а в исследованиях Brojer и соавт. и Scheffer с соавт. диагностическая точность также была выше 99 % [13]. Эти расхождения могут быть связаны с различиями в способах выделения ДНК, с низкой концентрацией вкфДНК у разных беременных.
Заключение
Методики определения пола и резус-фактора плода по крови беременной женщины с применением наборов «Тест-SRY» и «Тест-RHD» (ООО «ТестГен», Россия) обладают высокими показателями диагностической точности, чувствительности и специфичности; являются легкими, простыми и надежными в исполнении и могут быть рекомендованы для применения в рутинной лабораторной практике.
Рецензенты:Васильев Д.А., д.б.н., профессор, генеральный директор ООО «НИИЦМБ», г. Ульяновск;
Девяткин А.А., д.м.н., начальник отдела медицинской статистики и управления качеством, ГБУЗ «Самарская городская клиническая больница № 1 им. Н.И. Пирогова», г. Самара.
Работа поступила в редакцию 25.12.2014.
Библиографическая ссылка
Тороповский А.Н., Никитин А.Г., Жмырко Е.В., Скороходов Л.С., Беляков А.В., Викторов Д.А. АНАЛИЗ ПОКАЗАТЕЛЕЙ ИНФОРМАТИВНОСТИ НАБОРОВ РЕАГЕНТОВ «ТЕСТ-SRY» И «ТЕСТ-RHD» ПРИ ОПРЕДЕЛЕНИИ ПОЛА И РЕЗУС-ФАКТОРА ПЛОДА // Фундаментальные исследования. – 2014. – № 10-8. – С. 1566-1571;URL: https://fundamental-research.ru/ru/article/view?id=36357 (дата обращения: 19.04.2024).



