Лёгочная оссификация (ЛО) – развитие в лёгких костной ткани (resp. – понятие «кость» и «костная ткань» здесь и далее будут употребляться как синонимы) с или без очагов миелопоэза – до настоящего времени привлекает к себе внимание только своей редкостью и неясностью механизма развития. В мировой литературе описано по разным авторам от 140 до 200 случаев этой патологии. В отечественной литературе за последние десятилетия опубликовано пять описаний авторских наблюдений лёгочного окостенения [3, 8, 10, 11, 13] и три обзора по проблеме лёгочных кальци- и оссификаций [6, 8, 13].
Неясность патогенетических представлений объясняет описание лёгочной оссификации то вместе с кальцификацией (кальциноз, обызвествление) лёгких, поскольку обоим состояниям свойственно отложение кальция в тканях [15, 18], то в группе болезней накопления вместе с амилоидозом и протеинозом лёгких [12]. Порой признание патогенетической содружественности кальци- и оссификации доходит до трактовки лёгочной оссификации как естественного продолжения кальцификации [18]. Эта точка зрения созвучна представлениям исследователей прошлых лет, объединявших кальцификацию и оссификацию лёгких в группу известковых дистрофий и полагавших, что процесс обызвествления ткани вообще способствует метапластическому образованию в ней костной ткани [1].
Лёгочная оссификация в зарубежной литературе описывается чаще как дендриформная (ветвистая, древовидная, коралловидная) ЛО [17, 20, 23, 27, 31, 35, 40, 42], в отечественной – как остеопластическая пульмопатия [3, 6, 8, 10, 11]. Встречаются и другие дефиниции этой патологии – «диффузная», «идиопатическая диссеминированная», «гетеротопическая» ЛО.
В настоящее время имеется достаточно оснований отказаться от критерия отложения кальция в тканях как сущностного для объединения лёгочных кальци- и оссификации и трактовать ЛО феноменом, принципиально отличающимся от кальциноза лёгких.
Лёгочная кальфицикация относится к области метаболических нарушений кальций-фосфорного обмена на уровне либо целостного организма, либо клеток. Многочисленность причин гомеостатических и/или внутриклеточных нарушений этого обмена объясняет разнообразие форм лёгочного кальциноза [15, 16]. Только торакальный (альвеолярный, лёгочный) микролитиаз как одна из его форм остаётся необъяснённым с точки зрения метаболических нарушений.
ЛО как процесс образования костной ткани относится к явлениям цито- и гистогенеза соединительной ткани. Её развитие подчиняется закономерностям формирования тканей и детерминации путей клеточной дифференциации, в данном случае выходящих за рамки онтогенетического развития, поскольку она носит гетеротопический характер и неизбежно должна быть сопряжена с процессом метаплазии, то есть с феноменом превращения специализированных клеток одного типа в гистогенетически другой тип клеток.
Эмпирические наблюдения о метапластическом образовании костной ткани в зонах воспаления и фиброза до последней четверти минувшего столетия схематизированно объяснялись развитием костной ткани из камбиальных клеток, из клеток мезенхимального резерва, оставшихся в ткани с периода эмбрионального развития и по непонятным причинам уклоняющихся во взрослом организме в сторону остеопластического вместо фибропластического развития. Выражение «метапластическое образование» костной ткани в лёгких того периода имело метафорический, иносказательный характер, поскольку метаплазия клеток лёгочной ткани как высоко специализированных считалась, исключая онкологическую ситуацию, невозможной [2]. «…даже в пределах обширной, сборной группы эпителиальных тканей у позвоночных не бывает взаимопревращений кожного и кишечного эпителиев или кишечного и целомического эпителиев, то есть взаимопревращений тканей. Тем более следует считать окончательно ушедшими в область прошлого представления о превращениях эпителиев в соединительную ткань и обратно, ведущее начало ещё от Вирхова» [9].
Прогресс науки привел к кардинальному пересмотру представлений о специализации клеток, их дифференцировке, трансдетерминации, трансдифференцировке и метаплазии. В настоящее время доказано, что дифференцировка является обратимым процессом, генетическая программа любой клетки любого уровня дифференцировки и специализации доступна перепрограммированию. Нобелевская премия 2012 года по физиологии и медицине была вручена Д. Гёрдону и С. Яманаке за «открытие возможности перепрограммирования дифференцированных клеток в плюрипотентные».
Физиологические и патогенетические каскады, определяющие вектор клеточной дифференциации клеток и состоящие из про- и противовоспалительных, ростовых факторов, факторов миграции, рецепторов к ним, молекул адгезии и сигнальной трансдукции, регуляторов трансляции (активирующих и ингибирующих) оказались путями, по которым лежащие на поверхности «причины» – нозологии и различные состояния (воспаление, гипоксия, оксидативный стресс, излучения и проч.) – получают доступ к геному, репрессируя одни и экспрессируя другие его участки, тем самым приводя не только к гистогенетически детерминированному развитию клеток, но и к изменению их гистогенетических фенотипов.
Сказанное было доказано на патогенезe фиброзирующих и оссифицирующих заболеваний как в целом [21, 34, 39], так и при патологии системы органов дыхания [19, 25, 33, 41], а также при таких клинически значимых заболеваниях, как гетеротопическая оссификация мягких тканей опорно-двигательного аппарата у обездвиженных пациентов с ожогами, обширными травмами скелета, черепно-мозговыми или спинальными травмами [32, 36, 37] и при прогрессирующей оссифицирующей фибродисплазии [22, 26, 29].
Обнаружившаяся в патогенезе фиброза закономерность гистогенетических превращений оказалась тождественной наблюдающейся в период эмбриогенеза и известной в биологии развития как эпителиально(или эндотелиально)-мезенхимальная трансформация как способа изменения гистогенетического фенотипа клеток путем их дедифференцировки.
В условиях патологии эпителиальные или эндотелиальные клетки под воздействием механизмов патогенетического каскада также реверсируют в фенотип клеток своих гистогенетических предшественников, то есть в фенотип мезенхимальных клеток [19, 21, 25, 30, 34, 38, 39], гистогенетической потенцией которых является способность образовывать различные диффероны (клеточные линии): фибропластической, мио-хондро-остео- и адипоцитарной направленности. Морфофункциональная гетерогенность фибробластов, объясняемая существованием нескольких гистогенетических линий, объединённых общим термином «популяция фибробластов» [4], расширила круг претендентов на промежуточные и конечные клетки эпителиальной или эндотелиальной трансформации вплоть до мезенхимальных клеток [28].
В клинических условиях эпителиально-мезенхимальная трансформация ЭМТ может быть отслежена при обычной световой микроскопии не только по исчезновению полярности клеток, изменению их внешнего вида, затрудняющих отличие их от фибробластов, но и по выявлению появившейся у них миграционной способности. Иммуногистохимически и иммуноферментативно у реверсируемых эпителиальных клеток начинают обнаруживаться маркёры, свойственные мезенхимальным клеткам. При ЭМТ исчезают многие специфичные для эпителиев белки кератиновой группы, из которых построены промежуточные филаменты, типичные для всех эпителиев. Эти кератины заменяются виментином – белком промежуточных филаментов, типичным для всех клеток мезенхимального происхождения. Мезенхимальные и мезенхиподобные клетки начинают экспрессировать, помимо виментина, другие свои маркёры: немышечный актин, десмин, α-гладкомышечный актин (α-SMA), фибронектин, а также начинают синтезировать коллаген и гликозаминогликаны, указывающие на менее зрелый характер соединительной ткани. Полнота ЭМТ (полная или неполная) зависит, скорее всего, от глубины дерепрессии генома.
Таким образом, к продукции коллагена, развитию фиброза, мышц, хряща или костной ткани в очагах гетеротопической оссификации в любом месте, в том числе и при ЛО, могут оказаться причастными клетки трёх линий:
1) резидентные прогениторные клетки мезенхимального фенотипа;
2) пришлые из костного мозга мезенхимальные стромальные клетки;
3) образовавшиеся на месте при ЭМТ мезенхимоподобные клетки фибропластической, остеопластической или хондропластической ориентации.
Однако изучение интимных механизмов лёгочного фиброза находится ещё в стадии накопления фактов [24], а представление о роли ЭМТ в её генезе считается недостаточно изученными [7]. Поэтому в представившемся нам случае лёгочной дендриформной оссификации мы изучили существование при ней феномена ЭМТ. А поскольку представления о патогенезе пневмокониоза остаются дискутабельными [5, 14], мы попутно озадачились вопросом о возможности проявления его в форме ЛО.
Из 119 найденных нами публикаций о ЛО только в двух [3, 42] сообщалось об ассоциации её с пневмокониозом, развившимся от воздействия редкоземельных металлов. Авторы первого из них говорили о сочетании двух нозологий, во второй трактовали оссификацию как осложнение или проявление пневмокониоза.
Приводим описание собственного наблюдения. Мужчина, 1950 г.р., в 1971-2005 годах работал в подземных условиях шахтёром в Кемеровской области в разных профессиях: горнорабочий очистного забоя, подземный электрослесарь, горный мастер. Проходил профосмотры, признавался годным к работе. На предмет профессиональной патологии органов дыхания не обследовался. С 2005 года перестал подвергаться воздействию пылевого фактора. Осенью 2011 года госпитализирован в терапевтическое отделение в связи с болями в голеностопных и коленных суставах, оказавшимися связанными с деформирующим остеоартрозом. Тогда рентгенологически выявлено снижение пневматизации лёгочной ткани в верхних и средних отделов лёгких за счёт резко усиленного лёгочного рисунка с нечёткими контурами, местами сливающимися; деформация лёгочного рисунка по смешанному типу; малоструктурность корней; местами буллёзные вздутия. По СКТ органов грудной клетки с болюсным контрастированием: в лёгких диффузно, практически симметрично обнаруживались участки уплотнения лёгочной ткани по типу «матового стекла», чередующиеся с немногочисленными небольшими участками альвеолярной консолидации, на фоне которых отчётливо были видны просветы бронхов; интерстиций был изменён в виде утолщения междольковых перегородок; наибольшая выраженность изменений приходилась на средние отделы; в средостении выявлялись отдельные увеличенные лимфоузлы с максимальным их размером до 14×15 мм. Выявленные изменения в лёгких протекали клинически бессимптомно. Характер заболевания оставался до 2013 года неясным. Предполагался ревматоидный артрит с синдромом Каплана, недифференцированное заболевание соединительной ткани с поражением суставов и лёгких. Рабочим диагнозом был саркоидоз лимфатических узлов и лёгких, в связи с чем проводилась стероидная терапия. СКТ органов грудной клетки в апреле 2013 – практически без существенной динамики. В связи с неясностью клинической ситуации и неэффективностью стероидной терапии пациенту в апреле 2013 года в туберкулезном отделении выполнена диагностическая торакотомия слева с краевой резекцией лёгкого.
Макроскопически во время операции были выявлены участки уплотнения ткани лёгкого; в резецированном участке размером 4×2×2 см определялась зона уплотнения лёгочной ткани 1,5×2,0 см местами каменистой плотности с отложениями угольной пыли; на разрезе зона уплотнения была частично кальцинированной. При световой микроскопии в зоне уплотнения диффузно обнаруживались многочисленные костные балки в виде одиночных структур или их скоплений (рис. 1). Последние располагались среди зон перибронхиального или периваскулярного склероза, а также между участками бронхиально-респираторной ткани лёгких с её сдавлением и атрофией, в том числе и внутриальвеолярно. Костные балки содержали элементы клеточного костного мозга или жировую ткань. Наличие в костных балках клеток хондроидного типа свидетельствовало тем не менее о несовершенном остеогенезе. Таким образом, выявленные изменения не оставляли сомнение в принадлежности их к ЛО.
Аргументациями в пользу феномена ЭМТ при световой микроскопии являлись, во-первых, фибробластноподобные клетки среди бронхиального эпителия и, во-вторых, данные иммуногистохимического исследования, выполненного по методике мультимерной безбиотиновой системы детекции – REVEAL Biotin-Free Polyvalent DAB (Производитель – Spring Bioscience, США). Оно выявило антитела к виментину как у отдельных клеток бронхиального эпителия (рис. 2), так и у клеток, располагавшихся в зоне фиброза (рис. 3).
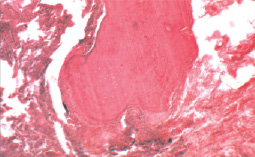
Рис. 1. Компактная кость в окружении угольной пыли в зоне фиброза (справа) и в респираторной структуре лёгкого (слева); в кости определяются хондроидные элементы (внизу) и очаг миелопоэза (вверху); ×100; окраска гематоксилином и эозином
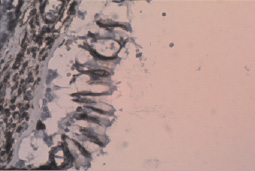
Рис. 2. Экспрессия виментина в эпителии бронха; ×400
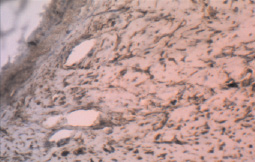
Рис. 3. Экспрессия виментина в недифференцированных клетках соединительной ткани в зоне перибронхиального склероза; ×100
Результаты исследования однозначно указывали на феномен ЭМТ, который мы считаем причастным и к интерстициальному фиброзу, и к развитию ЛО. Но и фиброз, и ЛО мы трактуем как проявление пневмокониотического процесса, исходя из современных представлений о гетеротопической оссификации как феномена трансформации прогениторных мезенхимальных клеток в остеобласты и об ЛО как частном его (феномена) случае, при котором клетки остеогенной ориентации образуются путём ЭМТ.
В представленном нами случае значительная запылённость лёгких угольно-породной пылью, содержащей двуокись кремния и облигатно запускающей макрофагальное воспаление, в свою очередь неизбежно являющего триггером для всех клеток, а также локализация этой пыли в зонах оссификации позволяют говорить о причастности её к развитию и ЭМТ, и остеогенной направленности ответной реакции образовавшихся при ней мезенхимоподобных клеток. Аргументацией пневмокониотической трактовки выявленной оссификации является, помимо её локализации в зонах, содержащих угольную пыль, морфологическая избыточность ответной реакции соединительной ткани. Для гетеротопических оссификаций, являющихся клинической проблемой, таких как прогрессирующая оссифицирующая фибродисплазия, оссификация крупных суставов у ортопедически или неврологически обездвиженных больных, характерна, помимо их биологической неуместности, ещё и морфологическая неуёмность (избыточность) соединительнотканных разрастаний. Но избыточность образования коллагеновых волокон характерна и для пневмокониозов, особенно узелковых его форм, в которых она резко контрастирует со слабым развитием соединительной ткани в случаях запылённости лёгких интактной пылью.
Данные литературы и собственное наблюдение, несмотря на его единичность, в сочетании с отсутствием специфических для ЛО рентгенологических признаков и возможностью её клинически бессимптомного течения дают основание предполагать её более широкую распространённость, которая у работников пылевых профессий может протекать под маской кальцификации лёгких, являясь, по сути дела, формой пневмокониоза.
Рецензенты:Давыдова Е.В., д.м.н., доцент, профессор кафедры факультетской терапии, ГБОУ ВПО «Южно-Уральский государственный медицинский университет», г. Челябинск;
Серебряков П.В., д.м.н., профессор, зав. терапевтическим отделением Института общей и профессиональной патологии, ФБУН «Федеральный научный центр гигиены им. Ф.Ф. Эрисмана», г. Мытищи;
Войцеховский В.В., д.м.н., доцент кафедры госпитальной терапии, ГБОУ ВПО «Амурская ГМА», г. Благовещенск;
Лахман О.Л., д.м.н., профессор, главный врач клиники ФГБУ «Восточно-Сибирский научный центр экологии человека» Сибирского отделения РАМН, зав. кафедрой профпатологии и гигиены, ГБОУ ДПО «Иркутская государственная медицинская академия последипломного образования», г. Ангарск;
Широков В.А., д.м.н., профессор, ведущий научный сотрудник, ФБУН «Екатеринбургский медицинский научный центр профилактики и охраны здоровья рабочих предприятий», г. Екатеринбург.
Работа поступила в редакцию 04.12.2014.
Библиографическая ссылка
Разумов В.В., Бондарев О.И. ДЕНДРИФОРМНАЯ ЛЁГОЧНАЯ ОССИФИКАЦИЯ КАК ФОРМА ПНЕВМОКОНИОЗА НА ФОНЕ ЭПИТЕЛИАЛЬНО-МЕЗЕНХИМАЛЬНОЙ ТРАНСФОРМАЦИИ // Фундаментальные исследования. – 2014. – № 10-8. – С. 1640-1646;URL: https://fundamental-research.ru/ru/article/view?id=36372 (дата обращения: 18.04.2024).



