Термин «Metabolomics» впервые был опубликован в 1998 г. в статье «Effect of Slow Growth on Metabolism of Escherichia coli, as Revealed by Global Metabolite Pool (metabolom) Analysis» [16]. Согласно существующим представлениям, метаболомика – это «систематическое изучение уникальных химических «отпечатков пальцев», специфичных для процессов, протекающих в живых клетках» [10]. Метаболом представляет собой совокупность всех метаболитов, являющихся конечным продуктом обмена веществ в клетке, ткани, органе или организме [12]. В то время как данные об экспрессии мРНК генов и данные протеомного анализа не раскрывают полностью того, что может происходить в клетке, метаболические профили могут дать мгновенный «снимок» физиологических процессов в ней [15]. Токсические эффекты, генетические и соматические заболевания могут проявляться нарушением синтеза некоторых белков, приводящим к изменению управления биохимическими процессами, что в свою очередь отражается на соотношении концентраций многих эндогенных веществ в потоках биологических жидкостей [6, 10, 15]. На сегодняшний день метаболомика все ещё остается «новой» областью исследований [12]. Дальнейший прогресс в этой области зависит от многих факторов, в том числе от развития технической базы аналитических методов. С учетом наличия подобной ситуации неслучаен интерес к инновационным методам, которые способны отражать метаболический профиль биологических жидкостей. К таковым, в частности, относятся технологии исследования кристаллогенных свойств биосред [4].
К настоящему времени клинические проявления нематодозов изучены достаточно полно, предложены новейшие методы диагностики этих заболеваний, однако глобальные экологические изменения последних десятилетий, широкое применение антибактериальных, иммунотропных и прочих лекарственных средств и ряд других факторов изменили клиническую картину данных паразитарных инвазий [5, 8, 9, 11]. На этом основании нематодозы, несмотря на их распространенность, остаются на сегодняшний день одной из самых плохо диагностируемых патологий [8]. В связи с этим актуальными остаются поиски методов ранней, качественной, информативно-специфической верификации глистно-паразитарной инвазии с целью проведения своевременного лечения методами, обладающими минимальным количеством побочных эффектов и высокой эффективностью в отношении паразитарных инвазий у человека и животных, для чего необходимо иметь арсенал антигенов всех гельминтов [8, 13].
Целью исследования служила оценка особенностей дегидратированных антигенов некоторых распространенных гельминтов (трихинелл, сетарий, токсокар).
Материалы и методы исследования
Исследованы соматические антигены нематод (трихинелл, сетарий и токсокар). Для получения антигена трихинелл провели экспериментальное заражение белых беспородных крыс (15 животных) личинками T. spiralis в дозе 2000 лич./животное [1, 5, 7]. Из тушек крыс готовили фарш, который переваривали в искусственном желудочном соке (пептолиз) по ускоренной методике в аппарате АВТ (аппарат для групповой экспертизы свинины на трихинеллез) в течение 30 минут при непрерывном помешивании. Использовали личинки 45–50-дневного возраста. Выделенных личинок тщательно отмывали физиологическим раствором, затем 2 раза стерильным физиологическим раствором и переносили в стерильный стакан. Дальнейшую отмывку проводили в стерильных условиях в боксе. Отмывали 4 раза раствором Хенкса с добавлением 1000 Ед/мл пенициллина и 1 мг/мл стрептомицина и 1 раз физиологическим раствором. Экспозиция отстаивания после каждой отмывки составляла 15–20 минут, что позволяло избавиться от нежизнеспособных особей. Отмытых личинок помещали в чашки Петри. Антиген из трихинелл получали по методу Маgat в модификации ВИГИС – фракционированием соматических экстрактов гельминтов [2, 3]. Через 40–45 дней получали мышечную массу крыс. Переваривание в искусственном желудочном соке проводили в течение 4 часов при 39–40 °С, периодически перемешивая содержимое. Полученные личинки отмывали физраствором, проверяли их жизнеспособность и замораживали для накопления и дальнейшего использования при температуре –18 °С. Приготовление соматических экстрактов гельминтов путем измельчения, гомогенизации, многократного замораживания и оттаивания с последующим экстрагированием белков в фосфатном буферном растворе рН 7,2–7,4 проводилось при температуре 4 °С при постоянном перемешивании на магнитной мешалке в течение 24–48 часов. Полученная гомогенная масса была подвергнута центрифугированию при 15 тыс. об/мин на холоде в течение 15–20 мин. Надосадочная жидкость – экстракт – использовался в качестве антигена. Фракционирование белковых антигенов-экстрактов из половозрелых T. spiralis проводили методом гель-фильтрации на колонке с сефадексом [2, 7].
Антиген из сетарий получен по способу Бережко В.К. с соавт. [2, 7] и включает следующие процессы: проведение гомогенизации половозрелых гельминтов Setaria labiato-papillosa вручную на холоде, экстрагирование белков гомогената в фосфатно-солевом буфере рН 7,2–7,4 в соотношении 1:10 в течение 48 часов при +4 °С на магнитной мешалке, центрифугирование гомогената и отбор надосадочной жидкости при 15 тыс.об/мин и +4 °С в течение 20 минут, надосадочную жидкость – экстракт дополнительно очищают гель-фильтрацией на колонке с сорбентом Superose 12 Prep Grade и скоростью потока натрий-фосфатного буфера (рН 6,0) – 30 мл/ч, с последующим отбором антигеноактивных фракций посредством иммуноферментной реакции с помощью положительных и отрицательных при дирофиляриозе собак референс-сывороток.
Исследовали кристаллогенную активность антигенов по следующей методике [5, 13б 14]: отбирали пробу, которую наносили на предметное стекло, в объеме 50–100 мкл и проводили дегидратацию препарата в потоке теплого воздуха при температуре 40–50 °С и влажности 20–30 % в течение 15–20 минут в горизонтальном положении. Далее с помощью цифровой фотокамеры высокого разрешения получали цифровое изображение препарата, которое переносили в память компьютера и изучали основные структурообразующие элементы фаций.
Для выполнения качественно-количественной оценки результатов собственной кристаллизации слюны (морфометрия фаций) применяли следующие критерии: индекс структурности, кристаллизуемость, степень деструкции фации и выраженность краевой белковой зоны [5, 14].
Статистическую обработку данных производили с помощью Statistica 6.0.
Результаты исследования и их обсуждение
Картины собственной структуризации антигенов некоторых нематод представлены на рис. 1–3. Анализ кристаллогенных свойств антигенов различных гельминтов позволяет верифицировать их существенные различия, причем они находят отражение как в морфологии центральной, так и краевой зоны микропрепарата.

Рис. 1. Морфологическая картина фации дегидратированного фракционированного антигена, приготовленного из трихинелл
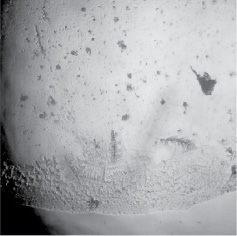
Рис. 2. Морфологическая картина фации дегидратированного фракционированного антигена, приготовленного из сетарий
Так, наименее выраженной кристаллогенной активностью обладает антиген трихинелл (рис. 1). Для его фаций характерно формирование немногочисленных одиночно-кристаллических элементов в центральной зоне в сочетании с умеренными признаками дендритообразования в краевой зоне высушенного образца.
В дегидратированных препаратах сетарий наблюдали более активную структуризацию, что в первую очередь касалось стимуляции процессов дендритогенеза в краевой зоне фации (рис. 2). Также регистрировали активацию кристаллообразования и в центральной зоне микропрепарата антигена.

Рис. 3. Морфологическая картина фации дегидратированного фракционированного антигена, приготовленного из токсокар
Паттерн собственной кристаллизации эталонных антигенов
|
Показатель |
Виды паразитарных антигенов |
||
|
Антиген из трихинелл |
Антиген из сетарий |
Антиген из токсокар |
|
|
Индекс структурности |
0,7 ± 0,2* |
1,4 ± 0,3 |
2,9 ± 0,2* |
|
Кристаллизуемость |
1,4 ± 0,2 |
1,1 ± 0,3 |
2,8 ± 0,2* |
|
Степень деструкции фации |
1,8 ± 0,3* |
1,1 ± 0,2 |
0,6 ± 0,3* |
|
Выраженность краевой зоны |
1,6 ± 0,2* |
2,3 ± 0,3 |
1,2 ± 0,2* |
Примечание. * – р < 0,05 по сравнению с уровнем показателя, характерным для антигена сетарий.
Наиболее значимая дендритизация кристаллоскопической фации отмечена в случае проведения дегидратации антигена токсокар (рис. 3). Эта тенденция особенно выраженно проявлялась в краевой зоне микропрепарата, однако и в центральной его части имело место формирование поликристаллических структурных элементов.
На основании подсчета четырех указанных выше показателей сформирован паттерн их значений (таблица). Установлено, что различия в характере собственной кристаллизации рассматриваемых антигенов проявляются и при морфометрическом анализе кристаллограмм, причем все использованные показатели закономерно изменяются в ряду «токсокары – сетарии – трихинеллы».
Заключение
Установлено, что кристаллогенные свойства антигенов различных гельминтов существенно варьируют. При этом их прокристаллогенная активность убывает в ряду «токсокары – сетарии – трихинеллы», что проявляется на основании анализа кристаллоскопических фаций антигенов указанных гельминтов по всем использованным критериям. Это позволяет говорить о возможности разработки технологии метаболической дифференциации антигенов по их способности к собственной структуризации.
Работа поддержана грантом РФФИ № 14-34-50-405 «Научно-методические основы разработки методов специфической профилактики трихинеллеза».
Рецензенты:
Колосов А.Е., д.м.н., профессор, зав. кафедрой патологической анатомии с секционным курсом, ГБОУ ВПО «Кировская государственная медицинская академия Минздрава России», г. Киров;
Абдуллин Т.Г., д.м.н., профессор кафедры гистологии, эмбриологии и цитологии, ГБОУ ВПО «Кировская государственная медицинская академия Минздрава России», г. Киров.
Работа поступила в редакцию 26.12.2014.
Библиографическая ссылка
Мартусевич А.К., Мартусевич А.К., Жданова О.Б., Хайдарова А.А., Бережко В.К., Написанова Л.А. АНАЛИЗ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ АНТИГЕНОВ НЕКОТОРЫХ ГЕЛЬМИНТОВ КАК ТЕХНОЛОГИЯ ПАРАЗИТОЛОГИЧЕСКОЙ МЕТАБОЛОМИКИ // Фундаментальные исследования. – 2014. – № 12-7. – С. 1437-1441;URL: https://fundamental-research.ru/ru/article/view?id=36381 (дата обращения: 25.04.2024).



