Известно, что сахарный диабет (СД) является одной из наиболее социально значимых проблем. Ежегодно СД уносит жизни более 5 млн человек. В 2013 г. в мире насчитывалось около 382 млн человек, больных СД, что на 11 млн больше, чем в 2012 г. К сожалению, СД продолжает быстро распространяться. По прогнозам экспертов ВОЗ, к 2035 г. число заболевших СД увеличится на 55 % и достигнет 592 млн [1, 5, 9, 10].
Микро- и макрососудистые нарушения, развивающиеся при СД, являются основной причиной инвалидности и смертности этого контингента пациентов. Среди основных нарушений функционирования сосудов при СД отмечается дисбаланс между процессами констрикции и дилатации вследствие нарушения функционирования эндотелиальных и гладкомышечных клеток (ГМК) сосудистой стенки. Большинство исследований в этом направлении позволяюет утверждать, что основной причиной развития сосудистой дисфункции в условиях СД является гипергликемия [13, 14], хотя имеются данные, указывающие на то, что одной гипергликемии может быть недостаточно [16].
Вещества, обладающие антиоксидантными и антигипоксическими свойствами, могут оказывать положительное влияние на углеводный обмен при СД [4, 6, 11]. В этом плане наше внимание привлек отечественный препарат бензофурокаин (БФК; этилового эфира 5-окси-6-диметиламинометил-2-метил-4-хлорбензофуран-3-карбоновой кислоты тартрат), обладающий как вышеотмеченными свойствами, так и антикининовым, антисеротониновым и антигистаминным действием; способен активировать нуклеиновый и энергетический обмен, повышать выживаемость животных (собак) при остром экспериментальном панкреатите [2, 7, 8, 12].
Целью настоящей работы явилось выявление способности БФК проявлять антидиабетическое (гипогликемическое) действие и влиять на эндотелий-зависимую вазодилатацию, являющуюся основным показателем функционирования эндотелия [15], и К + -проводимость плазматической мембраны ГМК – основного фактора гиперполяризации этих клеток и расслабления сосудов [17].
Материалы и методы исследования
СД вызывали у взрослых самцов крыс линии Вистар (190–210 г) однократным внутрибрюшным введением стрептозоцина (AppliChem, Дармштадт, Германия) в дозе 65 мг/кг. Определение СД осуществляли по наличию гипергликемии. Концентрацию глюкозы в плазме крови измеряли каждый месяц после инъекции стрептозоцина и в день эксперимента у всех исследуемых групп животных. Стрептозоцин растворяли в цитратном буферном растворе, содержащем 0,9 % NaCl и 10 ммоль цитрата, рН = 4,6. В эксперимент животных брали на 30 ± 7 и на 90 ± 7 день после индукции СД.
Уровень глюкозы (УГ) в крови контрольных (n = 8) и диабетических крыс (n = 32) измеряли до инъекции стрептозоцина экспериментальной группе животных, через каждые 30 суток в течение 3-х месяцев развития СД и в день эксперимента при помощи электронного глюкозометра Bionime Rightest GS300 (Bionime Gmbh, Швейцария). В период введения БФК диабетическим крысам (n = 16) УГ в крови измеряли каждый день у всех групп животных. Измерения УГ проводили утром после 3-часового голодания, пробу крови брали из хвоста животных.
БФК вводили животным внутримышечно в дозе 15 мг/кг на раннем (30 дней, n = 8) и позднем (90 дней, n = 8) сроке развития СД. БФК растворяли в физиологическом растворе и вводили в объеме 200 мкл два раза в день на протяжении 5 дней. Животных брали в эксперимент через 2 дня после последнего введения БФК.
Регистрацию тонуса сосудов проводили на сегментах грудного отдела аорты взрослых самцов крыс линии Вистар (190–210 г). После предварительной анестезии (кетамин 45 мг/кг, ксилазин 10 мг/кг) животных подвергали эвтаназии путём декапитации с последующим обескровливанием. После этого грудную клетку вскрывали, выделяли аорту и переносили ее в раствор Кребса следующего состава (в ммоль/л): 133 NaCl, 16,3 NaHCO3, 4,7 KCl, 1,05 MgCl2 × 6Н2О, 1,38 NaH2PO4, 2,75 CaCl2, 7,82 глюкоза, 10 HEPES (рН 7,4), при температуре 18–23 °С. Для сосудов животных с СД концентрация глюкозы в растворе была увеличена до 25 ммоль/л. Грудной отдел аорты очищали от жировой и соединительной ткани и нарезали на кольцевые сегменты шириной 1–2 мм.
Регистрацию сократительной активности сосудистых препаратов осуществляли в изометрическом режиме при помощи датчиков напряжения (Danish Myo Technology, Aarhus, Дания) и компьютерной программы LabScribe 2 (World Precession Instrument Inc., США).
Сосудистые сегменты размещали в рабочей плексигласовой камере объёмом 1 мл с проточным буферным раствором, где закреплялись на стальных крючках, один из которых был стационарно прикреплён к стенке камеры, а другой соединён со штоком тензодатчика. Для получения оптимальной силы сокращения сосудистые сегменты пассивно растягивали с силой 1300–1400 мг и периодически стимулировали раствором Кребса, содержащим 60 ммоль/л КСl (гиперкалиевый раствор, ГК60) до достижения стабильных сократительных ответов.
Сосудистые сегменты в камере перфузировали буферным раствором с постоянной скоростью 1,5 мл/мин при помощи 4-канального перистальтического насоса IPS ISM 930 «Ismatec» (Германия) при температуре 37 °С. Для определения эндотелий-зависимой вазодилатации использовали аппликацию ацетилхолина (АХ) в концентрации 10–1 –10–4 М на препараты, предварительно сокращённые фенилэфрином (ФЭ) в концентрации 10–6 М. Аппликацию всех использованных фармакологических агентов осуществляли при помощи перфузионной системы.
Величины средней эффективной концентрации АХ представлены как отрицательный логарифм концентрации АХ, требуемой для развития полумаксимального ответа (pD2). Расчёт этого параметра производился при помощи программы Origin 8.1 (OriginLab Corporation, США) с использованием следующей формулы:
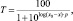
где T – нормализованный уровень тонуса (выраженный как проценты от начального уровня сокращения препаратов) при концентрации исследуемого вещества x (выраженного как негативный логарифм); x0 – средняя точка кривой доза-эффект (т.е. T = 50 %); p – фактор наклона кривой. Итоговые значения pD2 были получены усреднением pD2, рассчитанных отдельно для каждого сосудистого препарата.
Изучение трансмембранных К+-токов проводили с использованием метода фиксации мембранного потенциала (patch-clamp). Гладкомышечные сосудистые клетки (ГМК) выделяли из отпрепарированой грудной аорты крыс. Для этого сосудистые сегменты выдерживали в течение 5–10 мин в номинально бескальциевом буферном растворе следующего состава (в ммоль/л): 140 NaCl, 5,9 KCl, 2,5 MgCl2, 11,5 глюкозы, 10 HEPES (pH 7,4). После этого сегменты аорты разрезали на фрагменты размером 2×2 мм и инкубировали в течение 33 мин при температуре 37 °С в номинально бескальциевом буферном растворе, содержащим коллаген типа ІА (2 мг/мл), проназу Е (0,5 мг/мл), бычий сывороточный альбумин (2 мг/мл). Затем в номинально бескальциевом буферном растворе фрагменты ткани отмывали от ферментов и выделяли ГМК путём многократного пипетирования. Аликвоты полученных ГМК помещали в буферный раствор с нормальной концентрацией Са2+, содержащий (в ммоль/л): 140 NaCl, 5,9 KCl, 1,2 MgCl2, 2,5 CaCl2, 10 HEPES, 11,5 глюкозы (pH = 7,4). ГМК, которые сохраняли при температуре 5 °С, оставались в функциональном состоянии в течение 4 часов.
Выходящий трансмембранный ионный ток измеряли при помощи метода фиксации потенциала (patch-clamp) в модификации «whole-cell perforated patch» с использованием амфотeрицина Б. Регистрацию ионных токов и стимуляцию клеток проводили при помощи усилителя Axopatch 200B (Axon Instruments Inc., США), аналого-цифрового преобразователя (АЦП) Digidata 1200B (Axon Instruments Inc., США) и программного обеспечения pClamp Software (V.6.02, Axon Instruments Inc., США). Сигнал из усилителя проходил через фильтр низких частот (частота среза 2 кГц) на АЦП и оцифровывался с частотой дискретизации 10 кГц. Типичные значения мембранного сопротивления клеток составляли 2–5 ГОм. Индифферентный Ag-AgCl-электрод размещали непосредственно в камере объёмом 200 мкл. В начале каждого эксперимента контактный электронный потенциал между раствором в пипетке и раствором в камере был электрически скорректирован до нуля соответствующей системой усилителя. В ходе эксперимента при регистрации токов утечка не компенсировалась, все клетки с низким сопротивлением контакта (присутствием утечки тока) были исключены из анализа. Полученные величины тока были нормированы по величине ёмкости мембраны, которая пропорциональна площади мембраны, и выражены в пА/пФ. Все эксперименты проводили при температуре 20 °C.
Микропипетки изготовляли из боросиликатного стекла (Clark Electromedical Instruments, Pangbourne Reading, Великобритания) и заполняли раствором следующего состава (в ммоль/л): 140 KCl, 10 NaCl, 1,2 MgCl2, 10 HEPES, 2 EGTA, 1 CaCl2 (итоговая концентрация свободного [Ca2+ ] составляла приблизительно 170 нМ), 11,5 D-глюкоза (pH 7,3), амфотерицин В 250 мкг/мл. Сопротивление микропипеток 2,5–5 МОм. Внеклеточный раствор содержал (в ммоль/л): 140 NaCl, 5,9 KCl, 2,5 CaCl2, 1,2 MgCl2, 10 HEPES, 11,5 D-глюкозы (pH 7,4).
Сравнение полученных величин (M ± m) проводили с использованием t-критерия Стьюдента для парных и непарных измерений. Различия считали статистически достоверными, если величина р < 0,05. Расчёты проводили с использованием программ Origin 8.1 (OriginLab Corporation, США) и EXEL 5.0 (Microsoft, США).
Результаты исследования и их обсуждение
Влияние БФК на концентрацию глюкозы в плазме крови крыс с экспериментальным СД. До введения стрептозоцина УГ составлял 6,3 ± 0,41 ммоль/л (n = 40). В день эксперимента УГ после 30-го дня развития СД был равен 27,9 ± 2,55 ммоль/л (n = 16, р < 0,05), а после 90-го – 32,6 ± 0,38 ммоль/л (n = 16, р < 0,05) по сравнению с контрольными животными (6,7 ± 0,38 ммоль/л, n = 8). Мониторинг УГ производили ежедневно в течение всего курса введения БФК. Введение БФК не влияло на УГ в крови диабетических крыс после 90-го дня развития СД, в то время как на ранних сроках СД (до 30 ± 7 дней) способствовало транзиторным изменениям УГ. Так, на 4–5-й день применения БФК способствовал достоверному снижению УГ до 20,2 ± 1,29 ммоль/л (n = 8, р < 0,05) по сравнению с диабетическими животными. Через 2 дня УГ также демонстрировал достоверные отличия от диабетических нелеченных животных и составлял 20,9 ± 1,93 ммоль/л (n = 8, р < 0,05) (рис. 1).
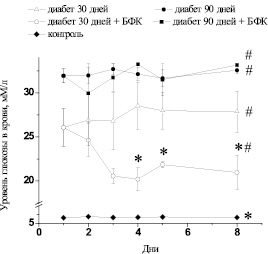
Рис. 1. Уровень глюкозы в крови контрольных животных (контроль); диабетических животных на 30-й (диабет 30 дней) и 90-й день после введения стрептозоцина (диабет 90 дней); диабетических животных после курсового введения БФК (диабет 30 дней + БФК; диабет 90 дней + БФК). # – р < 0,05 по отношению к контролю. * – р < 0,05 по отношению к диабетическим животным
В день эксперимента УГ в крови диабетических крыс на позднем сроке развития СД после курсового введения БФК составлял 33,2 ± 0,15 ммоль/л (n = 8, р > 0,05) и достоверно не отличался от значений, зарегистрированных у диабетических животных без введения БФК (рис. 1).
Изучение эндотелий-зависимой дилатации изолированных препаратов аорты. Аппликация АХ в концентрации 10–10– 3⋅10–5 ммоль/л вызывала дозозависимую дилатацию изолированных препаратов аорты с максимумом дилатации 96,5 ± 3,05 % от преконстрикции препаратов, вызванной ФЭ в концентрации 10–6 ммоль/л (n = 8) (рис. 2). Значение pD2 составляло при этом 7,59 ± 0,08 (n = 8).
В препаратах аорты крыс с экспериментальным СД наблюдалось достоверное угнетение эндотелий-зависимой дилатации на АХ с максимумом 76,88 ± 3,98 % (n = 8, р < 0,05) при длительности диабета 30 ± 7 дней (рис. 2) и 78,05 ± 5,57 % (n = 8, р < 0,05) при длительности диабета 90 ± 7 дней (рис. 3). Значение pD2 при этом по отношению к контрольному значению уменьшалось до 7,13 ± 0,09 (n = 8, р < 0,05) и 6,7 ± 0,18 (n = 8, р < 0,05). Смещение кривой доза-эффект, характеризующееся параметром pD2, является показателем изменения чувствительности сосудистых препаратов к действию исследуемого вещества. В данном случае кривая сдвигается влево.
Курсовое введение БФК не вызывало изменений в максимальной амплитуде эндотелий-зависимой дилатации препаратов аорты диабетических крыс под действием АХ как на ранних (рис. 2), так и на поздних сроках развития СД (рис. 3). Максимум вазодилатации при этом составлял 77,53 ± 7,64 (n = 8, р < 0,05) и 78,39 ± 7,95 % (n = 8, р < 0,05) соответственно. Вместе с тем наблюдалось увеличение значения pD2 до 7,57 ± 0,19 (n = 8, р > 0,05) на ранних сроках развития СД, что не имело достоверных отличий от показателей здоровых животных, и до 7,05 ± 0,21 (n = 8, р < 0,05) на поздних сроках развития СД. Полученные данные свидетельствуют о том, что курсовое введение БФК диабетическим животным не влияет на максимальную амплитуду угнетенной в условиях СД эндотелий-зависимой дилатации аорты, однако повышает чувствительность аорты к действию АХ. Следует отметить, что положительный эффект БФК зависит от срока развития СД.
Изучение суммарного выходящего К+-тока изолированных ГМК аорты. Исходя из показателей УГ, которые свидетельствуют об эффективности БФК именно на ранних сроках развития СД, изучение суммарного выходящего тока проводили на диабетических животных после 30-го дня от введения стрептозоцина.
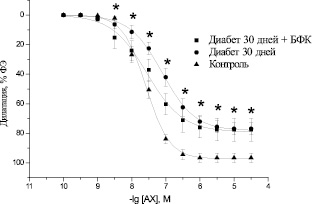
Рис. 2. Дилататорные реакции изолированных сегментов аорты крысы, предварительно сокращенных ФЭ (10–6 ммоль/л), под действием АХ (10–10 –3⋅10–5 ммоль/л) в аорте контрольных животных (контроль), диабетических животных на ранних сроках развития СД (диабет 30 дней) и диабетических животных после курсового введения БФК (диабет 90 дней + БФК). * – р < 0,05 по отношению к контролю
Рис. 3. Дилататорные реакции изолированных сегментов аорты крысы, предварительно сокращенных ФЭ (10–6 ммоль/л), под действием АХ (10–10 –3⋅10–5 ммоль/л) в аорте контрольных животных (контроль), диабетических животных на поздних сроках развития диабета (диабет 90 дней) и диабетических животных после курсового введения БФК (диабет 90 дней + БФК). * – р < 0,05 по отношению к контролю
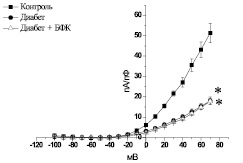
Рис. 4. Вольт-амперная характеристика суммарного выходящего К+-тока мембраны изолированных ГМК аорты контрольных крыс (контроль), диабетических животных после 30-го дня развития СД (диабет) и диабетических животных после курсового введения БФК (диабет + БФК). * – р < 0,05 по отношению к контролю
Суммарный выходящий К+-ток фиксировали в ответ на ступенчатую деполяризацию мембраны изолированных ГМК от –100 до 70 мВ через каждые 3 с при поддерживаемом потенциале – 60 мВ. Суммарный выходящий К+-ток в ГМК контрольных животных при максимальном уровне деполяризации мембраны –70 мВ составлял 51,4 ± 4,76 пА/пФ (n = 8). Плотность выходящего тока в ГМК аорты диабетических животных после 30-го дня развития СД была ниже, чем в контроле, и составляла 18,1 ± 1,84 пА/пФ (n = 10, р < 0,05). Курсовое введение БФК не вызывало изменений плотности выходящего К+-тока, которая при максимальном уровне деполяризации –70 мВ не отличалась от показателей диабетических животных и составляла 17,8 ± 1,38 пА/пФ (n = 14, р > 0,05) (рис. 4).
Заключение
Таким образом, в условиях СД, индуцированного стрептозоцином у крыс, БФК проявляет гипогликемическое действие на ранних сроках СД (30 дней), при этом имеет место тенденция к восстановлению эндотелий-зависимой дилатации ГМК аорты. БФК не оказывает значимого действия на эти показатели при поздних сроках СД (90 дней) и не влияет на функционирование К+-каналов плазматической мембраны ГМК аорты в оба срока исследования.
Способность БФК снижать УГ в крови животных в условиях СД, вызванного стрептозоцином, может быть обусловлена наличием у БФК антиоксидантных, антигипоксантных и противовоспалительных свойств, а также способности повышать активность НАД и НАДФ-зависимых дегидрогеназ в печени [2] и, возможно, в поджелудочной железе. Принято считать, что механизм диабетогенного действия стрептозоцина связан со снижением уровня НАД и НАДФ в b-клетках островков Соболева – Лангерганса поджелудочной железы вследствие активации поли-АДФ-рибосинтетазы, использующей НАД в качестве субстрата, что и ведет к некрозу метаболически активной ткани железы [3].
Рецензенты:
Тюренков И.Н., д.м.н., профессор, заведующий кафедрой фармакологии и биофармации, ФУВ ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград;
Спасов А.А., д.м.н., профессор, зав. кафедрой фармакологии, ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград.
Библиографическая ссылка
Бедросова К.А., Галенко-Ярошевский П.А., Попков В.Л., Соловьев А.И., Уваров А.В. АНТИДИАБЕТИЧЕСКИЕ СВОЙСТВА БЕНЗОФУРОКАИНА И ВЛИЯНИЕ ЕГО НА ЭНДОТЕЛИАЛЬНУЮ ДИСФУНКЦИЮ И К+-КАНАЛОПАТИЮ АОРТЫ В ЭКСПЕРИМЕНТЕ // Фундаментальные исследования. – 2015. – № 1-4. – С. 689-694;URL: https://fundamental-research.ru/ru/article/view?id=37402 (дата обращения: 20.04.2024).



