Репарация костной ткани является одной из важнейших проблем регенеративной медицины, особенно травматологии, реконструктивной хирургии, стоматологии [4]. Ежегодно в мире травматизм, связанный с переломами костей, растет. При этом большой проблемой является высокая степень инвалидизации, закономерно увеличивающаяся с возрастом пострадавших [3]. В связи с этим перед современной медициной возникает задача стимуляции посттравматической регенерации костной ткани, особенно при ограничении собственных компенсаторных реакций организма, обусловленном различными этиологическими факторами [1]. На процесс заживления переломов костей большое значение оказывает качественное и количественное содержание белков межклеточного матрикса костной ткани в области перелома на различных сроках остеорепарации, продуцируемых клетками фибробластического, хондробластического и остеобластического дифферонов. Местная стимуляция пролиферативной активности клеток выше перечисленных дифференов – один из путей решения задачи активации посттравматической остеорепарации. С этой целью используют стимуляторы регенерации – репаранты, к которым относятся факторы роста и, в частности, фактор роста фибробластов (ФРФ) [6].
В 2011 году на кафедре травматологии и ортопедии Оренбургской государственной медицинской академии разработан препарат «Винфар», содержащий ФРФ (Патент № 2427644 от 27.08.2011), выделенный из метаболитов штамма бактерий Bacillus subtilis 804.
Цель исследования – изучение особенностей динамики изменений содержания коллагеновых и неколлагеновых белков межклеточного матрикса в костной мозоли при заживлении перелома диафиза кости в условиях применения препарата «Винфар».
Материалы и методы исследования
Экспериментальное исследование проведено на 70 половозрелых крысах-самцах линии «Вистар». Все исследования на животных были выполнены в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (приказ Минвуза СССР от 13.11.1984 г. № 724). Животным под ингаляционным наркозом формировали открытый поперечный перелом средней трети диафиза левой большеберцовой кости. В опытной группе (ОГ) животным в область перелома на 1 и 2 сутки эксперимента вводили по 0,5 мл препарата «Винфар», в контрольной группе (КГ) – 0,5 мл физ. раствора. Осуществлена естественная иммобилизация посредством сохранившей целостность малоберцовой кости. Животных выводили из опыта на 3, 14, 21, 28, 44 и 61 сутки. Фрагменты отломков костей с костной мозолью фиксировали в 10 % нейтральном формалине (на фосфатном буфере) с последующей декальцинацией смесью: Трилон Б + 40 % NaOH + Н2O (дист.), обезвоживанием в спиртах возрастающей крепости, заливкой кусочков парафином – целлоидином и изготовлением гистосрезов толщиной 5,0 мкм. Исследования проводили с использованием гистологических, иммуногистохимических методов и морфометрии. Гистологическое исследование включало окраску гематоксилином Майера и эозином. При проведении иммуногистохимических методов исследования для выявления экспрессии Osteocalcin (маркер созревания костной ткани), collagen II (маркер хондрогенеза) и collagen I (в нашем исследовании – маркер остеогенеза) использовались соответственно антитела anti-Osteocalcine («SPRING Bioscience», США), anti-Collagene II Type и anti-Collagene I Type («GeneTex», США). Используемая система детекции – Reveal Polyvalent HRP – DAB Detection System («SPRING Bioscience», США). Подсчет площади остеокальцина и коллагеновых волокон производился в относительных значениях (относительная объёмная плотность – ООП), как отношение площади остеокальцина и/или коллагеновых волокон к общей площади тканевых элементов, в пределах исследуемого гистосреза на 1 микрофотографии (равной 1 полю зрения) при увеличении х300 минимум в 5 полях зрения (микрофотографий) для каждого показателя. При проведении статистической обработки результатов вычисляли средние значения абсолютных и относительных величин (M), ошибки средних величин (m) и t-критерий Стьюдента. Различия считали достоверно значимыми, при уровне вероятности р < 0,05.
Результаты исследования и их обсуждение
На 3 сутки у животных контрольной группы (КГ) в периостальной зоне перелома синтез остеокальцина незначителен и составляет 0,218 ± 0,009 %, тогда как в опытной группе (ОГ) ООП остеокальцина в 2 раза выше – 0,423 ± 0,013 % (рис. 1). Экспрессия коллагена I типа в ОГ (ООП 9,40 ± 0,62 %) больше таковой группы контроля (ООП 3,92 ± 0,31 %) почти в 3 раза. У животных контрольной группы ООП коллагена II типа составляет 4,77 ± 0,11 %, что незначительно превышает данный показатель в ОГ (ООП коллагена II типа 4,03 ± 0,08 %).
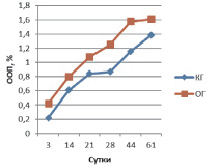
Рис. 1. ООП остеокальцина в периостальной мозоли
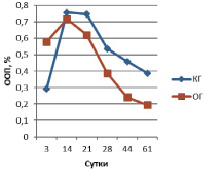
Рис. 2. ООП остеокальцина в эндостальной мозоли
В эндостальной костной мозоли на 3 сутки эксперимента содержание остеокальцина в ОГ вдвое больше КГ и незначительно превышает аналогичные показатели периостальной зоны (ООП остеокальцина КГ 0,293 ± 0,011 % и ООП остеокальцина КГ 0,579 ± 0,013 %) (рис. 2). ООП коллагена I типа в эндостальной мозоли в обеих группах троекратно, а ООП коллагена II типа – четырехкратно меньше, чем в периостальной мозоли (рис. 3, 4).
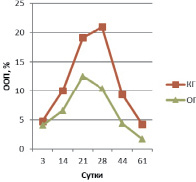
Рис. 3. ООП коллагена II типа в периостальной мозоли
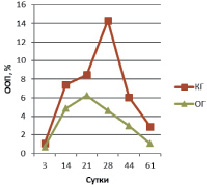
Рис. 4. ООП коллагена II типа в эндостальной мозоли
На 14 сутки у животных КГ в периостальной зоне перелома ООП остеокальцина составляет 0,612 ± 0,024 %, а в ОГ ООП остеокальцина – 0,802 ± 0,031 %. Экспрессия коллагена I типа в ОГ (ООП 15,21 ± 0,23 %) на этом сроке, по сравнению с предыдущим, значительно возрастает и по-прежнему больше таковой группы контроля (ООП 9,24 ± 0,12 %). У животных контрольной группы ООП коллагена II типа составляет 10,04 ± 0,16 %, что почти двукратно превышает данный показатель в ОГ (ООП коллагена II типа 6,58 ± 0,27 %).
В эндостальной костной мозоли на 14 сутки эксперимента содержание остеокальцина в КГ (ООП 0,757 ± 0,007 %) незначительно превышает ООП остеокальцина ОГ (0,718 ± 0,008 %). ООП коллагена I типа эндостальной мозоли в КГ – 3,33 ± 0,08 %, в ОГ – 6,97 ± 0,13 %. ООП коллагена II типа КГ – 7,41 ± 0,22 %, в ОГ – 4,86 ± 0,39 %.
На 21 сутки у животных КГ в периостальной зоне перелома ООП остеокальцина составляет 0,841 ± 0,035 %, а в ОГ ООП остеокальцина – 1,078 ± 0,027 %. Экспрессия коллагена I типа в ОГ (ООП 20,7 ± 1,01 %) на этом сроке возрастает и по-прежнему больше таковой группы контроля (ООП 11,25 ± 1,12 %). У животных контрольной группы ООП коллагена II типа составляет 19,16 ± 0,98 %, в ОГ ООП коллагена II типа – 12,55 ± 0,52 %, т.е. происходит двукратное увеличение экспрессии коллагена II по сравнению с предыдущим сроком.
В эндостальной костной мозоли на 21 сутки эксперимента содержание остеокальцина в КГ (ООП 0,747 ± 0,008 %) незначительно превышает ОГ (ООП 0,621 ± 0,013 %), ООП остеокальцина которой меньше значений предыдущего срока, что означает более раннее (по сравнению с КГ) начало редукции эндостальной мозоли. ООП коллагена I типа эндостальной мозоли в КГ – 8,47 ± 0,89 %, в ОГ – 19,24 ± 1,72 %. ООП коллагена II типа КГ – 8,44 ± 0,36 %, в ОГ – 6,25 ± 0,32 %.
На 28 сутки у животных КГ в периостальной зоне перелома содержание остеокальцина по сравнению с предыдущим сроком почти не изменяется и составляет 0,866 ± 0,023 %, тогда как в ОГ ООП остеокальцина увеличивается на четверть и достигает 1,253 ± 0,056 %. Экспрессия коллагена I типа в ОГ (ООП 29,85 ± 1,03 %) на этом сроке возрастает на треть и по-прежнему больше таковой группы контроля (ООП 16,23 ± 1,08 %). У животных контрольной группы ООП коллагена II типа составляет 21,01 ± 1,12 %, в ОГ ООП коллагена II типа – 10,38 ± 1,02 %, т.е. в ОГ в отличие от КГ происходит уменьшение экспрессии коллагена II по сравнению с предыдущим сроком, что, вероятно, связано с хондролизом хряща и остеогенной реорганизацией периостальной мозоли (это подтверждается увеличением ООП коллагена I типа, см. выше).
В эндостальной костной мозоли на 28 сутки эксперимента содержание остеокальцина уменьшается в обеих группах животных, но тем не менее в КГ ООП (0,538 ± 0,019 %) двукратно превышает ООП остеокальцина ОГ (0,288 ± 0,012 %), что подтверждает более выраженную редукцию эндостальной мозоли в опытной группе по сравнению с контролем. ООП коллагена I типа эндостальной мозоли в КГ продолжает увеличиваться – 10,52 ± 0,07 %, тогда как в ОГ двукратно уменьшается – 12,09 ± 0,22 %, так же, как и уменьшение содержания остеокальцина, подтверждая развитие эндостальной мозоли в КГ и выраженность процесса её редукции в ОГ на данном сроке эксперимента. ООП коллагена II типа КГ – 14,32 ± 0,72 %, в ОГ – 4,61 ± 0,41 %.
На 44 сутки у животных КГ в периостальной зоне перелома ООП остеокальцина составляет 1,156 ± 0,034 %, а в ОГ ООП остеокальцина уже на данном сроке достигает значений (ООП 1,582 ± 0,026 %), близких с ООП нормальной (около 1,6 %) костной ткани [2]. Экспрессия коллагена I типа в ОГ (ООП 42,43 ± 2,21 %) на этом сроке возрастает на четверть и по-прежнему двукратно больше таковой группы контроля (ООП 21,23 ± 1,94 %) (рис. 5). У животных контрольной группы ООП коллагена II типа составляет 9,35 ± 0,97 %, в ОГ ООП коллагена II типа – 4,33 ± 0,82 %, т.е. происходит уменьшение экспрессии коллагена II в обеих группах по сравнению с предыдущим сроком, из-за остеогенной реорганизацией периостальной мозоли, что также подтверждается увеличением ООП коллагена I типа, см. выше.
В эндостальной костной мозоли на 44 сутки эксперимента содержание остеокальцина продолжает уменьшаться в обеих группах животных и по прежнему, в КГ ООП (0,460 ± 0,017 %) двукратно превышает ООП остеокальцина ОГ (0,242 ± 0,028 %) из-за более выраженной редукции эндостальной мозоли в ОГ по сравнению с контролем. ООП коллагена I типа эндостальной мозоли в КГ все еще увеличивается – 12,2 ± 0,49 %, тогда как в ОГ уменьшается – 8,75 ± 0,53 %, подтверждая развитие эндостальной мозоли в КГ и продолжение процесса её редукции в ОГ на данном сроке эксперимента. ООП коллагена II типа КГ – 6,04 ± 0,12 %, в ОГ – 2,97 ± 0,47 %.
На 61 сутки у животных КГ в периостальной зоне перелома ООП остеокальцина увеличивается на четверть по сравнению с предыдущим сроком и достигает 1,384 ± 0,028 %, а в ОГ ООП остеокальцина почти не изменяется, составляя 1,612 ± 0,031 %. Экспрессия коллагена I типа в ОГ (ООП 69,25 ± 2,23 %) на этом сроке возрастает более чем на треть и на треть больше таковой группы контроля (ООП 46,09 ± 1,74 %), на данном сроке достигая значений близких с ООП коллагена I нормальной (около 70,0 %) костной ткани [2]. У животных контрольной группы ООП коллагена II типа составляет 4,19 ± 0,13 %, в ОГ ООП коллагена II типа – 1,68 ± 0,09 %, т.е. происходит двукратное уменьшение экспрессии коллагена II в обеих группах по сравнению с предыдущим сроком, из-за остеогенной реорганизации периостальной мозоли, что также подтверждается увеличением ООП коллагена I типа, см. выше.

Рис. 5. А – контрольная группа, периостальная зона перелома (мозоль), иммуногистохимическая реакция на выявление экспрессии коллагена I типа (коричневого цвета), об. ув. х 600; Б – опытная группа, периостальная зона перелома (мозоль), иммуногистохимическая реакция на выявление экспрессии коллагена I типа (коричневого цвета), об. ув. х 600
В эндостальной костной мозоли на 44 сутки эксперимента содержание остеокальцина продолжает уменьшаться в обеих группах животных и по прежнему в КГ ООП (0,388 ± 0,008 %) двукратно превышает ООП остеокальцина ОГ (0,195 ± 0,017 %) из-за более выраженной редукции эндостальной мозоли в ОГ по сравнению с контролем. ООП коллагена I типа эндостальной мозоли в КГ начинает уменьшаться только на данном сроке – 8,87 ± 0,05 %, подтверждая только начавшийся процесс редукции эндостальной мозоли, тогда как в ОГ ООП коллагена I типа составляет 8,01 ± 0,02 %, достигая значений близких с ООП коллагена I нормальной костной ткани (около 7,0–8,0 %). ООП коллагена II типа КГ – 2,9 ± 0,03 %, в ОГ – 1,09 ± 0,02 %.
Заключение
В обеих сравниваемых группах сращение отломков кости проходит хрящевую стадию, подтверждаемую экспрессией коллагена II типа, но в ОГ из-за преобладания интрамембранного остеогенеза показатели синтеза коллагена II на всех сроках эксперимента значительно ниже таковых по сравнению с контролем. ООП коллагена II типа при сопоставимых сроках в эндостальной мозоли всегда меньше таковой в периостальной мозоли, что объясняется лучшей неоваскуляризацией эндостальной костной мозоли и, следовательно, оксигенацией эндостальной зоны перелома из-за более значительной миграции предшественников эндотелиоцитов со стороны эндоста и красного костного мозга. Уменьшение в эндостальной мозоли ООП коллагена I и II типа в опыте на 28, а в КГ только на 44 сутки эксперимента объясняется её редукцией, соответственно более ранней в ОГ. При этом уменьшение ООП остеокальцина происходит в более ранние сроки по сравнению с коллагеновыми белками, что, вероятно, связано с меньшей молекулярной массой остеокальцина и, следовательно, большей скоростью катаболизма. Отсутствие значимого увеличения остеокальцина в периостальной зоне перелома у животных ОГ в отличие от КГ на 61 сутки эксперимента (по сравнению с 44 сутками) подтверждает завершение реорганизации периостальной костной мозоли в компактное вещество кортикальной кости диафиза.
Таким образом, динамика изменений коллагеновых и неколлагеновых белков эндостальной и периостальной мозолей в процессе заживления перелома диафиза большеберцовой кости подтверждает более ранние сроки консолидации при применении препарата «Винфар», что, вероятно, обусловлено мощным ангиогенным воздействием входящего в его состав ФРФ, а также влиянием на пролиферативную активность клеток хондрогенного и остеогенного дифферонов, ответственных за синтез соответствующих белков межклеточного матрикса.
Рецензенты:
Стадников А.А., д.б.н., профессор, заведующий кафедрой гистологии, цитологии и эмбриологии, Оренбургский государственный медицинский университет, г. Оренбург;
Красиков С.И., д.м.н., профессор, заведующий кафедрой химии и фармацевтической химии, Оренбургский государственный медицинский университет, г. Оренбург.
Библиографическая ссылка
Миханов В.А., Полякова В.С., Мхитарян Е.Е., Мещеряков К.Н., Бакаева Н.Р., Шурыгина Е.И. ИММУНОГИСТОХИМИЧЕСКИЙ АНАЛИЗ ДИНАМИКИ ИЗМЕНЕНИЙ СОДЕРЖАНИЯ КОЛЛАГЕНОВЫХ И НЕКОЛЛАГЕНОВЫХ БЕЛКОВ МЕЖКЛЕТОЧНОГО МАТРИКСА В ПРОЦЕССЕ ОСТЕОРЕПАРАЦИИ ПРИ ИСПОЛЬЗОВАНИИ ПРЕПАРАТА «ВИНФАР» // Фундаментальные исследования. – 2015. – № 1-8. – С. 1634-1638;URL: https://fundamental-research.ru/ru/article/view?id=38263 (дата обращения: 25.04.2024).



