Пленкообразующие субстанции находят применение в медицине, ветеринарии и пищевой промышленности [8]. Они перспективны при разработке биодеградируемых съедобных пленкообразующих материалов, обладающих барьерными свойствами. Этим требованиям отвечают структурные полимеры в составе панцирьсодержащего сырья (ПСС) гидробионтов – хитин и его простейшее производное хитозан, получаемый деацетилированием исходного биополимера (рис. 1). Барьерные свойства хитозановых субстанций обусловлены наличием у них бактериостатических и антиоксидантных свойств [3, 4].
Формовочные свойства хитозансодержащих субстанций зависят от молекулярной массы хитозана, степени его деацетилирования, массовой доли сухих веществ, природы и объемной доли органической кислоты в составе дисперсионной среды [6, 7].
Флуоресцентная спектроскопия является одним из высокочувствительных методов, позволяющих детектировать вещества в очень низких концентрациях с целью их идентификации. Она является чрезвычайно информативным методом, поскольку позволяет получать данные о структурных свойствах и ориентации, конформационной подвижности, комплексообразовании и в целом о межмолекулярных взаимодействиях. К достоинствам флуоресцентной спектроскопии относится также возможность неразрушающего контроля образца в ходе исследования [1, 2, 5].
Цель работы: обоснование условий идентификации хитозана в составе пленкообразуюших субстанций с использованием методов флуоресцентной спектроскопии.
Материалы и методы исследования
В качестве объектов исследования использовали образцы хитозана производства ЗАО «Биопрогресс» (ТУ 9289-067-00472124-03) с различной молекулярной массой: образец I (Мм = 260 кДа) и образец II (Мм = 350 кДа).
Пленкообразующие субстанции хитозана с массовой долей полимера 2 % получали путем диспергирования в органических кислотах: уксусной, янтарной, молочной, лимонной. Использовали растворы кислот с массовой долей 2–4 %.
Приготовление раствора 1-анилин-8-нафталинсульфаната (АНС): в связи с выраженным гидрофобным характером АНС в качестве растворителя использовали водно-спиртовой раствор с соотношением «спиртовая фаза: водная фаза – 1:9». Раствор АНС вносили в хитозановые дисперсии в дозировке 100 мкл на 2 см3 дисперсии.
Концентрацию АНС в образцах определяли спектрофотометрически на спектрофотометре «Промэколаб» в стеклянной кювете по воде, при длине волны 360 нм по следующей формуле:
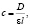
где ε – коэффициент экстинкции, l – длина кюветы.
Спектральные свойства хитозановых дисперсий и пленок изучали на флуоресцентном двухлучевом сканирующем спектрофотометре PERKIN ELMER Lambda 800. Спектры флуоресценции регистрировали при 20 °С в зеркальной кювете с длиной оптического пути 1 см в диапазоне 400–550 нм (при возбуждении на 370 нм) и 430–500 нм (при возбуждении на 380 нм). Светопропускающие щели устанавливали по 8 мм. Образцы для флуоресцентных исследований, содержащие хитозан и гидрофобный краситель с концентрацией 1*10-6 моль/дм3, инкубировали в течение 2–3 часов при 20 °С. Спектры флуоресценции растворов красителей и хитозансодержащих композиций вычитались из спектров флуоресценции образцов.
При определении степени поляризации использовали длины волн возбуждения 380 нм и излучения – 430 нм. Светопропускающие цели устанавливали по 8 нм.
Величину светорассеяния определяли на спектрофлуориметре аналогично предыдущим опытам (в зеркальных кюветах) при скрещенных монохроматорах: при одинаковой длине волны 560 нм (щель 8 нм в первом монохроматоре и 1 нм во втором) в канал регистрации попадал рассеянный свет, пропорциональный размерам частиц и их количеству.
Хитозановые пленочные покрытия готовили из хитозановых субстанций с добавлением АНС с концентрацией 1,56*10-6 моль/дм3 методом растекания на полиэтиленовой, либо стеклянной подложке с последующим испарением кислоты на воздухе. Пленки выдерживали до испарения кислоты при комнатной температуре в течение 36–48 ч. Для исследования пленки наносились на покровные стекла и помещались в стеклянные кюветы по диагонали.
Спектры флуоресценции снимали в диапазоне 430–500 нм, при длине волны возбуждения 310 нм. Щели устанавливали по 5 нм на возбуждение и по 2,5 нм на излучение.
Результаты исследования и их обсуждение
В связи с тем что хитозан не обладает флуоресцирующими свойствами, была проведена работа по выбору хромофора, способного в наибольшей степени связываться с биополимером. При этом определяющим требованием к хромофору в случае детекции хитозана является его гидрофобный характер.
Гидрофобный хромофор будет связываться с гидрофобными участками на поверхности полимера. Изменение окружающего хромофор растворителя непосредственно влияет на спектр флуоресценции и поглощения, поэтому свободный и связанный красители можно различить оптическими методами. Если краситель заряжен, то поверхностный потенциал будет непосредственно влиять на сродство красителя к субстанции (положительно заряженные зонды связываются хитозаном сильно, отрицательно заряженные – слабо). При изменении поверхностного потенциала сродство красителя к поверхности будет меняться, что можно зарегистрировать по изменению его оптических свойств.
В качестве зондов для измерения поверхностного потенциала хитозановых субстанций использовали следующие флуорофоры: рибофлавин, родамин С и 1-анилино-8-нафталинсульфоната (АНС). Наилучшие результаты получены с использованием в качестве зонда высокочувствительного к изменениям поверхностного заряда полимера отрицательно заряженного красителя АНС.
В данном случае свободный краситель обладает крайне низкой интенсивностью флуоресценции. Уменьшение поверхностного заряда полимера приводит к увеличению связывания АНС и разгоранию его флуоресценции.
С помощью устройства, подключенного к ПК, снимали спектры излучения при возбуждении λ1 = 370 нм и λ2 = 400 нм.
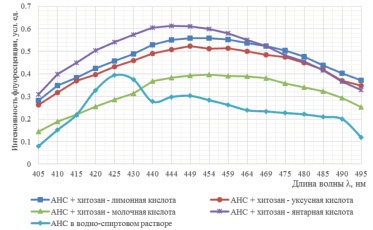
Светорассеяние определяли в условных единицах по контролю – водно-спиртовому раствору хитозана (0) при λ1 = λ2 = 560 нм (щели на входе – по 8 мм, щели на выходе по 1 мм). Результаты представлены на рис. 2.
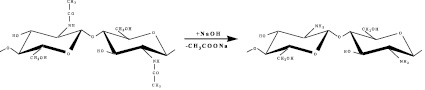
Рис. 1. Деацетилирование хитина с получением хитозана
а)
б)
Рис. 2. Спектры флуоресценции водно-спиртового раствора АНС в хитозановых дисперсиях: а – образец I; б – образец II
Спектральные характеристики кислоторастворимых субстанций хитозана
|
Вид системы |
Молекулярная масса хитозана, кДа |
Максимум флуоресценции, нм |
Полуширина спектра |
Рассеивание |
Вязкость, Пуаз |
|
АНС, водно-спиртовой раствор |
– |
425 |
85 |
0,01 |
– |
|
АНС + хитозан – уксусная кислота |
350 |
440 |
85 |
0,18 |
2,17 |
|
АНС + хитозан – лимонная кислота |
350 |
450 |
95 |
0,17 |
2,08 |
|
АНС + хитозан – янтарная кислота |
350 |
445 |
85 |
0,24 |
1,8 |
|
АНС + хитозан – молочная кислота |
350 |
450 |
83 |
0,51 |
0,67 |
|
АНС + хитозан – уксусная кислота |
260 |
445 |
102 |
0,11 |
2,43 |
|
АНС + хитозан – лимонная кислота |
260 |
450 |
105 |
0,10 |
2,38 |
|
АНС + хитозан – янтарная кислота |
260 |
450 |
95 |
0,12 |
1,86 |
|
АНС + хитозан – молочная кислота |
260 |
455 |
95 |
0,24 |
0,51 |
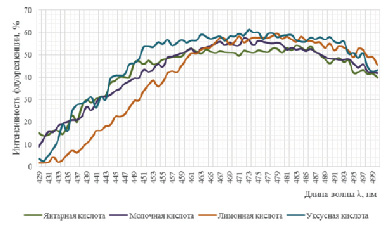
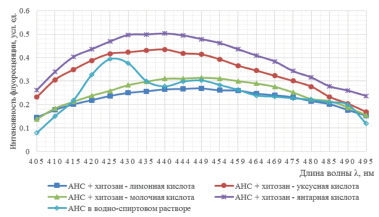
Рис. 3. Спектры флуоресценции АНС в хитозановых пленках, при формовании их из дисперсий в различных органических кислотах
Сдвиг максимума излучения в коротковолновую область по полученным графикам свидетельствует о том, что АНС практически полностью связался с молекулами хитозана. Установленный эффект впоследствии может быть использован при разработке методики детекции хитозана флуориметрическим способом.
Cпектры водно-спиртового раствора АНС, приведенные на рис. 2, получены с увеличением чувствительности прибора в 100 раз, следовательно, по полученным выше спектрам можно сделать вывод, что интенсивность флуоресценции в хитозановых композициях в 100 раз выше, чем интенсивность флуоресценции водно-спиртового раствора АНС, что свидетельствует о связывании АНС с молекулами хитозана. Молекулы красителя взаимодействуют с гидрофобными участками полимера. Неодинаковая интенсивность флуоресценции красителя в аналогичных хитозановых дисперсиях связана с различной молекулярной массой полимеров – образец I (Мм = 260 кДа), образец II (Мм = 350 кДа).
Соотношение спектральных характеристик полученных кислоторастворимых субстанций хитозана с его физико-химическими показателями представлено в таблице.
Установлено, что наиболее подходящим красителем для идентификации молекул хитозана спектральными методами является гидрофобный краситель 1-анили-8-нафталинсульфанат (АНС). Он перспективен для использования в качестве зонда в спектральных методах детекции хитозана.
В хитозановых пленках среда более полярна, чем в гелях, поэтому краситель АНС находится в более полярной фазе, что подтверждается сдвигом спектра в длинноволновую область с максимумом флуоресценции 470–480 нм (рис. 3).
Заключение
Изучены спектральные характеристики хитозановых субстанций, полученных с применением водных растворов органических кислот в диапазоне концентраций 2–4 %. Хитозановые субстанции получены в двух формах: дисперсии с массовой долей сухих веществ 2 % и плёнки. Ввиду того, что сам по себе хитозан не обладает флуоресцирующими свойствами, обоснован выбор гидрофобного красителя, способного максимально связываться с гидрофобными участками молекулы хитозана – АНС. Результаты исследования могут быть положены в основу для разработки методики качественного и количественного определения хитозана методом флуоресцентной спектрофометрии.
Рецензенты:
Кучменко Т.А., д.х.н., профессор, зав. кафедрой физической и аналитической химии, ФГБОУ ВПО «Воронежский государственный университет инженерных технологий», г. Воронеж;
Селеменев В.Ф., д.х.н., профессор, член Российской экологической академии, зав. кафедрой аналитической химии, ФГБОУ ВПО «Воронежский государственный университет», г. Воронеж.
Библиографическая ссылка
Векшин Н.Л., Глотова И.А., Балабаев В.С., Измайлов В.Н. ФЛУОРИМЕТРИЧЕСКОЕ ИССЛЕДОВАНИЕ ПЛЕНКООБРАЗУЮЩИХ СУБСТАНЦИЙ ХИТОЗАНА // Фундаментальные исследования. – 2015. – № 6-3. – С. 447-451;URL: https://fundamental-research.ru/ru/article/view?id=38639 (дата обращения: 19.04.2024).



