Целлюлозосодержащая биомасса является перспективным и альтернативным источником энергии для получения биоэтанола. В переработке биомассы главным образом задействовано два процесса: гидролиз целлюлозы лигноцеллюлозной биомассы с получением редуцирующих сахаров и спиртовое брожение сахаров в биоэтанол [11]. Предварительная обработка целлюлозосодержащей биомассы также является важным этапом в процессе получения биоэтанола и необходима для устранения прочности матрицы сырья и повышения выхода сбраживаемых сахаров на этапе ферментативного гидролиза [9].
В качестве источника сырья для получения биоэтанола в данной работе выбраны плодовые оболочки овса (ПОО). Они составляют 28 % от массы зерна, и для перерабатывающих заводов со средней производительностью 1400 т овса в месяц отсутствие схемы их утилизации является нерешенной проблемой. Следует отметить, что ранее плодовые оболочки овса рассматривались как гемицеллюлозное сырье и источник получения фурфурола и ксилита, так как содержание гемицеллюлозы составляет 32–35 % [5]. Высокое содержание целлюлозы (до 35 %) и размещение плодовых оболочек овса непосредственно в промышленных районах позволяет их позиционировать как потенциальный источник недревесной целлюлозы. Известно, что за рубежом плодовые оболочки овса признаны сырьем, пригодным для получения биоэтанола [8]. Целью данной работы являлось масштабирование процесса получения биоэтанола в емкостном оборудовании объемом 63 л из нового источника целлюлозосодержащего сырья – плодовых оболочек овса, полученных в установке с роторно-пульсационным аппаратом.
Материалы и методы исследования
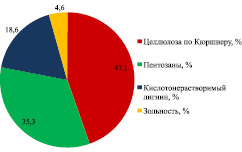
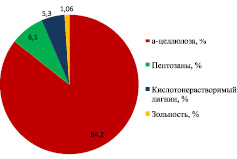
Для получения биоэтанола в качестве субстрата использовался волокнистый продукт (ВП) из плодовых оболочек овса, полученный в установке с роторно-пульсационным аппаратом (РПА) в ИПХЭТ СО РАН. Обработку в установке с РПА проводили циркуляцией суспензии 1,5 кг целлюлозосодержащего продукта в 60 л 2 %-ного раствора NaOH в течение 1 ч [2, 4]. Плодовые оболочки овса до обработки в установке с РПА и после нее представлены на рис. 1 а, в. Определение основных характеристик сырья и субстрата (массовой доли (м.д.) целлюлозы по Кюршнеру, м.д. пентозанов, м.д. кислотонерастворимого лигнина, зольность) проводилось по стандартным методикам. Характеристики представлены на рис. 1 б, г.
Биоконверсия полученного субстрата в биоэтанол осуществлялась на опытном производстве ИПХЭТ СО РАН согласно ТП 10018691.01101.00071 «Технологическая пропись получения биоэтанола из мискантуса и плодовых оболочек овса». Ферментативный гидролиз проводился в водной среде в емкостном оборудовании объемом 63 л, при этом уровень активной кислотности поддерживался вручную в диапазоне 4,7–5,1 путем добавления растворов ортофосфорной кислоты и аммиака. Концентрация субстрата составила 60 г/л в пересчете на абсолютно сухое вещество. В работе использовались промышленно доступные ферментные препараты «Целлолюкс-А» (производитель ПО «Сиббиофарм», Бердск) и «Брюзайм BGX» (производитель «Polfa Tarchomin Pharmaceutical Works S.A.», Польша, для компании «Diadic International Inc.», США). Препарат «Целлолюкс-А» позиционируется на рынке как целлюлаза для расщепления некрахмалистых полисахаридов, «Брюзайм BGX» – как гемицеллюлаза. Ферментные препараты были внесены в избытке. Температура ферментативного гидролиза составила 46,5–47 °С, продолжительность – 24 ч, после этого среда охлаждалась до 28 °С, вносились засевные дрожжи и в течение последующих 44 ч проводилось спиртовое брожение, совмещенное с ферментативным гидролизом, активная кислотность поддерживалась вручную на уровне 4,7–5,1.
Спиртовое брожение осуществлялось с использованием дрожжей Saccharomyces сerevisiae Y-1693 Всероссийской коллекции промышленных микроорганизмов (г. Москва). Дрожжи для сбраживания подготовлены следующим образом: чистая культура была пересеяна на среду неохмеленного солодового сусла в количестве 5 % к объему среды, культивирование проводилось 1 сутки при температуре 28 °С; затем эти дрожжи в количестве 5 % были перенесены на среду, состоящую из ферментативного гидролизата и неохмеленного солодового сусла, культивирование проводилось 1 сутки при температуре 28 °С. Полученные дрожжи в дозировке 12 % внесены как инокулят в ферментативный гидролизат, полученный на опытном производстве, общее количество клеток составило 93 млн КОЕ/мл.

а б

в г
Рис. 1. а – плодовые оболочки овса; б – химический состав ПОО; в – волокнистый продукт плодовых оболочек овса; г – химический состав ВП ПОО
Концентрация сахаров в пересчете на глюкозу определялась спектрофотометрически. Выход редуцирующих веществ (РВ) рассчитан как отношение массы РВ к массе субстрата. Крепость бражек (объемная доля спирта) определялась ареометром для спирта в дистилляте, полученном после предварительной перегонки спирта из бражки, в соответствии с ГОСТ Р 51135-2003 [1]. По крепости полученных бражек и концентрации РВ в исходной среде рассчитывался выход биоэтанола. Теоретическая концентрация этанола рассчитывалась по стехиометрическому уравнению брожения, выход биоэтанола – как отношение экспериментальной концентрации этанола к теоретической.
Результаты исследования и их обсуждение
По данным, представленным на рис. 1 б, г, видно, что предобработка плодовых оболочек овса в установке с РПА позволяет снизить содержание пентозанов в 5,8 раза, содержание кислотонерастворимого лигнина в 3,5 раза, зольность в 4,4 раза. Массовая доля целлюлозы в ВП ПОО составляет 84,2 %.
На рис. 2 представлена зависимость концентрации РВ от продолжительности процессов ферментативного гидролиза и спиртового брожения ВП плодовых оболочек овса.

Рис. 2. Зависимость концентрации РВ от продолжительности процессов ферментативного гидролиза и спиртового брожения ВП плодовых оболочек овса
Накопление редуцирующих веществ происходит экспоненциально, через 20 ч накапливается максимальная концентрация РВ – 35,5 г/л, т.е. выход РВ составил 53,3 %. После внесения дрожжей наблюдалось снижение концентрации РВ. Неполный ферментативный гидролиз волокнистого продукта из плодовых оболочек овса может объясняться как несогласованностью действия индивидуальных ферментов, входящих в состав ферментной композиции (известно, что препараты, синтезированные, продуцентами рода Trichoderma, обеднены целлобиазой [6]), так и явлениями субстратного ингибирования и адсорбции ферментов на субстрате [10]. Таким образом, химическая предварительная обработка сырья в установке с РПА позволяет получать качественный субстрат для ферментативного гидролиза [3].
Результаты спиртового брожения ферментативного гидролизата волокнистого продукта плодовых оболочек овса представлены в таблице. Крепости бражек, получаемых в результате сбраживания химических гидролизатов древесины, составляют 1,0–1,5 об. % [7], в данной работе получена бражка с крепостью 2,0 об. %. Эти результаты подтверждают перспективность применения именно ферментативного способа получения гидролизатов из целлюлозосодержащего сырья. Остаточная концентрация РВ в бражке невелика и составляет 5,3 г/л, что свидетельствует о биологической доброкачественности ферментативного гидролизата волокнистого продукта из плодовых оболочек овса.
Выход биоэтанола на гидролизной среде ВП ПОО составляет 52,6 % от теоретического. Известно, что выход этанола на гидролизных заводах составляет 55–58 л из 100 кг сбраживаемых сахаров [7], или 85–90 % от теоретического. Меньший выход биоэтанола по сравнению с литературными данными объясняется неполноценностью состава нативного гидролизата, а именно нехваткой азота и фосфора. Оптимизация состава питательных сред по этим элементам позволит увеличить выход этанола до нормативных показателей. В процессе простой перегонки бражки с последующим концентрированием водно-спиртовой смеси был получен 50 % раствор биоэтанола. Методом газожидкостной хроматографии, принятой в отрасли, было установлено, что метанол в опытном образце биоэтанола отсутствует.
Результаты спиртового брожения для волокнистого продукта плодовых оболочек овса
|
Показатель |
Субстрат |
|
Концентрация РВ в ферментативном гидролизате, г/л |
35,5 |
|
Крепость бражки, об. % |
2,0 |
|
Остаточная концентрация РВ в бражке, г/л |
5,3 |
|
Выход биоэтанола, % от теоретического |
52,6 |
Выводы
Установлено, что обработка плодовых оболочек овса в установке с РПА позволяет получать субстрат с высокой реакционной способностью к ферментативному гидролизу: выход редуцирующих веществ составил 35,5 г/л.
На среде ферментативного гидролизата волокнистого продукта из плодовых оболочек овса при использовании продуцента Saccharomyces сerevisiae Y-1693 получен биоэтанол с выходом 52,6 % от теоретического. Оптимизация стадии спиртового брожения позволит увеличить выход этанола до нормативных показателей.
Процесс получения биоэтанола из субстрата, полученного в установке с РПА, масштабирован на опытном производстве ИПХЭТ СО РАН в емкостном оборудовании объёмом 63 л.
Рецензенты:
Меледина Т.В., д.т.н., профессор, заведующая кафедрой пищевой биотехнологии продуктов из растительного сырья Института холода и биотехнологий, ФГАОУ ВО «Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики», г. Санкт-Петербург;
Канарский А.В., д.т.н., профессор кафедры пищевой биотехнологии, ФГБОУ ВПО «Казанский национальный исследовательский технологический университет», г. Казань.
Библиографическая ссылка
Байбакова О.В. ПЛОДОВЫЕ ОБОЛОЧКИ ОВСА В КАЧЕСТВЕ СЫРЬЯ ДЛЯ ПОЛУЧЕНИЯ БИОЭТАНОЛА ПРИ МАСШТАБИРОВАНИИ ПРОЦЕССА ПО ОБЪЕМУ // Фундаментальные исследования. – 2015. – № 9-2. – С. 215-218;URL: https://fundamental-research.ru/ru/article/view?id=39076 (дата обращения: 16.04.2024).



