В настоящее время растет интерес исследователей к синтезу наноматериалов на основе оксидов металлов, в том числе оксидов меди, как в области фундаментальной, так и прикладной науки. Это обусловлено уникальными свойствами материалов в наноструктурированном состоянии и необходимостью разработки новых материалов с заданными свойствами. При этом наиболее важной задачей при разработке контролируемого метода синтеза таких материалов является понимание механизма образования частиц разных размеров и морфологии. На сегодняшний день предложены десятки способов синтеза наноразмерных оксидов меди (порошков и пленок), в том числе и электрохимических [1–3]. Ранее в наших работах [4, 5] был подробно изложен электрохимический способ получения наночастиц CuOx, основанный на окислении и диспергировании медных электродов в нейтральном растворе хлорида натрия под действием переменного импульсного тока (ПИТ-синтез). Особенностью способа является возможность управления составом и структурой наночастиц оксидов меди путем варьирования параметров тока, т.е. плотности тока и скважности импульсов. Так при плотности тока 0,5 А/см2 и скважности ≤ 30 % образуются преимущественно полые октаэдрические частицы Cu2O (CuOx-0,5). При плотности тока 1,0 А/см2 и скважности 40 %, формируются полиэдрические частицы Cu2O, декорированные небольшими пластинчатыми частицами CuO (CuOx-1,0), а при плотности тока 1,5 А/см2 (скважность 50 %) происходит формирование двухслойных композитов Cu2O/CuO (CuOx-1,5).
Величины потенциалов, устанавливающиеся на электродах во время синтеза
|
Характер тока |
Постоянный ток |
Переменный импульсный ток, 50 Гц |
||||||||||
|
Положительный |
Отрицательный |
|||||||||||
|
импульс |
пауза |
импульс |
пауза |
|||||||||
|
Плотность тока, А/см2 |
средняя |
0,5 |
1,0 |
1,5 |
0,5 |
1,0 |
1,5 |
– |
–0,5 |
–1,0 |
–1,5 |
– |
|
истинная |
0,5 |
1,0 |
1,5 |
4,5 |
5,0 |
6,0 |
– |
–4,5 |
–5,0 |
–6,0 |
– |
|
|
Потенциал, В |
10 |
11,5 |
12 |
5,5 |
5,6 |
5,8 |
1,0–1,2 |
–4,0 |
–4,5 |
–4,8 |
0,2–0,4 |
|
В настоящей работе рассмотрены причины формирования частиц различной морфологии и представлен наиболее вероятный механизм процесса. Экспериментальные условия синтеза и анализа продуктов детально описаны в [4].
Процесс образования Cu2O в растворах, содержащих ионы Cl-, изучен достаточно подробно [6], что обусловлено в основном проблемой коррозионной стабильности меди в морской воде [7]. Электрохимическое растворение Cu при анодной поляризации в нейтральных и щелочных растворах сопровождается образованием растворимых хлоридных комплексов меди типа CuClnn-1, при этом большинство исследователей считает, что n = 2 [7].
Cu + Cl- ↔ CuClsurf + e-, (1)
CuClsurf + Cl- ↔ CuCl-2. (2)
Cu2O образуется в результате реакции осаждения, а не прямого электрохимического образования из металла или хлорида меди.
2CuCl-2 + 2OH-→Cu2O + H2O + 4Cl-. (3)
Константа равновесия реакции (3) K = 1020, т.е. образование Cu2O практически необратимый процесс [7]. При низких перенапряжениях, т.е. в области потенциалов –0,35÷ –0,15 В, в 2 М NaCl при 60 °С образование CuCl-2 и соответственно Cu2O лимитируется кинетикой процесса. При более анодных потенциалах скорость образования CuClsurf превышает скорость образования комплексов CuCl-2 и, скорость, их диффузии от поверхности электрода в объем раствора. В дальнейшем лимитирующей становится диффузия ионов хлора из объема раствора к поверхности электрода [8]. При потенциалах выше 0,1 В уже возможно дальнейшее окисление меди до Cu (II), т.е. конкуренция реакций образования комплексов CuCl-2 (2) и свободных ионов Cu2+ из CuClsurf (4), а общую скорость процесса определяет диффузия CuCl-2 и Cu2+ от поверхности электрода в объем раствора [9, 10].
CuClsurf ↔ Cu2+ + Cl- + e-. (4)
Таким образом, процесс электрохимического образования оксида меди (I) Cu2O на постоянном токе стадийный, при этом скорость процесса и природа лимитирующей стадии определяются потенциалом, устанавливающимся на электроде в процессе синтеза.
Электрохимическое растворение меди в различных растворах сопровождается периодическими колебательными процессами [11]. Колебательный процесс связан с концентрационной поляризацией и омическими потерями в нарастающей на поверхности электрода пленке СuClsurf или Cu2O (в зависимости от рН электролита и его состава); ее пористой структурой и полупроводниковыми свойствами [12]. При наложении переменного тока периодически изменяющаяся полярность электродов делает процесс более сложным, но существенно ускоряет его. Симметричный переменный импульсный ток (ПИТ) с относительно невысоким коэффициентом заполнения 30–50 % был использован нами по нескольким причинам:
- В паузы, которые составляют 50–70 % времени синтеза, система находится в квазиравновесном состоянии и потенциалы электродов стремятся к равновесным для данных условий значениям.
- При относительно невысоких средних плотностях тока 0,5–1,5 А/см2 реальные пиковые значения достигают 5–6 А/см2 (таблица). Это обеспечивает резкое и кратковременное выведение системы из состояния квазиравновесия и таким образом интенсифицирует процесс.
Величины потенциалов, которые устанавливаются на электродах во время синтеза, приведены в таблице.
Высокие значения плотности тока в импульсах обусловливают установление высоких потенциалов на электродах, на первый взгляд не характерных для электрохимии водных растворов – выше 5 В в положительный импульс и ниже –4 В – в отрицательный. В эти величины вносит вклад омическая составляющая, обусловленная повышением сопротивления приэлектродной области электролита за счет газонаполнения при выделении газообразных продуктов разложения воды, с одной стороны. С другой стороны, на электроде образуется пассивная пленка, состоящая из продуктов окисления меди полупроводникового характера. Так, потенциал медного электрода при поляризации постоянным током той же плотности, что и при ПИТ синтезе, достигает 10–12 В (таблица). В некоторой степени эти значения носят качественный характер, позволяющий, однако, оценить вероятность протекания термодинамически возможных процессов электрохимического растворения меди под действием переменного импульсного тока.
Но, пожалуй, более важную информацию можно получить, анализируя величины потенциалов, устанавливающихся на электродах в периоды пауз, поскольку именно эти периоды составляют большую часть времени ПИТ синтеза. В паузах потенциалы электродов лежат в области 0,2–0,4 и 1,0–1,2 В после отрицательного и положительного импульсов соответственно (таблица) [4]. Именно при этих потенциалах идет образование СuClsurf и CuO.
В хлорид-содержащих растворах потенциал коррозии меди составляет –0,3 В (Ag/AgCl) [13]. Это означает, что даже при отсутствии тока в цепи на электродах могут идти реакции образования СuClsurf или комплексов меди CuCl-2, которые при взаимодействии с водой, OH- или другими активными кислородсодержащими частицами образуют Cu2O. В положительный импульс создаются условия для прямого окисления меди до Cu2O (5) и CuO (6).
2Cu + O*↔ Cu2O + e-, (5)
Cu2O + O* ↔CuO + e-. (6)
Возможно также выделение газообразных хлора и кислорода, хотя в присутствии ионов хлора перенапряжение выделения кислорода возрастает. Однако мгновенные потенциалы достигают столь высоких значений, что следует учитывать вероятность и этого процесса. При этом локально изменяется рН приэлектродного слоя за счет образования катионов Н+ (8).
2Cl-→Cl2↑ + 2e-, (7)
2H2O → O2 + 2H+ + 2e-. (8)
В отрицательный импульс возможна серия восстановительных процессов.
CuClsurf + e- ↔ Cu + Cl-, (9)
Cu2O + H2O + e- ↔ 2Cu + 2OH-, (10)
Cu2+ + 2e- ↔ Cu. (11)
Кроме того, потенциал вполне достаточен для протекания реакции восстановления кислорода (12).
O2 + 2H2O + 4e- ↔ 4OH-. (12)
Выделение водорода (13) также возможно, поскольку потенциалы и локальные плотности тока в отрицательный импульс также очень высоки.
2H2O + 2e-→H2↑ + 2OH-. (13)
Реакции (12) и (13) сопровождаются повышением рН приэлектродного слоя, что благоприятно сказывается на процессе образования Cu2O по реакции (3).
Кроме перечисленных реакций, которые периодически чередуются, и, соответственно, вызывают изменения в приэлектродном слое, при наложении переменного тока следует учитывать также:
- изменение структуры ДЭС;
- изменение направления диффузии ионов;
- чередование процессов кристаллизации и растворения кристаллов;
- образование пассивной пленки CuCl и CuO на поверхности, которые обладают полупроводниковыми свойствами и соответственно, влияют на распределение заряда по поверхности электрода;
- в разные моменты синтеза оказывает влияние адсорбция и десорбция анионов например Сl-, OH- или CuCl-2.
Потенциал нулевого заряда меди (ПНЗ) иногда может отличаться более чем на 0,5 В [14]. Этот параметр зависит от типа электролита и метода подготовки поверхности электрода. ПНЗ меди в нейтральных растворах близок к –0,2 В (Ag/AgCl). Однако это значение также может быть –0,1 В, что практически соответствует меди, покрытой поверхностными оксидами. Другими словами, во время синтеза поверхность меди заряжена положительно, что, в свою очередь, интенсифицирует процесс путем адсорбции на поверхности Cl- и ОН-.
На рис. 1 показаны электрохимические и химические реакции на медном электроде, которые термодинамически и кинетически возможны в различные стадии процесса. Предлагаемая схема основана на литературных данных и измерении электродных потенциалов в процессе синтеза. В ней учтены только основные из возможных процессов, записаны они схематично в общем виде, поскольку детальный механизм любого процесса зависит от потенциала электрода, который в наших условиях циклично изменяется во времени. Однако эта схема дает представление о сложности процессов под действием ПИТ.

Рис. 1. Схема термодинамически и кинетически возможных электрохимических и химических реакций на медном электроде в процессе протекания переменного импульсного тока. Синие и красные пунктирные стрелки обозначают потенциалы, измеренные в положительный и отрицательный импульс соответственно. Фиолетовый прямоугольник – окно потенциалов в периоды пауз между импульсами
Во время положительного импульса, как и при наложении постоянного тока, возможно протекание следующих окислительных процессов [15, 16]:
- образование пленки СuClsurf (1) и комплекса CuCl2- (2), который осаждается из раствора в виде Cu2O (3) в приэлектродной области при E > –0,3 В;
- окисление СuClsurf вCu2+ (4) при E > –0,3 В;
- прямое окисление Cu до CuO (5 и 6) при E > 0,5 В;
- разряд ионов хлора с выделением Cl2 (7), и молекул H2O с выделением O2 (8) при пиковых потенциалах E > 2 В.
Во время отрицательного импульса, который начинается при E = 0,25 В, протекание реакций (1)–(4) все еще возможно, но также протекают процессы восстановления, так как электродный потенциал ниже, чем потенциал коррозии меди в нейтральном растворе NaCl при E ≤ –0,3 В [9, 10]. При этом возможны процессы:
- восстановление СuClsurf, Cu2O и ионов Cu2+ до Cu (9), (10) и (11) соответственно;
- восстановление кислорода (12) [6] ;
- выделение водорода и образование OH- (13) при E < –2 В. Этот процесс играет ключевую роль в интенсификации образования CuOx, так как пузырьки H2 обеспечивают удаление оксидных продуктов от поверхности электрода.
Для выяснения возможности контроля свойств получаемых продуктов путем изменения условий синтеза, было исследовано влияние средней плотности тока и скважности на свойства порошков оксидов меди (рис. 2).
При плотности тока 0,5 А/см2 и скважности ≤ 30 % образуются преимущественно полые октаэдрические частицы Cu2O (CuOx-0,5). В таких условиях процесс роста частиц протекает медленно, а скорости образования СuClsurf (2) и Cu2O (3) соизмеримы. Под действием переменного импульсного тока пузырьки H2, выделяющиеся во время отрицательного импульса, не успевают вырасти, так как рост таких пузырьков главным образом протекает из-за поверхностной диффузии по механизму коалесценции [17]. Таким образом, поверхность электрода покрыта маленькими пузырьками, которые служат центрами нуклеации для Cu2O (3) в приэлектродной области в следующую паузу. В начале анодного импульса заряд поверхности электрода быстро меняется, и пузырьки водорода отрываются с образованием частиц Cu2O (рис. 2, а).
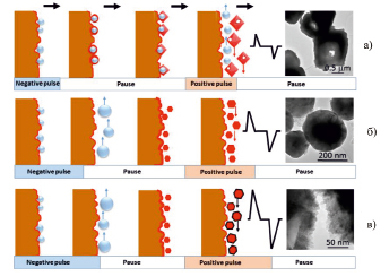
Рис. 2. Схематическое изображение CuOx различного состава и морфологии, полученных под действием переменного импульсного тока
При плотности тока 1,0 А/см2 и скважности 40 % пузырьки H2 коалесцируют и отрываются от электрода во время более длинного отрицательного импульса. Cu2O кристаллизуется в растворе в приэлектродной области. Высокая истинная плотность тока обуславливает очень высокие скорости процессов и, следовательно, резкое локальное изменение концентраций реагентов в приэлектродном слое. Создаются экстремально нестационарные условия роста кристаллов. Так, в положительный импульс приэлектродный слой обедняется ионами хлора, создаются условия для прямого окисления меди до Cu2O и CuO. И чем выше плотность тока, тем больше дефицит ионов хлора и, следовательно, больше образуется кристаллитов CuO (рис. 2, б).
При плотности тока 1,5 А/см2 происходит формирование двухслойных композитов Cu2O/CuO (рис. 2, в). В этом случае импульсы длиннее (скважность 50 %), при этом могут протекать окислительные процессы, ведущие к образованию небольших пластинчатых кристаллов CuO на поверхности Cu2O благодаря резкому изменению концентрации и pH в приэлектродной области [1].
В настоящей работе предложен механизм формирования нанодисперсных оксидов меди под действием переменного импульсного тока; обоснованы причины ускорения этого процесса по сравнению с процессом на постоянном токе; установлены факторы, определяющие состав и морфологию продуктов. Таким образом, сформулированы основные принципы управления процессом электрохимического синтеза наноматериалов с заданными свойствами.
Работа выполнена при финансовой поддержке РНФ (грант № 14-23-00078).
Исследования выполнены с использованием оборудования Центра коллективного пользования «Нанотехнологии» Южно-Российского государственного политехнического университета имени М.И. Платова.
Библиографическая ссылка
Ульянкина А.А., Смирнова Н.В. О МЕХАНИЗМЕ ЭЛЕКТРОХИМИЧЕСКОГО ОБРАЗОВАНИЯ НАНОДИСПЕРСНЫХ ОКСИДОВ МЕДИ ПОД ДЕЙСТВИЕМ ПЕРЕМЕННОГО ИМПУЛЬСНОГО ТОКА // Фундаментальные исследования. – 2017. – № 12-1. – С. 126-131;URL: https://fundamental-research.ru/ru/article/view?id=41991 (дата обращения: 19.04.2024).



