Согласно современным представлениям о патогенезе атеросклероза большое значение отводится иммуноопосредованному воспалению в артериальной стенке [2, 7, 8, 11].
Гипертензия и гиперхолестеринемия коррелируют с развитием атеросклеротического процесса [2, 7, 9, 14]. Являясь промоторными факторами, они усиливают пролиферацию гладкомышечных клеток и стимулируют образование атеросклеротических бляшек [1]. Однако нередко атеросклеротический процесс развивается у лиц с нормальным содержанием холестерина и даже при низких его концентрациях [7, 8]. Изменения реагирования эндотелия с клетками иммунной системы на уровне цитокинов являются ранним проявлениями атерогенеза [2, 8]. Цитокиновый дисбаланс влияет на образование, рост атеросклеротической бляшки и вносит свой вклад в ее дестабилизацию с дальнейшим тромбообразованием. При этом известно, что в физиологических концентрациях IL-6, IL-1β и TNF-α играют важную роль в регуляции иммунного ответа и тканевого гомеостаза, а в высоких концентрациях эти интерлейкины обладают эффектами, способствующими прогрессированию атеросклеротического процес- са [8]. TNFα и IL1-β достоверно усиливают адгезию эндотелиальных клеток, при этом IL1-β только в высоких концентрациях достоверно стимулирует миграцию эндотелиальных клеток [1].
Подтверждена связь изменений уровней провоспалительных цитокинов с разной степенью стеноза, распространенностью, локализацией поражений, нестабильностью атеросклеротических бляшек [2, 8]. Однако аспекты цитокиновой регуляции атерогенеза остаются еще до конца не выясненными и часто противоречиво трактуются разными авторами [2, 8, 11]. Экспериментальная оценка воспалительного повреждения артериальной стенки с позиций местного и системного цитокинового дисбаланса, влияющего на процессы миграции, активации и пролиферации Т-лимфоцитов, макрофагов и гладкомышечных клеток, позволит выявить и обосновать применение иммуномодулирующей терапии в регуляции иммунного воспаления при атеросклерозе.
Крысы часто используются в моделировании гиперлипидемии (ГЛ) и артериальной гипертензии (АГ) как факторов риска атеросклероза [4, 5, 6, 9, 14]. Их приобретение и содержание относительно недороги, животные просты в обращении, хорошо размножаются в неволе. Из всех экспериментальных животных у них лучше всего изучен метаболизм [5, 14]. Разработка адекватной экспериментальной модели повреждения эндотелия является необходимым шагом в целях диагностики, профилактики и лечения атеросклероза. Учитывая особенности обменных процессов крыс, способствующие формированию их резистентности к жировой нагрузке, нами применено сочетание экзогенной гиперлипидемии, угнетение обменных процессов и артериальной гипертензии для создания наиболее выраженного атеросклеротического повреждения [4, 5, 6, 9].
Митилан – полисахаридный гликогеноподобный 1,4; 1,6-α-D-глюкан, выделенный из мидии Crenomytilus grayanus, производства ТИБOX ДВО РАН. Обладает иммуномодулирующим, ранозаживляющим, гиполипидемическим, противовоспалительным, УФ- и радиопротекторным эффектами, не токсичен. Производство биогликанов из мидии является экологически безопасным процессом, не требующим дорогостоящего оборудования и материалов. Мидийный отвар, необходимый для производства Митилана является отходом производства рыбоперерабатывающей промышленности. Физико-химические и биологические свойства Митилана подробно изучены в области косметологии. Долгое время этот биоглюкан применялся в составе косметических кремов, выпускаемых рядом предприятий России. В экспериментальных исследованиях доказано, что преинкубация лимфоцитов с Митиланом способствует подавлению апоптоза клеток, существенно снижает уровень метаболитов NO [3, 10]. Препарат «Митилан» проявляет дозозависимое действие, в концентрации 10 мг/кг его противовоспалительная активность сравнима с действием нестероидного противовоспалительного препарата диклофенака (ортофена) в дозе 5 мг/кг. Митилан способен стимулировать перитонеальные макрофаги мышей, что выражается в увеличении лизосомальной активности клеток и в усилении формирования активных форм кислорода в них. Эти этапы предшествуют и сопутствуют процессу фагоцитоза макрофагами. Все это свидетельствует в пользу того, что исследуемый биогликан оказывает иммуномодулирующее воздействие на клеточное звено иммунитета [10].
Целью работы явилось: изучить влияние препарата «Митилан» на цитокиновый профиль и липидный спектр сыворотки крови крыс в модели экспериментального атеросклероза.
Материалом и методы исследования
Материалом исследования явились крысы линии Vistar – 30 голов, массой 350 г. Поставка крыс осуществлялась из вивария Тихоокеанского института биоорганической химии ДВО РАН, Владивосток. Опытная группа крыс – 20 голов, в течение 6 месяцев (180 суток), находились на диете с добавлением в корм холестерина, мерказолила – 1 мг/кг и витамина Д в количестве 2,5 МЕ на кг массы тела крыс (моделирование ГЛ) [4]. В целях создания АГ за 15 дней перед началом кормления животным была произведена операция: наложение лигатуры на почечную ножку правой почки нерассасывающимся шовным материалом и прошивание верхнего полюса левой почки (моделирование симптоматической реноваскулярной артериальной гипертензии), в модификации [13]. Животные опытной группы I – 10 крыс перед выведением из эксперимента получали препарат «Митилан» – per os в количестве – 10 мг, через день, в течение 1 месяца. Опытная группа II – 10 крыс не получали иммуномодулирующей терапии. Контролем являлись 10 здоровых крыс со стандартным рационом. Эвтаназию животных проводили путем декапитации под эфирным наркозом на 6 месяце эксперимента в соответствии с требованиями Европейской конвенции по защите экспериментальных животных 86/609 [12]. Содержание общего холестерина (ОХС); триглицеридов (ТГ); β-липопротеинов; липопротеинов низкой плотности (ЛПНП), липопротеинов очень низкой плотности (ЛПОНП), липопротеинов высокой плотности (ЛПВП) сыворотки крови исследовали с помощью стандартного колориметрического метода с использованием реагентов: «Ольвекс диагностикум» (Россия). Вычисляли индекс атерогенности (ИА) по формуле: общий холестерин – ЛПВП/ЛПВП. Определение цитокинов (TNF-α, IL-1β, IFN-γ, IL-10) и MMP-9 в сыворотке крови крыс производили методом твердофазного иммуноферментного анализа с использованием наборов: Rat «R&D Diagnostics Inc.», USA.Развитие атеросклероза подтверждали с помощью метода магниторезонансной томографии (МРТ) (томограф «PharmaScan US 70/16» (Bruker, Германия)). Гистологические препараты аорты и бедренных артерий окрашивали гематоксилином/эозином и суданом-4 (метод Окамото). Для математической обработки полученных данных использовали программу StatPlus 2009. Сравнение средних значений в выборках осуществляли с помощью непараметрического критерия Вилкоксона-Манна-Уитни.
Результаты исследования и их обсуждение
? ??????? ??????? ???? ????????? ?????? ??? ???????? ??????? ???????? ?????, ??????????? ??????????? ???????, ?? ????????????? ????????????????. ?????????????? ????????? ???????????? ????????? ????????????? ???????????? ???????, ???????? ???? ???????? ?? ?????????, ????????? ???????????? ??????, ????????? ?????????, ????????? ???????? ??????? ?????????. ???????? ??????? ????????????? ?????????? ??????????. ???????? ???? ????????????? ???????? ????????? ??????? ???? ????? ???????????.
? ???? ?? ???? ???????? ?????????? ???, ?-?????????????, ????, ??O?? ??В опытных группах крыс с помощью метода МРТ выявлено сужение просвета аорты, подвздошных и бедренных артерий, их неравномерное контрастирование. Гистологически в сосудах определялось изменение архитектоники эластических волокон, смещение ядер миоцитов на периферию, клеточная инфильтрация стенки, утолщение эндотелия, отложение в стенке жировых включений. Отмечена хорошая переносимость «Митилана» у животных. В группе крыс с применением Митилана изменения сосудов были менее выраженными.
У крыс ГЛ и АГ выявлено увеличение ОХС, β-липопротеинов, ЛПНП, ЛПOНП и ИА. Отмечена хорошая переносимость препарата Митилан у крыс. Применение иммуномодулятора способствовало достоверному снижению уровней ОХС, β-липопротеинов, ЛПНП и ИА, что подтверждает его гиполипидемические свойства [10] (табл. 1).
Таблица 1
Липидный спектр сыворотки крови крыс
|
Группы |
ОХС ммоль/л |
ТГ ммоль/л |
ЛПВП ммоль/л |
ЛПНП ммоль/л |
ЛПОНП ммоль/л |
β-липо- протеины |
ИА у.е. |
|
Опытная группа I |
2,6 р1-р2 = 0,02 |
0,8 (0,8–1,4) р1-р2 = 0,14 |
1,1 (1,0–1,5) р1-р2 = 0,62 |
1,1 (0,7–2,1) р1-р2 = 0,01 |
0,4 р1-р2 = 0,14 |
24,5 (22–37,2) р1-р2 = 0,02 |
1,3 (1,3–1,6) р1-р2 = 0,01 |
|
Опытная группа II |
6,1 (5,5–7,22) р2-р3 = 0,009 |
0,6 (0,5–0,9) р2-р3 = 0,29 |
1,12 (1,0–2,1) р2-р3 = 0,17 |
4,2 (3,8–5,4) р2-р3 = 0,009 |
0,3 (0,2–0,4) р2-р3 = 0,29 |
54 (46,5–69,2) р2-р3 = 0,009 |
3,1 (2,7–4,4) р2-р3 = 0,009 |
|
??????????? ??????Контрольная группа |
2,2 (2,0–3,1) р1-р3 = 0,32 |
0,5 (0,4–0,7) р1-р3 = 0,02 |
1,5 (1,4–1,9) р1-р3 = 0,62 |
0,9(0,7–1,4) р1-р3 = 0,62 |
0,2 (0,2–0,3) р1-р3 = 0,02 |
12 (11,2–12,7) р1-р3 = 0,01 |
1,1 (0,9–1,2) р1-р3 = 0,62 |
Примечание. Данные представлены в виде Медианы, верхнего и нижнего квартилей. р1-р2 – достоверность различий между I и II опытными группами; р2-р3 – достоверность различий между II опытной группой (ГЛ + АГ) и контрольной группой крыс; р1-р3 – достоверность различий между I опытной группой (Митилан) и контрольной группой.
Выявлено увеличение уровня TNF-α, IL-1β, IFN-γ и IL-10 в сыворотке крови крыс II группы, что согласуется с данными литературы о повышении содержания этих цитокинов при АГ и ГЛ (табл. 2) [2, 6, 8, 11]. Известно, что TNF-α, IL-1β и IFN-γ индуцируют активацию макрофагов, способствуют формированию дефектов функции рецепторов к ЛПНП и стимулируют прогрессирование атеросклероза [4, 8, 10, 12]. IFN-γ способен существенно влиять на соотношение ХС и эфиров холестерина в сторону накопления последних, тормозить захват и удаление ХС из клеток с помощью ЛПВП, что приводит к трансформации макрофагов в пенистые клетки [11]. Увеличение значений IL-10 у крыс с ГЛ и АГ объясняет компенсаторное противовоспалительное действие цитокина в условиях повышенной жировой нагрузки и циркуляторной гипоксии при артериальной гипертензии. Данными литературы установлено, что IL-10 по принципу отрицательной обратной связи вызывает замедление продукции провоспалительных цитокинов, подавляет экспрессию IСАМ-1 и VCAM-1 в IL-1β–активированных эндотелиальных клетках, снижает выработку IL-8 и IL-6, ингибирует TNF–α и TGF-β-индуцированную пролиферацию гладкомышечных клеток аорты человека [8, 11]. Другие источники подтверждают, что IL-10 подавляет активность макрофагов, стимуляцию эндотелия модифицированными липопротеинами и высвобождение металлопротеиназ из макрофагов (ответственных за нестабильность бляшки). Он также стимулирует синтез тканевого ингибитора металлопротеиназы-1 моноцитами [11].
При применении Митилана зафиксировано снижение уровней IFN-γ, IL-1β и увеличение IL-10 (см. табл. 2). Не выявлено достоверных отличий между группами по содержанию MMP-9, изменения носили характер тенденции к увеличению ее уровня в группе с применением Митилана (см. табл. 2).
Таблица 2
Содержание цитокинов (IL-1β, IFN-γ, TNF-α, IL-10) и MMP-9 в сыворотке крови крыс
|
Группы |
№ п/п |
TNF-α, пг/мл |
IL-1β, пг/мл |
IFN-γ, пг/мл |
IL-10, пг/мл |
MMP-9, нг/мл |
|
Опытная группа I |
1 |
0,4 (0,3–0,6) р1-р2 = 0,64 |
0,01 (0,01–1,8) р1-р2 = 0,08 |
4,4 (2,5–10,1) р1-р2 = 0,04 |
34,7 (22,4–106,8) р1-р2 = 0,06 |
32,1 (24,3–130,4) р1-р2 = 0,20 |
|
Опытная группа II |
2 |
0,35 (0,3–0,5) р2-р3 = 0,01 |
4,3 (0,6–29,5) р2-р3 = 0,01 |
16,3 (13,9–23,9) р2-р3 = 0,08 |
8,7 (2,4–26,4) р2-р3 = 0,05 |
8,7 (8,1–93,5) р2-р3 = 1 |
|
Контрольная группа |
3 |
0,27 (0,26–0,29) р1-р3 = 0,06 |
0,01 (0,01–0,01) р1-р3 = 0,32 |
3,2 (1,9–13,12) р1-р3 = 1 |
2,2 (2,1–2,7) р1-р3 = 0,01 |
13,9 (10,3–32,7) р1-р3 = 0,14 |
Примечание. Данные представлены в виде медианы, верхнего и нижнего квартилей. р1-р2 – достоверность различий между I и II опытными группами; р2-р3 – достоверность различий между II опытной группой (ГЛ + АГ) и контрольной группой крыс; р1-р3 – достоверность различий между I опытной группой (митилан) и контрольной группой.
Корреляционный анализ показал прямую зависимость между TNF-α и ЛПНП (r = 0,9; p < 0,04), IL-1 и ИА (r = 1,0; p < 0,05) и обратную связь между концентрацией IL-10 и ИА = (r = –0,9; р < 0,03). В каждой группе животных рассчитывали цитокиновый профиль – удельный вес средних значений исследуемых цитокинов в их общей сумме, которую принимали за 100 %. В профиле контрольной группы процент IFN-γ преобладал и составлял 56,6; 38,2 % занимало содержание IL-10, при этом соотношение IL-10 к IFN-γ было равно 0,67; 4,8 % приходилось на наличие TNF-α, тогда как процент IL-1β был менее 0,5 %. После 6-месячной жировой нагрузки и артериальной гипертензии в цитокиновом профиле происходило нарастание IL-1β практически в 15 раз, его процентное содержание стало составлять 14,6 %, при этом отмечалось достоверное снижение доли TNF-α, показатель IFN-γ практически не менялся, а отношение IL-10 к IFN-γ снизилось и стало составлять 0,53 в связи с уменьшением уровня IL-10. Под воздействием Митилана значительно возрос процент противовоспалительного цитокина – IL-10 – до 88 %, причем его доля стала в 2,3 раза выше, чем у контрольных крыс, и в 3 раза выше, чем в группе животных без Митилана. Соотношение IL-10 к IFN-γ при этом значительно увеличилось и стало составлять 7,5. Снизилось содержание TNF-α – в 4 раза по сравнению с контролем. Процентный показатель IFN-γ стал в 5 раз, чем у контрольных крыс и животных без назначения Митилана, а процент IL-1β приблизился к 0 уровню (рисунок).
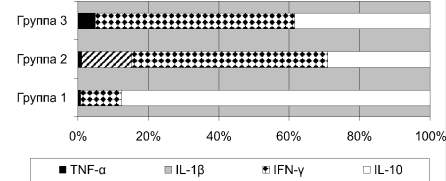
Цитокиновый профиль крови крыс с экспериментальным атеросклерозом и у контрольных животных
Заключение
Результаты исследования показали, что Митилан снижает степень выраженности воспалительного процесса при экспериментальном атеросклерозе и обладает способностью нормализовать показатели липидного обмена. Сочетание противовоспалительных и гиполипидемических свойств Митилана патогенетически обоснованны и позволяют использовать этот препарат для профилактики и комплексной терапии атеросклероза. Необходимы дальнейшие исследования по изучению патогенетических свойств Митилана, разработке адекватных схем и режима его назначения для коррекции иммунных механизмов воспалительного процесса при атеросклерозе.
Рецензенты:
Кулаков Ю.В., д.м.н., профессор, заведующий кафедрой госпитальной терапии ГБОУ ВПО ВГМУ, г. Владивосток;
Просекова Е.В., д.м.н., профессор, заведующая кафедрой биологической химии, клинической лабораторной диагностики, общей и клинической иммунологии ГБОУ ВПО ВГМУ, г. Владивосток.
Работа поступила в редакцию 09.08.2012.
Библиографическая ссылка
Турмова Е.П., Маркелова Е.В., Красников В.Е., Бычков Е.А., Лукьянов П.А., Чикаловец И.В., Григорюк А.А. ВЛИЯНИЕ 1,6-α-D-ГЛЮКАНА ИЗ ДАЛЬНЕВОСТОЧНОЙ МИДИИ «CRENOMYTILUS GRAYANUS» (МИТИЛАНА) НА ЛИПИДНЫЙ СПЕКТР И ЦИТОКИНОВЫЙ ПРОФИЛЬ СЫВОРОТКИ КРОВИ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ АТЕРОСКЛЕРОЗЕ // Фундаментальные исследования. – 2012. – № 11-1. – С. 46-50;URL: https://fundamental-research.ru/ru/article/view?id=30443 (дата обращения: 16.04.2024).



