Иммунная система и растущая злокачественная опухоль находятся в сложных многоуровневых перекрестных взаимодействиях, понимание которых открывает новые подходы к иммунотерапии. При этом ее эффективность находится в прямой зависимости от сохранности иммунной реактивности организма [6]. Ответ организма на рост опухоли имеет сходство с реакцией отторжения трансплантата, важнейшее значение при этом имеет презентация антигена и распознавание его Т-лимфоцитами [13]. Недостаточная противоопухолевая иммунная реакция может быть обусловлена отсутствием чужеродного генетического материала в опухолевых клетках, анатомической изоляцией опухоли, либо ее иммуносупрессивным влиянием [12]. Известно, что рост злокачественных новообразований сопровождается продукцией ими веществ, угнетающих защитные силы организма [2]. Отмечаемая при этом перестройка иммунной защиты приводит к «ускользанию» опухоли от иммунного надзора, которая перестает распознаваться как чужеродная ткань [12].
Немаловажное значение в прогрессии злокачественных новообразований принадлежит иммунодефицитам. Острые и хронические иммунодефициты могут способствовать недостаточному иммунному ответу на рост опухоли и более агрессивному течению заболевания, что, в частности, наблюдается у больных ВИЧ-инфекцией [8]. Спленэктомия вызывает стойкое нарушение гуморального и клеточного иммунитета [5, 11]. В отечественной литературе комплексе патологических сдвигов, связанных с удалением селезенки, получил обозначение «постспленэктомический гипоспленизм» [1].
В наших предыдущих работах описана динамика изменений морфологии и молекулярного фенотипа тимуса в моделях с канцерогенезом, возрастной инволюцией и спленэктомией [3, 5]. Однако в доступной литературе по-прежнему отсутствуют работы по исследованию изменений иммуногистохимического фенотипа тимуса при канцерогенезе на фоне вторичной иммунной недостаточности после спленэктомии.
Цель исследования – выявление особенностей изменений морфологии и молекулярного фенотипа тимуса при развивающейся злокачественной опухоли толстой кишки на фоне вторичной иммунной недостаточности после спленэктомии.
Материалы и методы исследования
Работа выполнена на 60 белых нелинейных крысах-самцах 4 и 5 месяцев массой 180–220 г. Уход и содержание животных проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Крысы были разделены на две группы. Первой группе животных (30 крыс) внутрибрюшинно водили 1,2-диметилгидразин из расчета 20 мг/кг массы 1 раз в неделю в течение 5 недель в соответствии с экспериментальной моделью [9]. Животным второй группы (30 крыс) предварительно выполнялась спленэктомия. Операцию проводили с соблюдением правил асептики и антисептики под местной анестезией. Через 30 суток после спленэктомии крысам водили 1,2-диметилгидразин в дозе и схеме, указанной выше. Выведение животных обеих групп из эксперимента проводилось через 30, 90 и 150 суток после окончания введения канцерогена путем декапитации. Объектом исследования служил тимус. В работе применялись следующие методы:
1. Иммуногистохимический метод с использованием трех коммерческих моноклональных антител (МКАТ) производства NovoCastra (Великобритания):
– МКАТ к мульти-цитокератинам;
– МКАТ к кластеру дифференцировки лимфоцитов 3 типа;
– МКАТ к белку клеточной пролиферации Ki-67.
Материал для исследования методом иммуногистохимии фиксировали 10 % нейтральным забуференным формалином в течение 24 ч, выполняли стандартную спиртово-ксилоловую проводку. Подготовленные образцы тканей заливали в парафин, готовили срезы толщиной 4 мкм, которые наносили на высокоадгезивные стекла и высушивали при температуре 37 °С в течение 18 ч. Демаскировка и иммуногистохимическая окраса проводилась ручным способом с использованием системы визуализации NovoLink polymer (NovoCastra, Великобритания). Контролем иммуногистохимической реакции служила неиммунизированная сыворотка.
2. Окраска срезов тимуса гематоксилином и эозином для изучения общегистологической картины микропрепаратов.
3. Компьютерная морфометрия. Линейные морфометрические измерения выполнены с использованием лицензионной программы Leica Application Sute 3.6.0. Количественные измерения интенсивности мембранных и цитоплазматических иммуногистохимических реакций выполнены с применением лицензионной программы «Микро-Анализ» (Россия), а также демо-версии программы Sigma Scan Pro (Япония). Интенсивность мембранной иммуногистохимической реакции оценена методом автоматического выделения и подсчета площади интересующего цветового спектра (окрашенного DAB) по отношению к площади снимка с переводом числовых значений в проценты. Для каждого среза выполнены измерения не менее чем в 10 интересующих полях зрения. Результат ядерной реакции оценивали путем подсчета позитивно окрашенных ядер на 100 клеток в десяти полях зрения при увеличении ×400, выражая результаты в процентах.
4. Статистическая обработка с использованием лицензионного пакета программ MS Office 2003, достоверность определялась t-критерием Стьюдента.
Результаты исследований и их обсуждение
Через месяц после курсового введения канцерогена тимус сохраняет дольчатое строение. Граница коркового и мозгового вещества хорошо различима. Обработка срезов антителами к цитокератинам выявляет рыхлую сеть эпителиальных клеток в корковом веществе и более компактные периваскулярные скопления в мозговом веществе дольки. Установлено, что позитивную реакцию с цитокератинами на этом сроке дают до 10,1 % клеток коркового вещества и до 18,7 % клеток мозгового вещества дольки. Окраска препаратов тимуса антителами к кластеру дифференцировки 3 типа выявляет многочисленные CD3+ тимоциты. Количество этих клеток в корковом веществе составляет 15,8 %, в мозговом – 46,8 %. Исследование экспрессии Ki-67 выявляет многочисленные пролиферирующие клетки. В корковом веществе позитивную реакцию с Ki-67 дают 42,4 % клеток, в мозговом – 12,85 %. Подобное строение железы сохраняется и через три месяца после введения канцерогена, при этом морфология и молекулярный фенотип тимуса не имеют достоверных отличий по сравнению с предыдущим сроком.
Через пять месяцев после введения канцерогена в толстой кишке крыс формируется злокачественная опухоль, имеющая морфологию дифференцированной аденокарциномы. В тимусе отмечается уменьшение размеров долек с расширением междольковых септ, в которых определяется значительное количество жировой ткани. Обработка препаратов антителами к цитокератинам выявляет густую сеть эпителиальных клеток дольки (рис. 1). Количество эпителиальных клеток коркового вещества достоверно возрастает до 32,4 % (P ˂ 0,001), мозгового – до 31,5 % (P ˂ 0,001). Окраска препаратов антителами к CD3 выявляет значительное увеличение числа позитивных тимоцитов коркового вещества до 47,5 % (P ˂ 0,001), тогда как количество этих клеток в мозговой зоне достоверно не изменяется. Определение экспрессии маркера клеточной пролиферации Ki-67 не выявляет достоверных отличий в количестве пролиферирующих клеток по сравнению с предыдущими сроками исследования (рис. 2).
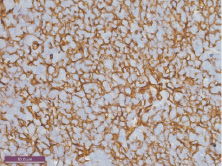
Рис. 1. Тимус крысы через 5 месяцев после введения канцерогена. Густая сеть эпителиальных клеток коркового вещества. Иммуногистохимическая реакция к мульти-цитокератинам. Ув. 400
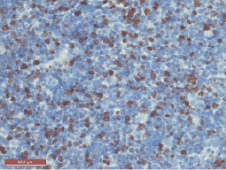
Рис. 2. Тимус крысы через 5 месяцев после введения канцерогена. Пролиферирующие клетки мозгового вещества. Иммуногистохимическая реакция с Ki-67. Ув. 400
Через месяц после введения канцерогена спленэктомированным крысам морфология и иммуногистохимический фенотип тимуса достоверно не отличаются от животных с изолированным введением канцерогена. Однако уже через три месяца в тимусе выявляются признаки инволютивных изменений, которые выражены в уменьшении размеров долек, потере границы между корковым и мозговым веществом и увеличении доли жировой ткани. Следует отметить, что эти изменения более выражены в периферических отделах органа. Обработка препаратов тимуса антителами к цитокератинам выявляет достоверное уменьшение количества эпителиальных клеток в мозговом веществе до 8,1 % (P ˂ 0,001), при этом наблюдается своеобразная конденсация эпителиоцитов в кортико-медуллярной зоне дольки с опустошением центральных отделов мозгового вещества (рис. 3). Определение кластера дифференцировки лимфоцитов 3 типа выявляет достоверное снижение числа CD3+ тимоцитов в мозговом веществе дольки до 20,33 % (P ˂ 0,001). Исследование экспрессии маркера клеточной пролиферации не выявляет достоверных отличий по сравнению с группой животных с изолированным введением канцерогена.
На стадии формирования карциномы у спленэктомированных крыс через пять месяцев тимус значительно уменьшен в размерах, дряблый, желтоватого цвета. Большая часть долек подвержена атрофии и замещена жировой тканью. Сохранившиеся дольки значительно уменьшены в размерах, граница коркового и мозгового вещества едва различима. Окраска препаратов антителами к цитокератинам выявляет густую сеть эпителиальных клеток в сохраненных дольках, а в дольках, подверженных атрофии, – компактные скопления в виде сливающихся периваскулярных розеток без лимфоцитов (рис. 4). Компьютерная морфометрия выявляет уменьшение количества эпителиальных клеток в корковом веществе до 17,4 % (P ˂ 0,001), тогда как в мозговом веществе число этих клеток возрастает до 43,4 % (P ˂ 0,01). Исследование экспрессии CD3 в сохраненных дольках демонстрирует достоверное снижение числа CD3+ клеток до 22,3 % (P ˂ 0,001) в корковом и до 15,59 % (P ˂ 0,001) – в мозговом веществе дольки. Обработка препаратов антителами к Ki-67 выявляет двукратное снижение экспрессии этого маркера в корковом веществе и более чем пятикратное снижение в мозговой зоне (рис. 5).
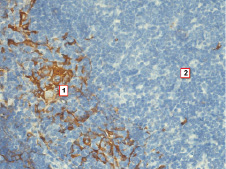
Рис. 3. Тимус спленэктомированной крысы через 3 месяца после введения канцерогена. Конденсация эпителиальных клеток в кортико-медуллярной зоне с «опустошением» мозгового вещества: 1 – эпителиальные клетки на границе коркового вещества, 2 – мозговое вещество. Иммуногистохимическая реакция к мульти-цитокератинам. Ув. 400
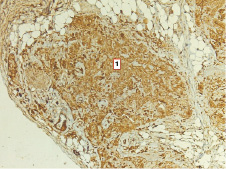
Рис. 4. Тимус спленэктомированной крысы через 5 месяцев после введения канцерогена:1 – компактные сливающиеся поля эпителиальных клеток в атрофированных дольках. Иммуногистохимическая реакция к мульти-цитокератинам. Ув. 400
Наши исследования показали, что через один месяц после введения канцерогена достоверные отличия морфологии и иммуногистохимического фенотипа тимуса в двух экспериментальных группах отсутствуют. Различия в течении инволютивных процессов регистрируются через три месяца после введения канцерогена, при этом раньше других изменения появляются в популяциях эпителиальных клеток и CD3+ тимоцитов мозгового вещества. Мы полагаем, что уменьшение количества эпителиоцитов мозгового вещества через три месяца после введения канцерогена спленэктомированным крысам является относительным и обусловлено изменением цитоархитектоники клеток с их конденсацией на границе коркового и мозгового вещества. Это, в свою очередь, может быть обусловлено увеличением числа клеток нетимопоэтического микроокружения в структурах мозгового вещества вследствие акцидентальной инволюции тимуса после спленэктомии.
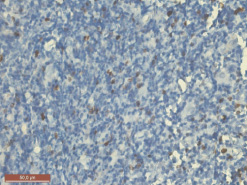
Рис. 5. Тимус спленэктомированной крысы через 5 месяцев после введения канцерогена. Значительное уменьшение пролиферирующих клеток в мозговом веществе. Иммуногистохимическая реакция с Ki-67. Ув. 400
На стадии формирования карциномы достоверные отличия морфологии и молекулярного фенотипа вилочковой железы у животных двух групп регистрируются во всех исследуемых структурах. Установлено, что инволюция тимуса у крыс с канцерогенезом на фоне спленэктомии заканчивается атрофией большей части органа с дезорганизацией сети эпителиальных клеток долек. Известно, что сохранение сети эпителиоцитов коркового вещества необходимо для дифференцировки и созревания Т-лимфоцитов, а ее разрушение приводит к угнетению тимопоэза [7].
Изменения в популяции эпителиальных клеток сопровождаются значительным снижением клеточной пролиферации, достоверным уменьшением числа CD3+ тимоцитов в структурах тимуса и указывают на угнетение тимопоэза. По данным литературы, удаление селезенки сопровождается активацией пучковой зоны надпочечников и повышением уровня глюкокортикоидов в крови [4, 5]. Известно, что глюкокортикоидные гормоны способны угнетать продукцию клеток костным мозгом, и, следовательно, поступление предшественников тимопоэза в тимус [10]. Мы считаем, что регистрируемое угнетение тимопоэза у животных с канцерогенезом на фоне спленэктомии может быть обусловлено как токсическим влиянием самой опухоли, так и нарушением поступления клеток-предшественников в железу вследствие влияния повышенного уровня глюкокортикоидов.
Таким образом, наши исследования показали, что развитие экспериментальной злокачественной опухоли толстой кишки на фоне вторичной иммунной недостаточности после спленэктомии существенно изменяет и усугубляет течение инволютивных изменений в тимусе. При этом в железе на фоне атрофии большей части паренхимы регистрируются признаки выраженного угнетения тимопоэза.
Рецензенты:
Димитриев Д.А., д.м.н., профессор, заведующий кафедрой анатомии, физиологии и гигиены детей, ФГБОУ ВПО «Чувашский государственный педагогический университет имени И.Я. Яковлева» Министерства образования и науки России, г. Чебоксары;
Суворова Г.Н., д.б.н., профессор, заведующая кафедрой анатомии человека, ГБОУ ВПО «Самарский государственный медицинский университет» Минздрава России, г. Самара.
Работа поступила в редакцию 07.03.2013.Библиографическая ссылка
Москвичев Е.В. ИММУНОГИСТОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ТИМУСА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ КАНЦЕРОГЕНЕЗЕ НА ФОНЕ СПЛЕНЭКТОМИИ // Фундаментальные исследования. – 2013. – № 3-2. – С. 346-351;URL: https://fundamental-research.ru/ru/article/view?id=31340 (дата обращения: 16.04.2024).



