Одной из важнейших проблем, с которой сталкиваются врачи-стоматологи в своей повседневной практике, является проблема ускорения регенерации костных дефектов челюстей, возникающих вследствие хирургических вмешательств в челюстно-лицевой области. Дефицит костной ткани наблюдается при осложненных экстракционных и реконструкционных вмешательствах, в процессе проведения парадонтологического и имплантологического лечения, а также различных восстановительных костнопластических операций. В настоящее время в хирургической практике достаточно широко используются природные и синтетические остеопластические материалы [1, 3, 5, 6]. Результаты операций во многом зависят от свойств веществ, входящих в состав остеопластических композиций, необходимых для стимулирования роста и минерализации костной ткани [1, 3, 4, 5, 6, 7]. В частности, применяются различные препараты, изготовленные из натуральной костной ткани крупного рогатого скота, а также полностью искусственно синтезированные. В связи с проблемой контроля качества ксеногенных остеопластических материалов в последнее время наибольший интерес проявляется к синтетическим препаратам. Однако результаты применения подобных препаратов неоднозначны и нередко сопровождаются различными осложнениями вследствие возможного иммунного ответа [4, 5]. Требуемые качественные характеристики таких материалов – остеоиндуктивность, биосовместимость, способность выполнять и поддерживать объем дефекта костной ткани[1, 3, 9, 10, 11, 12].
Известно, что результаты операций по замещению костных дефектов челюстей во многом зависят от свойств веществ, введенных в остеопластические композиции с целью стимулирования роста и минерализации костной ткани. Опыт использования отечественных и зарубежных препаратов на основе гидроксиапатита и коллагена указывает на их положительные свойства – предсказуемость и широкий диапазон применения [1, 2, 3, 4, 8]. Однако в современной литературе немного работ, посвященных сравнительному клинико-экспериментальному изучению влияния различных по составу остеопластических средств на скорость остеогенеза и заживления костной раны.
В ряде исследований последних лет, посвященных изучению влияния остеопластических средств на скорость остеогенеза и заживления костной раны, отмечен положительный опыт использования электромагнитного излучения в качестве вспомогательного метода. Детальное исследование результатов взаимодействия физических факторов и химических материалов в эксперименте и в клинической практике представляется актуальным способом совершенствования хирургической стоматологической помощи.
Цель исследования: клинико-экспериментальное изучение свойств костного регенерата в зависимости от используемых остеопластических материалов в комплексе с электромагнитным излучением.
Материал и методы исследования
Экспериментальная часть исследования. Исследование проведено на 40 годовалых кроликах массой 1100–1600 г. Под гексеналовым наркозом в области дистальных эпифизов бедренной кости с помощью шаровидного бора воспроизводили стандартные краевые дефекты диаметром на поверхности 3 мм и глубиной около 3–5 мм. В зависимости от условий эксперимента животных подразделяли на 5 групп по 8 в каждой:
1-я – в костные дефекты вводили «GenOx». 2-я – в костные дефекты вводили «Биальгин». 3-я – в костные дефекты вводили «Остеопласт – К, Т». 4-я – в костные дефекты вводили «AlgOss». 5-я – контрольная группа, где костный дефект заживал под кровяным сгустком. Все 5 групп в послеоперационном периоде подразделялись на подгруппу «А», где с первых суток после операции проводился курс электромагнитного излучения с длинной волны 5,6 мм в течение 45 минут. В подгруппе «В» электромагнитного излучения не проводилось. Операцию проводили в асептических условиях. Сроки выведения животных из опытов – 15, 30, 60-е сутки. Тканевые блоки декальцинировали в трилоне-Б и подвергали стандартной гистологической обработке с заливкой в парафин и окраской парафиновых срезов гематоксилином и эозином.
Клиническая часть исследования. Всего прооперированно 89 человек в возрасте то 20 до 65 лет без тяжелой соматической патологии. Все больные были разделены на 5 групп соответственно остеопластическому материалу. Все 5 групп в послеоперационном периоде подразделялись на подгруппу «А», где в первые сутки после операции проводился курс электромагнитного излучения с длинной волны 5,6 мм в течение 45 минут. В подгруппе «В» электромагнитного излучения не проводилось.
Обследование проводилось по стандартной схеме, включая выяснение жалоб, анамнеза, развития настоящего заболевания, наличие и отсутствие сопутствующей патологии. Для получения сопоставимых данных пациентам всех групп рентгенологический контроль проводился до операции, через 3, 6 и 12 месяцев после оперативного вмешательства. После оперативного вмешательства больным рекомендовали прием антибактериальных, противовоспалительных и десенсибилизирующих препаратов, также сразу после операции применяли локальную гипотермию (лед) и накладывали давящую повязку. Перевязки проводили ежедневно в течение 7 дней.
Материалы исследования подвергнуты математической обработке на персональном компьютере с помощью пакетов статистических программ Exel 2007, Statistica for Windous 5.0. Результаты представлены в виде средней арифметической и ее стандартной ошибки (М ± т).
Результаты исследования и их обсуждение
К 15-м суткам эксперимента во всех исследуемых группах наблюдалась однотипная картина. Основным элементом новообразованного регенерата в костном дефекте по всему периметру оставалась клеточно-волокнистая фибриллизированная соединительная ткань, включающая в себя частицы остеопластического материала (рис. 1).
Через 30 суток после подсадки в группах, где использовалось электромагнитное излучение, отмечалось интенсивное новообразование костной ткани. Регенерат запаивал частицы подсаженного композита, которые были представлены пустотами в костном веществе, заполненными зернистым веществом и остатками коллагена или гидроксиапатита, входящего в состав материала (рис. 2).
На 30 сутки эксперимента на фрагментах остеопластического материала во всех 4 группах образуется молодая костная ткань, которая совмещается с дном дефекта. Участки материала по периферии прорастают молодой соединительной тканью и сосудами (рис. 3). Вокруг них также находятся остеобласты.
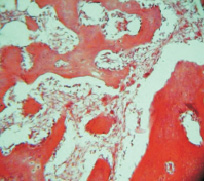
Рис. 1. Группа 1. Образование тонковолокнистой соединительной ткани к 15 суткам между фрагментами материала. Окраска гематоксилином и эозином. Об.10, ок. 12
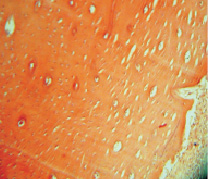
Рис. 2. Группа 2. Образование гаверсовых каналов в молодой костной ткани на 30-е сутки эксперимента. Окраска гематоксилином и эозином. Об.10, ок. 12
Волокнистая соединительная ткань между фрагментами биопластического материала обильно инфильтрирована круглыми клетками разной величины, причем разница достигает 5–6 раз. В волокнистой соединительной ткани выявляются обширные полости, стенки их прерывисто выстланы преимущественно круглыми клетками, но встречаются полости, где стенки образованы длинными плоскими клетками. В соединительной ткани формируются кровеносные сосуды, пронизывающие биоматериал, причем последний напоминает хрящевую ткань (рис. 4).
На 60 сутки в области дефекта видны фрагменты материала, окруженные костной тканью. В области дефекта обнаруживается костная мозоль, которая возвышается над поверхностью неповрежденной костной ткани. В новообразованной ткани выявляются сформировавшиеся остеоны (рис. 5).
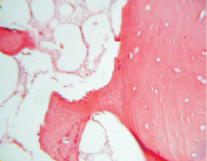
Рис. 3. Группа 3. На 30 сутки эксперимента на фрагментах материала образуется молодая костная ткань, которая совмещается с дном дефекта. Окраска гематоксилином и эозином. Об.10, ок. 12
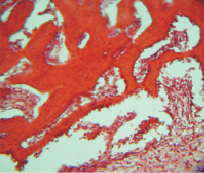
Рис. 4. Группа 2. 30 суток эксперимента. Видны многочисленные кровеносные сосуды, врастающие в остеопластический материал. Окраска гематоксилином и эозином. Об.10, ок. 12
Имплантированный материал окружен плоскими и отросчатыми соединительнотканными элементами различной формы, встречаются остеокласты. Между фрагментами материала располагается грубоволокнистая соединительная ткань с капиллярами (рис. 6).
Дно дефекта состоит из вновь образованной костной ткани, в которой просматриваются остатки материала.
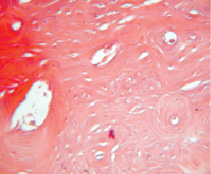
Рис. 5. Группа 3. На 60 сутки в области дефекта обнаружена костная мозоль, которая возвышается над поверхностью неповрежденной костной ткани. В костной мозоли выявляются неодинаковые по форме и размерам остеоны. Окраска гематоксилином и эозином. Об.40, ок. 12
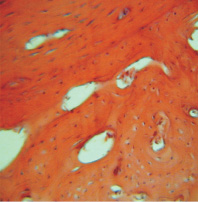
Рис. 6. Группа 4. 60 сутки. Наличие полостей в молодой костной ткани, вокруг которой располагается грубоволокнистая соединительная ткань. Окраска гематоксилином и эозином. Об.16, ок. 12
Таким образом, восстановление структуры костной ткани в эксперименте происходило во всех группах. В то же время в группе наблюдений с электромагнитным излучением и препаратами «AlgOss», «Биальгин» и «Остеопласт» костная фракция возросла в среднем с 30,5 % в 3 месяца до 89,8 % к 6 месяцам по сравнению с «GenOx», где костная фракция к 6 месяцу возросла лишь до 34,5 %. Наиболее быстро происходила резорбция препарата «Остеопласт» – в среднем за 2 месяца. Гранулы «Биальгина» и «AlgOss» почти полностью рассасывались к 6 месяцу, в то же время частицы «GenOx» были подвержены слабой резорбции (до 20,8 % к 6 месяцам).
В ходе эксперимента установлено, что в группе «А», где в дефекты бедренной кости вводили «AlgOss», «Биальгин» и «Остеопласт» и проводили курс электромагнитного излучения, активизация репаративного остеогенеза и дифференциация новообразованной костной ткани проходила быстрее, чем в этой же группе, где заживление шло под кровяным сгустком и с материалом «GenOx».
Представляет определенный интерес и ряд особенностей рассматриваемых остеорепаративных средств: «AlgOss» и «Биальгин» в комплексе с ЭМИ КВЧ ММ-диапазона на 15-е и 30-е сутки проявили более высокую степень выраженности локальных макрофагальных реакций, которая выражалась появлением гигантских многоядерных клеток. Данная реакция сохранялась также и на более поздних сроках – на 60-е сутки. Уровень интенсивности остеорепаративного процесса в группах «А» оставался на высоком уровне. Таким образом, выраженность репаративного остеогенеза во всех группах «А» была достаточно высокой, что позволяет признать данное сочетание химических компонентов и физического фактора высокоэффективным.
В клинике наиболее эффективными зарекомендовали себя препараты «Остеопласт», «AlgOss» и «Биальгин».
Выводы
1. Темпы регенерации костной ткани в эксперименте при заполнении искусственно созданного дефекта пористым гидроксиапатитом, являющимся основой препаратов «Биальгин» и «AlgOss» и костным коллагеном, составляющим основу препарата «GenOx» и «Остеопласт», не одинаковы.
2. Процессы ангио- и остеогенеза по срокам наблюдений в эксперименте и клинике наиболее выражены при использовании препаратов «Остеопласт», «AlgOss» и «Биальгин».
3. Сравнивая результаты использования различных остеопластических препаратов, следует учитывать не только их состав, возраст пациента, величину заполняемого костного дефекта, но и выраженность послеоперационных осложнений, процент которых выше в группе, где не проводился курс ЭМИ КВЧ ММ-диапазона.
4. Наиболее гладкое течение послеоперационного периода у больных отмечено нами при использовании остеопластического материала в сочетании с курсом электромагнитного излучения по предложенной схеме.
Рецензенты:
Слетов А.А., д.м.н., доцент кафедры челюстно-лицевой хирургии и хирургической стоматологии, ГБОУ ВПО «Ставропольский государственный медицинский университет» Минздрава России, г. Ставрополь;
Калиниченко А.А., д.м.н., главный врач стоматологической клиники «Фитодент», г. Михайловск.
Работа поступила в редакцию 11.04.2013.
Библиографическая ссылка
Сирак С.В., Казиева И.Э., Мартиросян А.К. КЛИНИКО-ЭКСПЕРИМЕНТАЛЬНОЕ ИСПОЛЬЗОВАНИЕ ОСТЕОПЛАСТИЧЕСКИХ МАТЕРИАЛОВ В СОЧЕТАНИИ С ЭЛЕКТРОМАГНИТНЫМ ИЗЛУЧЕНИЕМ ДЛЯ УСКОРЕНИЯ РЕГЕНЕРАЦИИ КОСТНЫХ ДЕФЕКТОВ ЧЕЛЮСТЕЙ // Фундаментальные исследования. – 2013. – № 5-2. – С. 389-393;URL: https://fundamental-research.ru/ru/article/view?id=31626 (дата обращения: 19.04.2024).



