Язвенный колит (ЯК) – полиэтиологическое заболевание, в происхождении которого могут участвовать генетический, инфекционный, аллергический, пищевой и иммунологический факторы. Однако последовательность тех или иных механизмов возникновения ЯК остается малоизученной и требует дальнейшего анализа [2, 3]. В последнее время большой интерес уделяется иммунологическим аспектам патогенеза ЯК. Одним из способов регуляторного воздействия на течение и исход воспалительного процесса, наряду с иммунной регуляцией, становится передача информации с помощью нейрогормонов, которые вырабатываются как в ЦНС, так и в диффузной эндокринной системе (ДЭС) желудочно-кишечного тракта [6, 7, 8]. В последние годы были обнаружены новые функции некоторых нейропептидов в регуляции воспалительных реакций. Показано, что эффекторные клетки (энтероциты) содержат рецепторы для нейропептидов, а клетки иммунной системы (лимфоциты, макрофаги) способны вырабатывать коммуникационные нейропептиды [4, 6, 7, 8].
Считается, что взаимодействие нервной и иммунной систем на уровне кишечника становится одним из патофизиологических факторов развития инфекционной диареи и воспалительного процесса в кишечнике, в том числе и при ЯК [6, 8]. У здоровых лиц в желудочно-кишечном тракте постоянно поддерживается баланс между провоспалительными (SP, VIP, нейротензина и др.) и противовоспалительными нейропептидами (CGPR, соматостатин, бомбезин и др.). Нарушение указанного баланса вносит определенный вклад в патофизиологию ЯК [6, 7, 8]. В клинической практике и при экспериментальном колите вещество Р и нейротензин были способны регулировать моторную и секреторную деятельность кишечника, увеличивать капиллярную проницаемость, вызывать дегрануляцию тучных клеток, оказывать влияние на продукцию иммуноглобулинов, хемотаксис и фагоцитоз иммуноцитов, нейтрофильное лизосомальное высвобождение, потенцируя таким образом иммуновоспалительную реакцию в толстой кишке [4, 6, 7, 8, 9]. VIP оказывает ряд эффектов на физиологию кишечника, участвуя в регуляции секреции электролитов и воды, кровоснабжения кишечника и его моторики, вовлекается в нейропластические реакции, заключающиеся в перестройке нервной системы кишечника в ответ на ее повреждение [6, 7, 8].
Цель исследования – изучить содержание провоспалительных нейропептидов – вещества Р, вазоинтестинального пептида и нейротензина в ткани толстой кишки (СОТК) больных язвенным колитом в динамике лечения..
Материалы и методы исследования
Обследованы 45 больных активным ЯК (18 мужчин и 27 женщин) в возрасте от 20 до 60 лет с различной тяжестью заболевания в динамике лечения (в среднем через 6 недель). У 24 пациентов выявлено рецидивирующее течение ЯК, у 13 – непрерывное течение, острый колит – у 8 пациентов. Для определения тяжести ЯК использовали индекс активности Рахмилевича. Легкая форма ЯК установлена у 11 пациентов (индекс клинической активности – 1–5 баллов), среднетяжелая – у 24 пациентов (индекс клинической активности 6–15 баллов), тяжелая – у 10 пациентов (индекс клинической активности 16–30 баллов). В зависимости от тяжести заболевания использовали препараты 5-АСК, глюкокортикостероиды (ГКС), цитостатики, биологическую терапию (Инфликсимаб), антибактериальную и симптоматическую терапию.
Кусочки биоптатов, полученные во время эндоскопии, взвешивали (5–10 мг), гомогенизировали в ледяном растворе 0,9 % NaCl, помещали в полипропиленовую пробирку, содержащую ЭДТА (этилендиаминтетрауксусную кислоту) в качестве антикоагулянта и апротинин в качестве ингибитора протеаз, при 4 °C гомогенизировали в ледяном соляном растворе фосфатного буфера (pH 7,4), содержащем протеазные ингибиторы (1 мкмоль фенилметилсульфонилфторида (PMSF), 10 мкг/мл апротинина, 10 мкг/мл лейпептина. Гомогенаты центрифугировали при 20.000хg в течение 10 минут при температуре 4 °C, после чего надосадочную жидкость (супернатант) собирали в полипропиленовую пробирку и хранили при –50 °C. Содержание нейропептидов – вещества Р (SP), нейротензина (NT) и вазоактивного интестинального полипептида (VIP) в супернатанте определяли методом ИФА с помощью стандартных тест-систем (Peptide Ensyme Immunoassay, Peninsula Laboratories, LLC, USA) согласно прилагаемой инструкции. Результаты выражали в нг/г сырой ткани.
Контрольную группу составили 15 здоровых добровольцев. Содержание SP в СОТК контрольной группы составило 0,198 ± 0,02 нг/г, NT – 0,03 ± 0,01 нг/г, VIP – 0,178 ± 0,01 нг/г.
При статистической обработке результатов исследования использовали t-критерий Стьюдента, коэффициент ранговой корреляции Спирмена (rs), точный критерий Фишера.
Результаты исследования и их обсуждение
В период обострения заболевания содержание SP и NТ в СОТК больных ЯК было повышено (0,553 ± 0,11 и 0,641 ± 0,19 нг/г соответственно, Р < 0,001), а уровень VIP снижен (0,037 ± 0,02 нг/г, Р < 0,001). Был проведен анализ изучаемых показателей у больных с различной тяжестью течения заболевания (табл. 1).
Таблица 1
Содержание SP, NT, VIP в СОТК больных с различной тяжестью ЯК 
|
Степень тяжести |
Изучаемые показатели, нг/г |
||
|
SP |
NT |
VIP |
|
|
Легкая, (n = 11) (1) |
0,453 ± 0,04* |
0,284 ± 0,13* |
0,04 ± 0,009* |
|
Средняя, (n = 24) (2) |
0,524 ± 0,14* |
0,641 ± 0,01* |
0,0439 ± 0,02* |
|
Тяжелая, (n = 10) (3) |
0,658 ± 0,03* |
0,857 ± 0,17* |
0,017 ± 0,004* |
|
P1-2 |
Р ˃ 0,05 |
Р < 0,05 |
Р ˃0,05 |
|
Р1-3 |
Р < 0,05 |
Р < 0,05 |
Р < 0,05 |
|
Р2-3 |
Р < 0,05 |
Р < 0,05 |
Р < 0,05 |
Примечания:
* – P < 0,05 в сравнении с контролем; P1-2 – различия показателей 1-й и 2-й групп; Р1-3 – различия показателей 1-й и 3-й групп; Р2-3 – различия показателей 2-й и 3-й групп.
Установлено, что в период выраженных клинических проявлений ЯК содержание SP и NT в СОТК было повышено во всех исследуемых группах. Наиболее высокие уровни SP и NT и наименьшие показатели VIP выявлены при тяжелом ЯК.
Учитывая тот факт, что тяжесть течения ЯК определяется выраженностью воспалительно-деструктивного процесса в толстой кишке, нами проведен анализ содержания SP, NT и VIP в СОТК в зависимости от обсуждаемого критерия (табл. 2).
Таблица 2
Содержание SP, NT, VIP в СОТК больных ЯК в зависимости от степени активности воспалительного процесса в толстой кишке 
|
Степень тяжести |
Изучаемые показатели, нг/г |
||
|
SP |
NT |
VIP |
|
|
1-я степень (n = 7) (1) |
0,394 ± 0,07* |
0,374 ± 0,01* |
0,052 ± 0,19* |
|
2-я степень (n = 18) (2) |
0,509 ± 0,14* |
0,597 ± 0,07* Р3 < 0,05 |
0,039 ± 0,02* |
|
3-я степень (n = 20) (3) |
0,599 ± 0,09* |
0,872 ± 0,12* |
0,024 ± 0,01* |
|
Р1–2 |
Р ˃ 0,05 |
Р < 0,05 |
Р ˃ 0,05 |
|
Р1–3 |
Р < 0,05 |
Р < 0,05 |
Р < 0,05 |
|
Р2–3 |
Р˃0,05 |
Р < 0,05 |
Р ˃ 0,05 |
Примечания:
* – P < 0,05 в сравнении с контрольной группой. P1-2 – различия показателей 1-й и 2-й групп;
Р1-3 – различия показателей 1-й и 3-й групп; Р2-3 – различия показателей 2-й и 3-й групп.
Установлено, что более высокие показатели SP и NT наблюдались при 2-й и, особенно, 3-й степени (2-я и 3-я группы) активности воспалительно-деструктивного процесса в СОТК. При этом уровень VIP находился в обратной зависимости от степени эндоскопической активности ЯК.
Нами был проведен корреляционный анализ между продукцией изучаемых нейропептидов в СОТК и клиническим индексом активности ЯК (индекс Рахмилевича) с использованием непараметрического метода ранговой корреляции Спирмена (табл. 3).
Таблица 3
Взаимосвязь между содержанием SP, NT, VIP в СОТК и показателями индекса клинической активности по Рахмилевичу 
|
Индекс клинической активности (в баллах) |
Коэффициент ранговой корреляции (rs) |
||
|
SP |
NT |
VIP |
|
|
1–5 |
0,566* |
0,433* |
–0,543* |
|
6–15 |
0,595* |
0,693* |
–0,679* |
|
16–30 |
0,792* |
0,758* |
–0,779* |
Примечание. * – P < 0,05.
Выявлена прямая достоверная зависимость между индексом клинической активности и уровнем SP и NT, и обратная – c VIP в СОТК.
В период формирования клинической ремиссии на фоне проводимой терапии (в среднем через 6 недель) отмечалась тенденция к нормализации SP и NT в CОТК. В эти же сроки отмечалось повышение уровня VIP в СОТК, но не до контрольного уровня.
С целью изучения влияния фармакологических препаратов и их комбинаций, используемых в терапии ЯК, на содержание изучаемых нейропептидов больные были разделены на группы в зависимости от вида лечения. Первой группе больных (13 пациентов с легким течением ЯК) назначались препараты 5-аминосалициловой кислоты (5-АСК) в виде монотерапии. Вторая группа (20 пациентов среднетяжелым ЯК) получала комбинацию препаратов 5-АСК с ГКС (преднизолон, метипред, гидрокортизон). Третьей группе (7 больных с тяжелой формой ЯК) назначалась сочетанная терапия гормонами и азатиоприном в рекомендованных дозировках. Четвертую группу составили 5 пациентов с высокой степенью клинической активности ЯК, получившие в дополнение к базисной терапии Инфликсимаб (Ремикейд) по индукционной схеме в дозе 5 мг/кг массы тела.
Установлено (рисунок), что формирование клинической ремиссии ЯК сопровождалось снижением уровня SP и NT и повышением уровня VIP в СОТК у всех больных, независимо от комбинации используемых препаратов. В группе больных тяжелого ЯК c изначально более низкими показателями VIP и более высокими показателями SP и NT в СОТК, рефрактерных к традиционной базисной терапии, после трехкратного внутривенного введения Ремикейда (Инфликсимаба) отмечалась нормализация изучаемых нейропептидов уже на 6-й неделе лечения.
Установленные закономерности в содержании изучаемых нейропептидов в СОТК больных различными клиническими формами ЯК подтверждают их причастность к патофизиологическим процессам в толстой кишке.
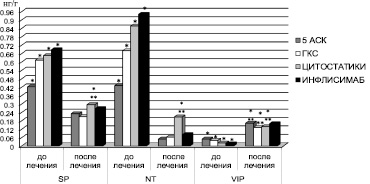
Динамика содержания SP, NT и VIP в CОТК в зависимости от вида лечения: * – P < 0,05 с контролем; ** – P < 0,05 между группами до и после лечения
Известно, что вещество Р высвобождается в ответ на повреждение слизистой толстой кишки [3, 6, 7, 9, 11, 12]. Увеличение экспрессии SP наблюдается как в тканях [5, 6, 7, 9], так и в нервных волокнах толстой кишки больных ЯК [3, 6, 8]. Повышение уровня SP у пациентов с ЯК также коррелирует с активностью заболевания [6, 8]. Эффекты SP опосредованы тремя рецепторами, принадлежащими к суперсемейству G-протеиновых рецепторов: NK-1, NK-2 и NK-3. Исследования на моделях животных четко указывают на важную роль SP и рецепторов NK-1 в патофизиологии ЯК. Провоспалительная активность вещества Р была подтверждена in vivo с использованием нескольких моделей экспериментального колита. Исключительно раннее увеличение числа NK-1-рецепторов наблюдается в слизистой оболочке подвздошной кишки у крыс при воспалении, вызванном токсином А (Clostridium difficile) с особенно возрастающей экспрессией в кишечном эпителии [6, 7, 8, 12], что наблюдалось у больных с Clostridium difficile-ассоциированным колитом [8, 12, 65]. При энтероколите у крыс, индуцированном токсином А (Clostridium difficile), специфический антагонист вещества Р CP-96,345 (Pfizer Diagnostics), блокирующий NK-1-рецепторы, значительно снижал секрецию жидкости, вызванную токсином А, проницаемость маннитола, высвобождение протеазы II тучных клеток, а также подавлял процессы воспаления и повреждения слизистой оболочки [6, 11, 12]. Вероятно, что ФНО-α также вовлечен в эти процессы, так как увеличение содержания этого цитокина в макрофагах собственной пластинки слизистой толстой кишки в ответ на инъекцию токсина А можно было ингибировать in vivo и in vitro при помощи антагониста вещества Р – СР-96,345 [8] или антител к веществу Р [6, 8, 10].
Нейротензин демонстрировал способность активировать несколько типов иммунных и воспалительных клеток посредством взаимодействия с R1 – рецепторами (дегрануляцию тучных клеток в тонкой и толстой кишке; транспорт, фагоцитоз и адгезию нейтрофилов и лимфоцитов, продукцию IL-1β, ПГЕ2), модулируя таким образом кишечное воспаление [4, 6, 8]. На материале in vivo получены доказательства того, что нейротензин участвует в процессах как острого, так и хронического воспаления. Так, при остром колите, индуцированном токсином А (Clostridium difficile), нейротензин активизирует дегрануляцию тучных клеток и усиливает приток нейтрофилов, что способствует более выраженному повреждению тканей [6, 8, 11].
Содержание VIP при патологии кишечника мало изучено. Отмечено снижение содержания VIP в слизистом/подслизистом слое пациентов с БК и ЯК [3, ,7 8]. Эти данные недавно подтвердились в независимых исследованиях биоптатов слизистой, полученных от пациентов с ЯК [3, 5, 7]. Повышение числа VIP-иммунореактивных нервных волокон недавно обнаружено в биоптатах слизистой оболочки пациентов с ЯК, перенесших колпроктэктомию [8].
Положительный эффект используемых лекарственных средств при разнообразных формах ЯК связан с их прямым или опосредованным действием на различные каскады воспаления. Препараты 5-АСК при ЯК способствуют снижению выработки производных арахидоновой кислоты, уменьшают пролиферацию Т-лимфоцитов и антителообразование В-лимфоцитами, блокируют продукцию, рецепторное связывание и эффективность ФНО-α, интерлейкинов [1, 2, 3]. ГКС при ЯК способствуют снижению адгезии лейкоцитов, участвуют в подавлении фагоцитоза, снижении экспрессии молекул адгезии, подавлении продукции антител, ингибиции клеточно-опосредованной цитотоксичности и высвобождения воспалительных медиаторов. Аутоиммунная природа ЯК обусловливает повышенный интерес клиницистов к использоваанию цитостатиков. Азатиоприн, являясь структурным аналогом аденина, гипоксантина и гуанина, входящих в состав нуклеиновых кислот, блокирует клеточное деление и пролиферацию тканей, включаясь в метаболические реакции, нарушает синтез нуклеиновых кислот, конкурирует с гипоксантином и гуанином за гипоксантин-гуанин-фосфорибозилтрансферазу, при участии которой происходит образование тиоинозиновой кислоты из меркаптопурина. Иммунодепрессивное действие азатиоприна направлено преимущественно на реакции замедленной гиперчувствительности и клеточную цитотоксичность.
Биологические методы широко применяют при лечении ЯК [1, 2, 5]. Ингибитор ФНО-α Инфликсимаб оказался способным быстро купировать рецидив, обеспечивать длительную ремиссию и уменьшать потребность в гормонах у значительного числа больных с гормонорезистентными и гормонозависимыми формами ЯК. Использование нами биологической терапии у больных с резистентными формами ЯК привело к нормализации уровней вещества Р, вазоинтестинального пептида и нейротензина в СОТК уже в период формирования клинической ремиссии ЯК. Механизмы, посредством которых ингибиторы ФНО-α подавляют продукцию провоспалительных нейропептидов, в настоящее время изучаются. Известно, что ФНО-α активирует синтез вещества Р в симпатических ганглиях посредством последовательной индукции интерлейкина-1 и фактора ингибирования лейкемии. В то же время SP может усиливать прямые провоспалительные реакции в клетках-мишенях, в том числе секрецию IL-1β, IL-6 и мощных хемоаттрактантов – IL-8 и ФНО-α [6, 8]. Инфликсимаб обладает высокой аффинностью к ФНО-α, быстро связывается и образует устойчивое соединение с обеими его формами (растворимой и трансмембранной), снижая его функциональную активность и подавляя воспалительную реакцию в кишечнике [5, 6, 8].
Полученные данные позволяют считать SP, VIP и NT важными медиаторами нейроиммунных реакций при развитии ЯК. Способность нейропептидов модулировать кишечное воспаление позволяет предположить, что эти вещества могут стать перспективной мишенью в терапии воспалительных заболеваний кишечника.
Выводы
1. В период обострения ЯК содержание SP и NT в СОТК повышено, а VIP – снижено.
2. Показатели вещества P и NT в СОТК больных с тяжелым течением ЯК были наиболее высокими, а уровень VIP наиболее низким.
3. Наиболее высокие показатели SP, NT и наиболее низкие показатели VIP наблюдались в 3-й степени активности воспалительно-деструктивного процесса в СОТК.
4. Содержание SP и NT в СОТК больных активным ЯК находилось в прямой связи с тяжестью ЯК, а показатели VIP – в обратной.
5. Формирование клинической ремиссии ЯК сопровождается снижением содержания SP, NT и повышением уровня VIP в СОТК.
6. Динамика содержания исследуемых нейропептидов зависит от используемых в лечении ЯК лекарственных препаратов.
Рецензенты:
Ткачев А.В., д.м.н., профессор, заведующий кафедрой пропедевтики внутренних болезней Ростовского государственного медицинского университета, г. Ростов-на-Дону;
Гейвандова Н.И., д.м.н., профессор кафедры госпитальной терапии Ставропольского государственного медицинского университета, г. Ставрополь.
Работа поступила в редакцию 09.10.2013.
Библиографическая ссылка
Павленко В.В., Александрова С.Б. НЕЙРОПЕПТИДЫ В МЕХАНИЗМАХ ВОСПАЛЕНИЯ ПРИ ЯЗВЕННОМ КОЛИТЕ // Фундаментальные исследования. – 2013. – № 10-7. – С. 1461-1466;URL: https://fundamental-research.ru/ru/article/view?id=32606 (дата обращения: 19.04.2024).



