В настоящее время антиоксиданты (АО) нашли широкое применение в медицине, в пищевой, косметической и химико-фармацевтической промышленности. Перечень официально разрешенных, нетоксичных АО невелик, преимущественно это природные соединения [2, 6]. Ведется поиск перспективных АО из числа традиционных лекарственных препаратов с целью расширения спектра их фармакологического действия. Создаются новые кинетические модели для тестирования антиоксидантной активности жирорастворимых и водорастворимых соединений в условиях, приближенных к биологическим средам.
Цель исследования – разработка кинетического способа тестирования антиоксидантной активности полифункциональных соединений в условиях каталитического окисления мицеллярных субстратов, приближенных к биологическим средам, изучение антиоксидантной активности ряда лекарственных препаратов в сравнении с реперными антиоксидантами дибунолом (ионолом) и a-токоферолом.
Экспериментальная часть
Антиоксидантную активность (АОА) изучали волюмометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении модельного субстрата метиллинолеата (МЛ), этилолеата (ЭО) в присутствии триметилцетиламмоний бромида (ЦТМАБ) в качестве поверхностно-активного вещества (ПАВ) 1·10–3 М, с добавками раствора хлорида меди (II) в количестве 2·10–3 М при t = (60 ± 0,2) °С. Соотношение липидов и воды составляло 1:3, а общий объем пробы 4 мл [7]. Графическим методом определяли величину периода индукции (ti), представляющую собой отрезок оси абсцисс, отсекаемый перпендикуляром, опущенным из точки пересечения касательных, проведенных к кинетической кривой. Эффективность торможения процесса окисления липидного субстрата определяли совокупностью реакций ингибитора и обозначали как
антиоксидантную активность, количественно определяемую по формуле АОА = τi – τS/τS, где τS и τi – периоды индукции окисления субстрата в отсутствие и в присутствии исследуемого АО соответственно, сравнивали с действием ингибитора, принятого за стандарт. Из наклона кинетических кривых (КК) определяли начальную (Wнач) и максимальную (Wмах) скорости окисления липидного субстрата с добавками АО. Скорость инициирования определяли уравнением Wi = f[InH]/τi, где f – стехиометрический коэффициент ингибирования, [InH] – концентрация ингибитора, τi – период индукции. В качестве стандартных ингибиторов использовали a-токоферол и дибунол, при этом концентрации АО были сравнимыми.
Кинетику накопления гидропероксидов в метилолеате (МО) и линолевой кислоте (ЛК) исследовали в условиях автоокисления методом обратного йодометрического титрования в среде хлорбензола при t = (60 ± 0,2) °С.
Пример математической обработки экспериментальных данных
Полученные в процессе окисления липидных субстратов экспериментальные кинетические кривые описывались функциональными зависимостями методом наименьших квадратов.
Пример. Найдем наилучшее приближение методом наименьших квадратов. Для прямой у = kх + b находим S такое, чтобы для n значений величина суммы квадратов отклонений ![]() была минимальной. Надо, другими словами, выбрать числа k и b так, чтобы величина S была наименьшей.
была минимальной. Надо, другими словами, выбрать числа k и b так, чтобы величина S была наименьшей.
Для этого найдем частные производные для S по k и b и приравняем их нулю:
![]()
и
![]()
Получаем систему уравнений для определения чисел k и b:
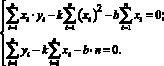
Найдем k и b, для краткости обозначив
![]()
![]()
![]()
![]()
Перепишем систему в новом виде:
![]()
Решаем:
![]()
![]()
В нашем случае нужно подобрать степенную функцию y = axm. Сведем задачу к более простой. Для этого логарифмируем обе части формулы: lg y = m lg x + lg a.
Вводя новые переменные z = lg y и u = lg x, получаем линейную зависимость z = mu + lg a, обрабатывая ее описываемым выше методом наименьших квадратов, находим искомые степень m и коэффициент a. Таким образом, задача сводится к линейной.
Находим ln t, ln V, ln t2 ln tV и сводим в табл. 1. Подсчитывая суммы этих величин, находим A1 A2 A3 A4.
Таблица 1
Параметры кинетических кривых, полученные методом наименьших квадратов
|
t |
V |
ln t |
lnV |
(ln t)2 |
ln t lnV |
V = 0,06t1,20 |
V = 0,05t1,24 |
|
10 |
1 |
2,302585 |
0 |
5,301898 |
0 |
0,950936 |
0,87749 |
|
20 |
2 |
2,995732 |
0,693147 |
8,974412 |
2,076483 |
2,184677 |
2,078764 |
|
30 |
3,2 |
3,401197 |
1,163151 |
11,56814 |
3,956105 |
3,553831 |
3,442791 |
|
40 |
4,5 |
3,688879 |
1,504077 |
13,60783 |
5,54836 |
5,01907 |
4,924571 |
|
50 |
6 |
3,912023 |
1,791759 |
15,30392 |
7,009404 |
6,560172 |
6,500561 |
|
60 |
8 |
4,094345 |
2,079442 |
16,76366 |
8,51395 |
8,164559 |
8,155936 |
|
70 |
10 |
4,248495 |
2,302585 |
18,04971 |
9,782522 |
9,82356 |
9,880384 |
|
80 |
12 |
4,382027 |
2,484907 |
19,20216 |
10,88893 |
11,53079 |
11,66626 |
|
90 |
14 |
4,49981 |
2,639057 |
20,24829 |
11,87526 |
13,28135 |
13,50763 |
|
100 |
16 |
4,60517 |
2,772589 |
21,20759 |
12,76824 |
15,07132 |
15,39976 |
|
110 |
17,8 |
4,70048 |
2,879198 |
22,09452 |
13,53362 |
16,8975 |
17,33875 |
|
120 |
19,8 |
4,787492 |
2,985682 |
22,92008 |
14,29393 |
18,75723 |
19,32133 |
|
130 |
21,7 |
4,867534 |
3,077312 |
23,69289 |
14,97892 |
20,64825 |
21,34472 |
|
140 |
23,5 |
4,941642 |
3,157 |
24,41983 |
15,60077 |
22,56861 |
23,40653 |
|
150 |
25,6 |
5,010635 |
3,242592 |
25,10647 |
16,24745 |
24,51663 |
25,50465 |
|
160 |
27,5 |
5,075174 |
3,314186 |
25,75739 |
16,82007 |
26,49081 |
27,63725 |
|
|
|
|
|
|
|
|
|
|
∑ |
67,51322 |
36,08669 |
294,2188 |
163,894 |
|||
|
A1 |
A2 |
A3 |
A4 |
Вычисляем степень наилучшего приближения
![]()
где n – количество измерений с ненулевым V (в данном случае n = 16)
Вычисляем
![]()
отсюда а = e–2,994881 = 0,050043.
Следовательно, наилучшее приближение V = 0,05t1,24.
Подсчитаем квадратичное отклонение S1 для найденной методом последовательного перебора функции V = 0,06t1,20 и S2 для функции V = 0,05t1,24, найденной методом наименьших квадратов и построим график.
Результаты исследования
и их обсуждение
С целью выбора эффективных катализаторов на процесс окисления липидных субстратов было изучено влияние солей переходных металлов: FeSO4, FeCl3, NiCl2, CoCl2, CuCl2 в широком диапазоне концентраций (10–6–10–1 М) в водно-эмульсионной среде. Установлено, что скорость окисления метиллинолеата в присутствии хлорида меди была выше в 5 раз по сравнению с добавками солей других металлов и при концентрации 2·10–3 М составляла (2,6 ± 0,3)·10–4 М·с–1
(рис. 2). Показано, что скорость каталитического окисления МЛ выше в 1000 раз, чем в безводной среде в присутствии 6·10–3 М азо-бис-изо-бутиронитрила (АИБН), которая в наших экспериментах составляла (2,6 ± 0,3) 10–7М·с–1.
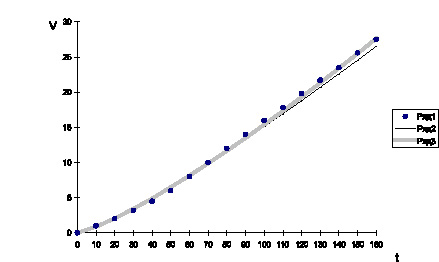
Рис. 1. Кинетические параметры, полученные методом наименьших квадратов
(Ряд 3, S2 = 1,86); полученные методом последовательного перебора функции
(Ряд 2, S1 = 8,46); точками (Ряд 1) обозначены исходные данные
Для выбора оптимальной добавки ЦТМАБ исследовали диапазон концентраций (10-4–10−2) М. Концентрация ПАВ 1·10−3 М оказалась оптимальной, дальнейшее её повышение приводило к снижению скорости окисления. Указанную концентрацию детергента, обеспечивающую наибольшую скорость реакции, можно рекомендовать для использования в гетерогенных моделях окисления. Методом Ребиндера и рефрактометрическим методом была оценена критическая концентрация мицеллообразования ЦТМАБ
(1,0 ± 0,2) 10−3 М, что соответствовало кинетическим данным. Аналогичные закономерности наблюдались при окислении этилолеата. На основе проведенных исследований была предложена новая кинетическая модель экспресс-тестирования антиоксидантов: модельный субстрат содержит эфиры высших ненасыщенных жирных кислот, 2·10−3 М хлорида меди (II) и 1·10−3 М ЦТМАБ в конечной концентрации, соотношение липиды – вода 1:3.
Механизм каталитического окисления липидов в водно-эмульсионной среде сводится к следующему. В присутствии ЦТМАБ формируются мицеллы. Добавки катионного ПАВ усиливают мицеллообразование, при этом катионы внедряются в промежутки между углеводородными «хвостами» с образованием двойного электрического слоя. С выработкой свободных радикалов высших жирных кислот катионы катализатора имеют доступ к гидрофобным хвостам субстрата.
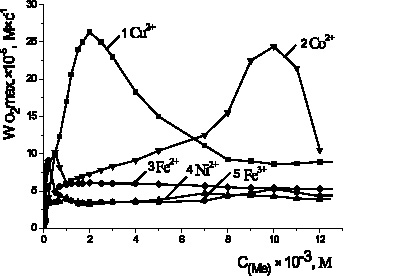
Рис. 2. Зависимость стационарных скоростей окисления метиллинолеата
в присутствии солей катализаторов от их концентраций, М:
1 – CuCl2; 2 – CoCl2; 3 – Fe2SO4; 4 – NiCl2; 5 – FeCl3, 1·10−3 М ЦТМАБ, t = 60 °С
В присутствии катализатора известны следующие реакции зарождения цепей [4]:
RH + Cu2+ → R● + Cu1+ + H+
ROOH + Cu1+ → RO● + OH● + Cu2+
ROOH + Cu2+ → RO2● + H+ + Cu1+
Возможно участие катализатора в продолжении цепей:
RO2● + Cu2+ + H2O → RO● + Cu(OH)2
RO● + RH → R● + ROOH
Новая кинетическая модель экспресс-тестирования антиоксидантной активности была изучена на примере 15 соединений в зависимости от концентрации
(1·10-8–1·10−1) М и структуры, без учета спектра их фармакологического действия. Ряд производных фенола составили: салициловая кислота, парацетамол, осалмид. Ряд производных пирокатехина представляли: адреналин, метилдофа. В качестве гетероциклических производных использовались: фентоламин, аллопуринол, эмоксипин. В составе аминов исследовали: новокаин, коринфар. В качестве серосодержащего соединения изучали капотен. Реперными АО послужили a-токоферол и дибунол, полупродуктами – фенол, пирокатехин.
В соответствии с теорией [5], ингибиторы условно делятся на сильные и слабые. Сильные ингибиторы эффективно тормозят окисление, участвуя только в реакциях обрыва цепей. Кинетика такого процесса характеризуется периодом полного торможения, аутоускорением и достижением максимальной скорости. Слабые ингибиторы способны не только обрывать цепи, но из-за высокой активности своих радикалов участвовать в реакциях продолжение цепей. Кинетика такого процесса характеризуется отсутствием периода полного торможения, достаточно высокими начальными скоростями, аутоускорением на определенном уровне окисления, достижением максимальной скорости.
Для доказательства свободнорадикального механизма каталитического окисления липидного субстрата использован метод ингибиторов. Проведено исследование закономерностей окисления модельного субстрата (МЛ, ЭО) в присутствии добавок стационарных ингибиторов окисления дибунола и a-токоферола. По результатам эксперимента рассчитаны кинетические параметры окисления субстратов.
Установлен идентичный характер кинетических кривых окисления ЭО в растворе хлорбензола в присутствии 6·10−3 М инициатора АИБН и водно-липидной системе в присутствии 2·10−3 М хлорида меди (II) при различных концентрациях дибунола. Показано, что дибунол проявлял себя как сильный ингибитор: наблюдался период полного торможения, период аутоускорения и достижение максимальной скорости окисления. Периоды индукции увеличивались пропорционально увеличению концентрации дибунола. По наклону прямой в координатах t, [InH] была рассчитана скорость инициирования в обеих системах, получены значения 6,2·10-8
и 6,7·10-5 М·с–1 в безводной и водно-липидной системе соответственно. Сравнение максимальных скоростей окисления ЭО при t = (60 ± 0,2) °С в безводной и водно-липидной средах равных 1,3·10-7 и 1,4·10-4 М·с–1, соответствовало различию скоростей инициирования ~ в 1000 раз.
Известно, что a-токоферол характеризуется высокой константой скорости реакции с пероксильными радикалами
k7 = (3,3–3,5)·106 М–1·с–1 [3], что на два порядка превышает аналогичные константы скорости для дибунола k7 = 1,40·104 М–1·с–1. Между тем вопрос о роли a-токоферола в биомембранах далек от своего решения. Известен сложный механизм действия a-токоферола в безводных углеводородных и липидных субстратах, его участие не только в реакциях обрыва цепей, но и реакциях продолжения цепей и распаде гидропероксидов. Последние реакции приводят к снижению антиоксидантной активности a-токоферола. Анализ кинетических кривых окисления этилолеата с добавками АО показал существенные отличия механизма действия a-токоферола от дибунола в зависимости от концентраций. С увеличением концентрации a-токоферола наблюдалась инверсия антиоксидантного действия (рис. 3), при этом увеличивалась максимальная скорость окисления. Причиной ускорения процесса может быть комплексообразование OH-группы a-токоферола с катионами меди. В процессе окисления a-токоферол образует достаточно активные токофероксильные радикалы (In·), способные участвовать в побочных реакциях продолжения цепей с молекулами субстрата (RH) [3]:
In· + RH → R· + InH
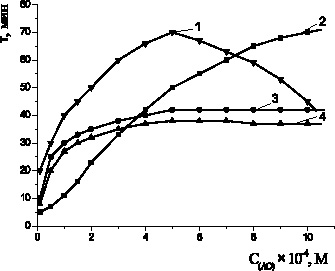
Рис. 3. Зависимости периода индукции от концентрации АО: 1 – a-токоферол; 2 –пирокатехин; 3 – адреналин; 4 – метилдофа; 2·10–3 М CuCl2,субстрат окисления – этилолеат, t = 60 °С
В качестве аминофенолов в настоящей работе были изучены производные пирокатехина: адреналин и метилдофа.
Известно [1], что аминосодержащие соединения способствуют разрушению гидропероксидов с образованием молекулярных продуктов согласно схеме:
первичные амины ROOH + R′–CH2NH2 → ROH + R′–CH = NH + H2O
вторичные амины ROOH + (R′–CH2)2NH → ROH + R′–CH = NH–CH2–R + H2O
третичные амины ROOH + (R′–CH2)3N → ROH + R′–CHO + (R′–CH2)2–NH
Скорость реакции падает в ряду: третичные > вторичные > первичные.
Пирокатехин существенно тормозил окисление этилолеата только при концентрациях 1·10−2 М и выше. При концентрации пирокатехина 1·10-4 М происходило ускорение, а при концентрации 1·10−3 М – замедление процесса, наблюдался период индукции, период аутоускорения и достижения максимальной скорости окисления (рис. 3, табл. 2). Вероятно, ускорение процесса обусловлено активацией катализатора за счет комплексообразования с солями меди. При концентрации пирокатехина 1·10−2 М его соотношение с катализатором составляет 5:1. В этих условиях большая часть пирокатехина не задействована в комплексообразовании и проявляет антиоксидантную активность. Кинетические кривые с добавками адреналина и метилдофа принимали другой характер: наблюдались небольшие периоды индукции и снижение максимальной скорости процесса окисления в 3–6 раз по сравнению с контролем. Такой характер КК предполагает подавление антиоксидантных свойств фенольного гидроксила за счет образование хелатных комплексов с катионами меди (II) и проявление ингибирующего эффекта только за счет аминогруппы. Снижение начальной скорости окисления указывает на участие соединений в реакциях обрыва цепей. Снижение максимальной скорости окисления (табл. 2) может свидетельствовать об участии соединений в реакциях с гидропероксидами с образованием молекулярных продуктов. На рис. 3 показаны зависимости периодов индукции антиоксидантов от их концентраций: наблюдалась экстремальная зависимость с максимумом в 5·10–4 М для a-токоферола, для пирокатехина периоды индукции возрастали практически линейно с увеличением концентрации соединения, периоды индукции адреналина и метилдофа возрастали до 5·10–4 М и в этом промежутке концентрации не изменялись.
Осалмид проявлял высокую антиоксидантную активность по сравнению с фенолом, салициловой кислотой и парацетамолом в соизмеримых концентрациях (рис. 4). Высокая ингибиторная активность осалмида обусловлена акцепторным характером заместителя в пара-положении, наличием p-р-сопряжения между амино-группой и фенолом. В парацетамоле донорный заместитель содержится в пара-положении. В салициловой кислоте антиоксидантная активность может снижаться за счет акцепторного характера карбоксильной группы. Исследуемые добавки осалмида и парацетамола уменьшали начальную и максимальную скорости окисления в 2–5 раз по сравнению с контролем (табл. 2).
Таблица 2
Кинетические параметры окисления этилолеата и метиллинолеата в водно-липидной среде в присутствии С(CuCl2) = 2·10–3 М, С(АО) = 1·10−3 М, t = 60 °С
|
№ п/п |
Название антиоксиданта |
τi, мин |
Wнач 10–5, М·с–1 |
Wmax·10–5, М·с–1 |
|
1 |
Контроль ЭО |
15 |
7,5 |
14,0 |
|
2 |
Фенол |
50 |
2,5 |
4,0 |
|
3 |
Салициловая кислота |
35 |
5,1 |
11,9 |
|
4 |
Парацетамол |
40 |
2,5 |
3,1 |
|
5 |
Осалмид |
350 |
0,6 |
2,7 |
|
6 |
Пирокатехин |
70 |
5,1 |
14,2 |
|
7 |
Адреналин |
40 |
2,1 |
4,5 |
|
8 |
Метилдофа |
35 |
3,4 |
5,1 |
|
9 |
Фентоламин |
20 |
6,8 |
13,8 |
|
10 |
Аллопуринол |
70 |
3,5 |
5,5 |
|
11 |
Эмоксипин |
55 |
1,0 |
3,5 |
|
12 |
Новокаин |
50 |
6,5 |
7,6 |
|
13 |
Коринфар |
50 |
3,9 |
5,0 |
|
14 |
Дибунол |
600 |
1,0 |
8,0 |
|
15 |
a-Токоферол |
45 |
4,3 |
16,8 |
|
16 |
Контроль МЛ |
5 |
14,4 |
26,3 |
|
17 |
Капотен* |
45 |
3,6 |
17,1 |
Примечание: * – субстрат окисления метиллинолеат.
Общим в эффекте всех аминов и аминофенолов является снижение максимальной скорости процесса пропорционально увеличению концентрации. Различие в эффекте состоит в том, что в присутствии одних аминов при различных концентрациях происходит окисление без периода индукции и периода аутоускорения. В присутствии других аминов наблюдаются периоды индукции и периоды аутоускорения. К аминам первой группы относятся новокаин, парацетамол, фентоламин. К аминам второй группы относятся адреналин, метилдофа, эмоксипин, аллопуринол, коринфар. Идентичный характер эффекта аминов и аминофенолов свидетельствует о том, что активность фенольного гидроксила полностью подавлена, возможно, за счет образования хелатов с катионами меди (II). Низкая АОА фентоламина может быть обусловлена нарушением сопряжения из-за объемного заместителя в положении 3. В эмоксипине в положении 2 и 4 по отношению к гидроксилу расположены донорные алкильные заместители.
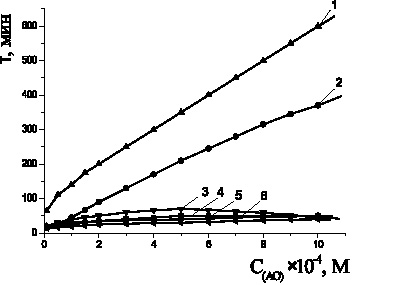
Рис. 4. Зависимости периода индукции от концентрации антиоксидантов в водно-липидной среде: 1 – дибунол; 2 – осалмид; 3 – a-токоферол; 4 – фенол; 5 – парацетамол; 6 – салициловая кислота; 2·10–3 М CuCl2, субстрат окисления – этилолеат, 2·10−3 М CuCl2, t = 60 °С
Капотен – производное пролина с отдаленной боковой меркаптогруппой. Химическая структура капотена позволяет прогнозировать его ингибирующую активность за счет разрушения гидропероксидов меркаптогруппой или хелатирования катализатора. Все добавки капотена тормозили процесс окисления. Снижение скорости окисления под влиянием капотена обусловлено его конкурентным участием с катализатором в молекулярном распаде гидропероксидов:
RO2· + R1–SH → ROOH + R1–S·
ROOH + R1–S–R2 → R1–SO–R2 + ROH
ROOH + Cu2+ → RO2· + H+ + Cu1+
Для подтверждения гипотезы о возможном разрушении гидропероксидов под действием АО были проведены эксперименты по тестированию кинетики накопления гидропероксидов (ROOH) с добавками в частично окисленный субстрат (время эксперимента 8 часов) каждого из исследуемых АО. После внесения ингибитора в течение первого часа наблюдалось снижение концентрации гидропероксидов, в контрольном опыте ROOH продолжали накапливаться. Установлено, что все исследуемые соединения способствовали разрушению гидропероксидов на 50–75 %. Таким образом, указанные методы адекватно оценивают свойства исследуемых соединений и позволяют полагать, что разрушение гидропероксидов под их действием осуществлялось нерадикальным путем, поскольку вторичного инициирования процесса не наблюдалось.
Выводы
1. Разработана кинетическая модель экспресс-тестирования антиоксидантов в водно-липидной каталитической среде, выбраны оптимальные концентрации катализатора и поверхностно-активного
вещества.
2. Получен ряд каталитической активности солей металлов переменной валентности: Cu2+ > Co2+ > Fe2+ > Fe3+ > Ni2+.
3. Показан идентичный механизм действия стационарного антиоксиданта дибунола при окислении безводных и водно-эмульсионных липидных субстратов.
4. Получен ряд увеличения антиоксидантной активности лекарственных препаратов: фентоламин < салициловая кислота < новокаин < аллопуринол < парацетамол < коринфар < метилдофа < адреналин < a-токоферол < эмоксипин < капотен < осалмид < дибунол.
5. Показана возможность полифункциональных соединений снижать максимальную скорость окисления в 2-6 раз по сравнению с контролем.
6. Установлено, что полифункциональные соединения в процессе окисления способны разрушать гидропероксиды молекулярным путем. Вероятно, что способность разрушения гидропероксидов связана с наличием амино-, амидной или меркаптогруппы.
7. Установлено, что синтетический ингибитор окисления дибунол в водно-липидной среде превосходит по своему действию природный антиоксидант a-токоферол.
8. Выявлены слабые антиоксидантные свойства у адреналина и метилдофа в водно-липидных катализируемых субстратах, уступающие пирокатехину.
Рецензенты:Ерёмин Д.И., д.б.н., профессор кафедры почвоведения и агрохимии, ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень;
Грехова И.В., д.б.н., профессор кафедры общей химии, ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень.
Работа поступила в редакцию 21.01.2014.
Библиографическая ссылка
Перевозкина М.Г. КИНЕТИКА КАТАЛИТИЧЕСКОГО ОКИСЛЕНИЯ МИЦЕЛЛЯРНЫХ СУБСТРАТОВ В ПРИСУТСТВИИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ РАЗЛИЧНОГО ФАРМАКОЛОГИЧЕСКОГО ДЕЙСТВИЯ // Фундаментальные исследования. – 2014. – № 3-1. – С. 68-75;URL: https://fundamental-research.ru/ru/article/view?id=33587 (дата обращения: 19.04.2024).



