Организм животных в промышленных комплексах постоянно подвергается действию стрессовых факторов, среди которых ведущее место принадлежит действию шумовых механизмов [1, 3, 4]. Это отражается на всех системах организма и, прежде всего на иммунной, что в последующем способствует снижению продуктивных и репродуктивных показателей животных [2, 5]. В этой связи были проведены опыты на крысах. Целью настоящих исследований явилось: изучить особенности иммунных реакций как адаптивно-регуляторных механизмов при действии на организм крыс КСФ и ДСФ и установить возможности их восстановления маточным молочком в комплексе с необработанным янтарем, со сравнительной оценкой:
а) естественной резистентности и фагоцитарной активности нейтрофилов крови и альвеолярных макрофагов;
б) динамики изменения показателей Т- и В- систем иммунитета (тЕ-РОК, ЕМ-РОК, рЕ-РОК, сЕ-РОК, аЕ-РОК, вЕ-РОК);
в) продукции сывороточных иммуноглобулинов (IgM, IgG, IgE), циркулирующих иммунных комплексов (ЦИК), мононуклеарных клеток периферической крови, иммуноферментированных с помощью моноклональных антител.
Материал и методы исследований
Опыты проводились на крысах, которые по принципу аналогов были разделены на 7 групп. Крыс содержали в янтарном ящике из янтарных планшет, каждая из четырех сторон которой, размером 60х60см, создает поток легких отрицательных ионов на расстоянии 1,5 м в 2833 ион//см3/с. Животные 1 группы были контрольные. Крысы 2 группы подвергались действию кратковременного стрессового фактора (КСФ), 3 группы – длительного стрессового фактора (ДСФ). Животные 4 и 5 групп на фоне КСФ и ДСФ находились под влиянием аэроионов янтаря (лёгких отрицательных ионов, фитонцидов необработанного янтаря и аэрозолей янтарной кислоты), которые выделялись от янтарных планшет и дополнительно в их рацион вносили янтарный порошок в дозе 0,25 г на голову, 1 раз в день, с кормом, ежедневно в течение 30 дней. Измерение количества легких отрицательных ионов в янтарном ящике для крыс проводили с использованием счетчика аэроинов САИ ТГУ-70 ИТ 6914. С крысами 6 и 7 групп, на фоне КСФ и ДСФ, проводили те же манипуляции, что и с животными 4 и 5 групп и дополнительно в рацион животных этих групп вносили маточное молочко пчел из расчета 0,5 г (таблетки «Апилака») в день на животное, в течение 15 дней эксперимента, из шприца со шлангом, предварительно растворив в слабощелочной воде для предупреждения разрушения его желудочным соком).
КСФ и ДСФ создавали путем включения механизма с высоким уровнем шума (120 дБ). Источником шума в 120 дБ служил электрический отбойный молоток Sparky K 615CE (1300 Вт; 1900–3000 уд./мин, 15 Дж). Измерение шума осуществляли шумометром профессиональным АR 844 c USB интерфейсом (диапазон измерения от 30–130 дБ).
Бактерицидную активность сыворотки определяли по П.А. Емельяненко (1980), лизоцимную – по В.Г. Дорофейчуку (1977). При определении фагоцитарной активности лейкоцитов объектом фагоцитоза служила суточная культура Staphylococcus aureus. Определение Т- и В-лимфоцитов в крови крыс проводили методом спонтанного розеткообразования, популяций Т-лимфоцитов – в реакции розеткообразования с теофиллином (S. Limatibul et al., 1978). Для оценки функционирования В-системы иммунитета определяли концентрацию иммуноглобулинов (G, A, Е классов) в сыворотке крови методом радиальной иммунодиффузии в геле по G. Mancini с соавт. (1981). Иммунофенотипирование мононуклеарных клеток периферической крови проводили с использованием мононоклональных антител (МКА) серии ИКО-10, ИКО-124 методом непрямой реакции иммунофлюоресценции (РИФ).
Статистическая обработка полученных данных проводилась по общепринятым методикам. Расчет результатов осуществляли с применением пакета прикладных программ Statistica 6.0 (for Windows; «Stat Soft Inc», США).
Результаты исследований и их обсуждение
Состояние иммунной системы изучалось в опытах на крысах. КСФ и ДСФ в начале действия оказывали стимулирующее действие на выработку лизоцима. Через 30 мин описываемый показатель в сыворотке крови крыс опытных групп не имел существенных изменений и соответствовал физиологическому уровню. Однако уже через 3 ч регистрировалось повышение активности лизоцима. Через 24 ч и, особенно, через 48 ч регистрировалась дальнейшая активизация лизоцимной активности сыворотки крови крыс, и она была на этот период максимальной. К 7 и 30 сут опыта отмечалось резкое снижение лизоцимной активности сыворотки крови крыс 3, 5 и 7 групп. Такое явление также свидетельствует о неблагоприятном развитии защитных реакций, о его дисбалансе. Лизоцимная активность сыворотки крови крыс 3, 5 и 7 групп к 30 сут опыта была ниже контрольных цифр в 1,37; 1,19 и 1,1 раза. Значение описываемого показателя в организме крыс 2, 4 и 6 групп, в которых животные подвергались кратковременному стрессу, эти изменения были умеренными. Подобно динамике лизоцимной активности сыворотки крови изменялась бактерицидная активность и фагоцитарная активность альвеолярных макрофагов (рис. 1).
Стресс способствовал проявлению всех защитных механизмов Т- и В-систем иммунитета, о чем свидетельствует динамика в организме животных не только т-Е-РОК-лимфоцитов (Т-активных), но и высокоавидных Т-индукторов-киллеров (РЕ-РОК-лимфоцитов), тимических – лимфоцитов (сЕ-РОК-лимфоцитов), посттимических предшественников функционально зрелых Т-клеток (аЕ-РОК-лимфоцитов), киллеров-супрессоров (вЕ-РОК-лимфоцитов) и ЕМ-лимфоцитов (рис. 2).
Стресс оказывал существенное влияние на активность тЕ-РОК-лимфоцитов в организме крыс. Содержание тЕ-РОК-лимфоцитов в крови крыс 2 группы через 3 часа от действия стресс-фактора по всем опытным группам превысило контрольную цифру на 8,0–10,0 %. Через 24 и 48 часов отмечалось резкое повышение данного показателя в крови крыс всех опытных групп.
К 7 сут наблюдалось резкое снижение уровня тЕ-РОК-лимфоцитов в крови крыс опытных групп. Значение описываемого показателя уступало данным крыс контрольной группы на этот срок опыта по 2, 3, 4, 5, 6, 7 группам на 39,0; 59,7; 34,8; 49,2; 32,0 и 42,2 %. В последующие сроки эксперимента по всем опытным группам регистрировалось повышение в крови уровня тЕ-РОК-лимфоцитов. Этот процесс имеет разную степень проявления и выраженности в зависимости от типа стресса и проведенных дополнительных профилактических манипуляций с необработанным янтарем и маточным молочком. Через 30 сут от начала опытов содержание тЕ-РОК-лимфоцитов в крови крыс 2 группы уступало показателю контроля на 11,1 %, 3 группы – на 27,0 %, 4 группы – на 4,2 %, 5 группы – на 80,8 %, 6 группы – достигло контрольного уровня, 7 группы – было ниже, чем в контроле на 16,8 %. Эта динамика продолжалась и к 60 сут эксперимента. В конце опыта (90 дней) содержание тЕ-РОК-лимфоцитов в крови крыс 4 и 6 групп значительно приблизилось к контрольной цифре и соответствовало физиологическим параметрам, а показатели животных 2, 3, 5 и 7 групп были несколько ниже его значения.
КСФ и ДСФ вызвали в организме животных снижение антителогенеза. Данный процесс в отношении IgМ прогрессировал до 48 ч. В последующем регистрировалось постепенное повышение описываемого показателя в сторону его физиологического значения. Уже через 3 ч содержание IgМ в сыворотке крови крыс 2, 3, 4, 5, 6, 7 групп снизилось, по сравнению с контролем на 26,1; 10,8; 11,8; 15,0; 20,3; 11,8 %, через 24 ч – на 23,9; 29,4; 21,1; 27,1; 19,3 и 24,3 %. Максимальное снижение уровня IgМ регистрировалось в опытных группах через 48 ч. К этому сроку исследований описываемый показатель уступал контрольной цифре на 23,7; 31,3; 21,8; 28,0; 18,5; 24,2 %.
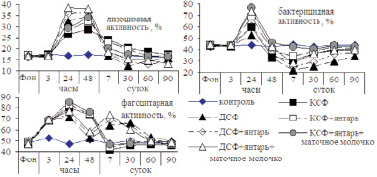
Рис. 1. Лизоцимная, бактерицидная активность сыворотки крови и фагоцитарная активность альвеолярных макрофагов крыс
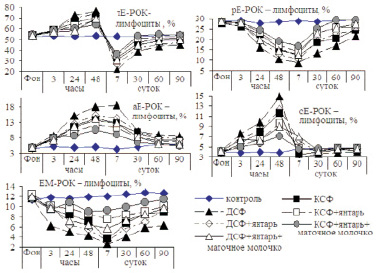
Рис. 2. Динамика т-Е-РОК, рЕ-РОК, аЕ-РОК, сЕ-РОК, ЕМ-РОК – лимфоцитов в крови крыс
В последующие сроки опыта наблюдалось постепенное повышение данного показателя в сторону контрольных цифр. Однако они продолжали уступать показателям животных контрольной группы. К 7 сут исследований содержание IgМ в сыворотке крови крыс 2, 3, 4, 5, 6 и 7 групп уступало контролю, на данный срок опыта, соответственно на 15,1; 23,7; 12,1; 18,2; 4,7 и 12,1 %, через 30 сут – на12,0; 26,3; 5,4; 16,0; 3,2 и 22,1 %. Данная тенденция сохранялась и к 60 и 90 сут опыта содержание IgМ в сыворотке крови крыс 2, 3, 4, 5, 6, 7 опытных групп было ниже, чем в контроле на 13,3 и 11,3 %; на 20,2 и 15,6 %; на 8,2 и 5,6 %; 15,5 и 13,9 %; 2,2 и 0,9 %; 13,7 и 8,7 %. Подобно динамике IgМ в сыворотке крови животных на фоне действия КСФ и ДСФ изменялась динамика содержания IgG.
Данные по изучению динамики изменения содержания в сыворотке крови крыс IgЕ приведены в таблице.
Динамика содержания в крови крыс IgE (тыс./мкл)
|
Группы животных |
Фон |
30 мин |
Сроки исследования от начала опытов |
||||||
|
часы |
сутки |
||||||||
|
3 |
24 |
48 |
7 |
30 |
60 |
90 |
|||
|
1 |
57,30 |
61,40 |
58,30 |
60,80 |
59,60 |
56,80 |
62,70 |
57,60 |
61,60 |
|
2 |
62,30 |
64,80 |
89,6*** |
106,6*** |
124,9*** |
118,3*** |
98,7*** |
80,4*** |
72,60* |
|
3 |
58,60 |
65,90 |
86,0*** |
139,3*** |
168,3*** |
172,5*** |
157,9*** |
126,0*** |
108,6*** |
|
4 |
59,00 |
64,80 |
82,50*** |
95,70*** |
115,70*** |
96,50*** |
71,00** |
62,90 |
59,70 |
|
5 |
60,40 |
65,10 |
80,00*** |
128,90*** |
149,70*** |
153,00*** |
129,6*** |
112,7*** |
85,90*** |
|
6 |
56,90 |
64,30 |
78,90*** |
90,50*** |
100,80*** |
82,90*** |
61,90 |
59,50 |
60,50 |
|
7 |
61,50 |
65,80 |
80,00*** |
121,80*** |
128,70*** |
134,80*** |
102,6*** |
86,70** |
70,80** |
Примечания: * – Р ‒ 0,95, ** – Р – 0,99, *** – Р ‒ 0,999.
Стресс способствовал значительной активизации в организме животных ЦИК. Более выраженным этот процесс был под действием ДСФ. Через 30 мин от начала эксперимента уровень ЦИК в сыворотке крови животных 2, 3, 4, 5, 6 и 7 групп повысился на 6,0; 6,0; 8,0; 5,0 и 5,0 МЕ/мл, через 3 сут – на 26,0; 28,0; 24,0; 30,0; 25,0 и 26,0 МЕ/мл. В последующие сроки эксперимента процесс накопления в организме крыс опытных групп ЦИК интенсивно продолжался. Максимальное повышение содержания ЦИК в крови крыс всех опытных групп регистрировалось, с разной степенью активности, через 48 ч. На 7 сут исследований его содержание несколько снизилось в группах при действии КСФ, но продолжало повышаться в группах под влиянием ДСФ, за исключением 7 группы (ДСФ). При этом по всем опытным группам он еще значительно превышал физиологические значения. На 30, 60 сут по всем опытным группам отмечалось, в разной степени проявления и активности, снижение содержания в сыворотке крови уровня ЦИК. До конца опыта (90 сут) уровень ЦИК динамично снижался. При действии КСФ данный показатель по 2 группе значительно приблизился к контрольному уровню, по 4 и 6 группам – восстановился и соответствовал физиологическим нормам. Показатели ЦИК в организме крыс, подвергнутых действию ДСФ (3, 5 и 7 группы), по сравнению с предыдущими сроками исследований, значительно приблизились к контрольным уровням, но превышали их в 1,57; 1,44 и 1,21 раза.
Заметным проявлением стресса было на динамику выработки в организме крыс моноклональных антител. МКА серии ИКО-124 в крови крыс 2 и 3 групп значительно снизились и через 48 ч от начала эксперимента были ниже показателя животных контрольной группы на 3,2 и 3,0 %, через 7 сут на 4,9 и 8,6 %, через 30 сут на 3,2 и 11,6 %, через 60 сут на 2,1 и 8,9 %. Содержание моноклональных антител серии ИКО-124 в крови крыс 6 и 7 групп имело тенденцию к повышению. Наиболее выраженным данный процесс был по 6 группе. При этом показатели животных 6 группы с 7 дня эксперимента превысили контрольный уровень. В крови крыс 7 группы они увеличились, по сравнению с показателями животных 3 группы, через 2, 7, 30 и 60 сут на 1,7; 4,9; 9,5 и 10,5 %, но не достигали показателя животных контрольной группы. Подобно динамике изменения содержания в сыворотке крови животных МКА серии ИКО-124 изменялась динамика МКА серии ИКО-10.
Заключение
1. Применение необработанного янтаря в комплексе с маточным молочком пчел на фоне действия на организм животных ДСФ способствует активизации механизмов иммунной защиты, проявляющихся в виде:
а) стабилизации факторов естественной резистентности (бактерицидной и лизоцимной активности сыворотки крови), фагоцитарной активности лейкоцитов крови и альвеолярных макрофагов;
б) восстановления уровня иммунокомпетентных клеток в крови: повышение содержания т-Е-РОК-лимфоцитов, рЕ-РОК-лимфоцитов (индукторов-хелперов); сЕ-РОК-лимфоцитов (тимические); ЕМ-лимфоцитов, на фоне снижения активности вЕ-РОК-лимфоцитов (киллеры-супрессоры) и аЕ-РОЕ-лимфоцитов (посттимические предшественники функционально зрелых Т-лимфоцитов);
в) нормализации уровня сывороточных иммуноглобулинов и ЦИК до значения их физиологических норм: содержание IgG повышается в 1,3; IgM в 1,08 раза, уровень IgE и ЦИК снижается в 1,53 и 1,29 раза;
г) активизации продукции МКА серии ИКО-124 в 2,0 раза, серии ИКО-10 – в 1,54 раза.
Рецензенты:
Емцев В.Т., д.б.н., профессор кафедры микробиологии и иммунологии (факультет почвоведения, агрохимии и экологии), ФГБОУ ВПО «Российский государственный аграрный университет – МСХА имени К.А. Тимирязева», г. Москва;
Храмцов В.В., д.с.-х.н., (зооинженерный факультет), ФГБОУ ВПО «Российский государственный аграрный университет – МСХА имени К.А. Тимирязева», г. Москва;
Юров Ю.Б., д.б.н., профессор, заведующий лабораторией, УРАМН Научный центр психического здоровья Российской академии медицинских наук, г. Томск.
Работа поступила в редакцию 11.02.2014.
Библиографическая ссылка
Маннапова Р.Т., Рапиев Р.А. ПОКАЗАТЕЛИ ИММУННОГО ОТВЕТА В ОРГАНИЗМЕ ЖИВОТНЫХ КАК АДАПТИВНО-РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ НА СТРЕСС // Фундаментальные исследования. – 2014. – № 3-3. – С. 500-504;URL: https://fundamental-research.ru/ru/article/view?id=33703 (дата обращения: 19.04.2024).



